fehérjegomoly* domain (domén) a fehérjében elkülönülő 40–250 (általában 41–100)
aminosav nagyságú, önállóan (a fehérjék többi részétől függetlenül)
feltekeredő, állandósult, tömör, jellegzetes térszerkezetű, a másodlagos és a
harmadlagos szerkezeti szint közötti egység. Szokásosan β-kanyarokkal
összekötött α-csavarulat, β-lemez vagy ezek együttesének valamilyen
változatából áll. Általában a fehérjék feladatának, kapcsolódásainak a
megvalósítója, de van olyan is, amelynek elkülönült saját működése van – ez teszi
lehetővé, hogy a fehérjék többféle feladatot is ellássanak, többféle fehérjével
is kapcsolatba léphessenek, és összehangolt hálózatot hozzanak létre. Egyes
gomolyokban előfordul más molekula is, például. fémion (hemoglobin). Általában
egy képező kódol egy gomolyt, de előfordul, hogy a közteskivágódás
következtében összevágódott több képező hozza létre.
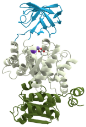 A legkisebb fehérjékben egy gomoly van, a nagyokban
akár száz is lehet. A magasabb rendű szervezetekben a fehérjék rendszerint több
gomolyt tartalmaznak jól elkülönülve; szokásosan más-más feladattal, például az
egyikkel kapcsolódik, a másik a feladatát hajtja végre. (Az ábrán a
háromgomolyos piruvát-kináz látható; forrás: Wikipédia.) Számos gomoly többféle
fehérjében is megtalálható; ezek működése különböző lehet. Vannak több egyforma
gomolyt tartalmazó fehérjék is. Nem egy gomoly csak kettőst képezve hatásos.
A legkisebb fehérjékben egy gomoly van, a nagyokban
akár száz is lehet. A magasabb rendű szervezetekben a fehérjék rendszerint több
gomolyt tartalmaznak jól elkülönülve; szokásosan más-más feladattal, például az
egyikkel kapcsolódik, a másik a feladatát hajtja végre. (Az ábrán a
háromgomolyos piruvát-kináz látható; forrás: Wikipédia.) Számos gomoly többféle
fehérjében is megtalálható; ezek működése különböző lehet. Vannak több egyforma
gomolyt tartalmazó fehérjék is. Nem egy gomoly csak kettőst képezve hatásos.
A gomolyok szerkezetét a másodlagos szerkezeti jelekkel és a mintázatokkal írjuk le – sokszor hozzátesszük a tekervényeket is. Bármily jellegzetesek is valamely egység mintázatai, azokból nem következtethetünk a működésére, mert előfordulhat más egységekben és a polipeptid nem tevékeny területein is.
Nemzetközi nevükben gyakorta szerepel a homology (hasonlóság) szó, utalva arra, hogy a gomoly szerkezete hasonló az abban a fehérjében lévőéhez, amelyben felfedezték. Például: PH-gomoly (pleckstrin homology domain), amelyet a pleksztrin fehérjében ismertek fel. Egyébként a nevüket általában betűszóval jelöljük. A gomolyokat síkban henger vagy doboz alakúnak ábrázolják – sokszor nevezik is őket az angol irodalomban boxoknak. Sokféle gomoly ismert. Jellegzetesebb csoportjaik:
▪ DNS-kötő gomolyok* (DNA binding domains) a DNS egyes szakaszait fajlagosan azonosítva kötődnek a DNS-sel. Szokásosan az átírásfehérjékben és a DNS-hibajavító fehérjékben találhatók. (→DNS-kötő gomolyok)
▪ Fehérjekapcsolati gomolyok* (protein interaction domains), protein–protein interaction domains, modular protein domains, protein modules a fehérjék közötti kapcsolatokat hozzák létre. Sokféle fehérjében megtalálhatók; egyazon fehérjében gyakran több is van. A fehérjekapcsolati gomolyok 40–200 aminosavat tartalmaznak, és rövid (3–6 aminosavból álló), vonalas mintázatokat (aminosavsorokat) ismernek fel (sormintázat*), ezekkel kapcsolódnak. A gomoly néhány aminosava létesít közvetlen kapcsolatot a társuló fehérjén felismert aminosavakkal, gyenge kötésekkel. Az SH2 gomoly például ~100 aminosavból áll, és foszfotirozint tartalmazó mintázatot ismer fel. Ugyancsak foszfotirozint azonosít a PTB (phosphotyrosine binding), de más mintázatban állót, mint az SH2. Az SH3 viszont többprolénes, 8–10 aminosavból álló ismétlődéseket vesz észre. Az azonosító mintázat nemcsak a kapcsolódást, hanem a ráhatást is irányíthatja, például, hogy melyik aminosav foszforileződjék. Bizonyos gomolyok a pozitív és negatív töltések elrendeződése (mintázata) szerint kapcsolódnak, és fejtik ki hatásukat – ilyen a PB1 (Phox and Bem 1) gomoly. Mintegy 85 féle fehérjekapcsolati gomolyt ismerünk. (→fehérjekapcsolódás)
▪ Kettősödési gomolyok* (dimerization domains) Bizonyos fehérjék csak kettőst képezve hatékonyak; kettősödhetnek önmagukkal (azonos kettős, homologic dimer) vagy más fehérjével (felemás kettős, heterologic dimer).
TRFH (TERF Homology Domain) a TERF1 (telomere repeat binding factor 1) vagy a TERF2 (telomere repeat binding factor 2) önmagával való kettősödését hozza létre. Sajátos négyes szerkezet jön létre. Állványként is szolgál más fehérjék társulásához, pl. RAP1. (→RAP1, TERF1, TERF2)
▪ Négyesítő gomolyok* (tetramerization domains) négy fehérjét összekapcsoló gomoly. Egyes fehérjék, például a p53, csak négyest alkotva hatékonyak; négy p53 fűződik egybe bennük (homotetramer).
▪ Nyolcszálas αβ-gomoly* (α/β barrel domain) nyolc párhuzamos β-lemezből és az azokat körülvevő 7–8 α-csavarulatból tevődik össze; a belső β-lemez mindegyike kapcsolódik egy α-csavarulattal, úgyhogy a szerkezet (α/β)8 szerkezetként írható le. Hordóra emlékeztető formájából származik a nemzetközi neve, ámbár nem teljesen olyan. Gyakran találunk bennük további α-, β- és más mintázatokat, sőt másik gomolyokkal is összefonódhatnak. Az ilyen enzimek családot képeznek, egyetlen „őstől” származnak, és igencsak szétágazó tevékenységűek. Jellegzetes képviselőjük a tirozinfoszfát-izomeráz, TIM1. (→TIM1)
▪ Proléngazdag gomolyok* (proline rich domains) sok prolént tartalmazó gomolyok. A fehérje sajátos térszerkezetét hozzák létre, ami elősegíti a fehérje kötődését más molekulával.
▪ Rendezetlen szerkezetű gomolyok* (intrinsically disordered domains, IDDs) jellegzetes mintázat és sajátosság nélküli, alig tekeredett gomolyok; térszerkezetüket könnyen változtatják. Mivel szerkezetük kevéssé kötött, rugalmasan, nagyobb alkalmazkodással képesek részt venni nagyon különböző biológiai folyamatokban (felismerésben, szabályozásban, jelközvetítésben). A magasabb rendű szervezetekben gyakoribbak, ami arra utal, hogy a fehérjék törzsfejlődésének magasabb fokozatai. Jelentősek a kutatás szempontjából is: a szerkezetkutatás fordított megközelítésének módja – a mintázathiány felől közelíthetők meg a szerkezeti összefüggések.
▪ RING (really interesting new gene) gomoly (RING finger domain/protein) C3HC4 aminosav-mintázatot és két cinkiont tartalmaz. 40–60 aminosavból áll; központi α-csavarodással és szegélyező két hurokkal, amelyeket a cinkion rögzít. Az ubikvitjelölésben van meghatározó szerepe, állványfehérjeként vesz részt: nem köti az ubikvitint elektronkötéssel. A RING gomolyt tartalmazó fehérjéket RING fehérjéknek nevezzük. (→ubikvitinezés)
▪ RNS-kötő gomolyok* (RNA binding domains) az RNS egyes részeit, rendre a végeket, fajlagosan azonosítva kötődnek az RNS-sel. (→RNS-kötő gomolyok)
▪ Sarkallógomolyok* (catalytic domains) az enzimek hatóegységei. Általában törzsökös szerkezetűek, és jellegzetesek az enzimcsoportokra. Pl. a kinázok mindegyikében ~250 aminosavból álló, sajátos térszerkezetű foszforilező gomoly van (kinázgomoly).
▪ Tevősítőgomolyok* (transactivation domains) géneket tevősítik, fokozzák a génátírást, és szabályozza a képződő fehérje szerkezetét.