elektronkötés* covalent
bond (egyéb elnevezések: atomkötés, elektronpárkötés,
kovalens kötés, homopoláris kötés) a vegyülő atomok egy-egy
párosítatlan elektronnal létrejövő kapcsolódása molekulává; közös
elektronpárral létrejövő kötés. A közös elektronpár a vegyértékhéjon van,
meghatározott irányú: a két atom között helyezkedik el. A közös elektronpárt kötő
elektronpárnak nevezzük, szemben az vegyértékhéjon lévő nem kötő
elektronpárral, amelynek szabad elektronpár a neve.
Az elektronkötéseket jellemző legfontosabb ismérvek:
■ Kötésszám a kötő elektronpárok száma.
Azt a kötést, amelyben egy elektronpár vesz részt, egyszeres kötésnek hívjuk. Ebben tehát mindkét részt vevő atom egy-egy elektronnal van jelen. A több vegyértékű atom képes több egyszeres kötést létrehozni. Ezek száma (kötésszám) attól függ, hogy hány elektron társulhat a vegyértékhéjon, a kötések kialakulásakor lévő elektronokhoz. A két kötő elektronpárral létrejövő kötést kettős, a három kötő elektronpárral létrejövőt pedig hármas kötésnek nevezzük.
Az elektronkötést a vegyülő atomok szerkezeti képletében az atomok vegyjele közötti vízszintes vonallal jelöljük (C–H). A kettős, illetve a hármas kötéseket két (C=O), illetve három (C º C) vízszintes vonallal jelöljük.
Az atom külső elektronhéján (vegyértékhéjon), vagyis a vegyértékhéjon nem lehet több nyolc elektronnál. Egy atom tehát nem létesíthet több mint négy egyszeres kötést, mivel egy egyszeres elektronkötésben két elektron van. Kívétel a hidrogén és a hélium, mert ezekben legfeljebb 2 elektron lehet vegyértékhéjon.
Ha a vegyértékhéjon nyolc elektron van,
az atom telített, ez az állékony állapot, a molekula ennek elérésére törekszik,
ezért jönnek létre az elektronkötések. (Ezt nevezzük nyolcas vagy
nemesgázszabálynak, oktettszabály)
Egy kötést létesíthet pl. a hidrogén, a klór, kettőt az oxigén, hármat a nitrogén, négyet a szénatom.
■ Kötéstávolság (kötéshossz) az egymással kötésben lévő atomok magjai közötti közepes távolság. Ez jól meghatározott, noha az atomok egymás felé rezegnek. Az elektronkötésben is nagyon jelentős, mert ha az atomok a közepes kötéshossznál közelebb kerülnek egymáshoz, már taszítják egymást; a kötési energia csökken. A szokványos kötési távolság 0.07–0,3 nm (70–300 pm). A kettős kötések távolsága kisebb, mint az egyes kötéseké. Minél nagyobb az atom, annál messzebb vannak a magok egymástól, ezért annál hosszabb a kötéstávolság.
■ Kötési energia két atom közötti kötés képződését vagy felszakítását kísérő energiaváltozás 1 mol molekulában; az előbbi negatív, az utóbbi pozitív előjelű. Értéke: kJ/mol. Pl. H2 kötésenergiája 438 kJ/mol, a vízzé pedig 463 kJ/mol.
A kötési energia nagysága függ az atomok méretétől (minél nagyobb az atom, annál kisebb a kötési energia, mert hosszabb a kötéstávolság), az atom töltésétől, a kötő elektronpárok számától és az elektronegativitástól, vagyis attól, hogy az atom mennyire vonzza a kötő elektronpárt. (→elektronegativitás) A kettős kötés energiája nagyobb, mint az egyszeres kötésé, de nem kétszer akkora, mert a szigma-kötés energiája nagyobb, mint a pi-kötésé.
■ Kötésszög a kapcsolódó atomok kötései által bezárt szög. Kialakulásában a szabad elektronoknak is jelentős szerepe van. A kötésszög a molekula téralakzatát határozza meg.
Az elektronkötések töltésviszonyai:
Ha a két atommag körül az elektronok eloszlása:
▪ Egyenletes, semleges elektronkötésről (apolar
covalent bond, apoláris kovalens kötés) beszélünk: a kötő elektronpárok
egyformán helyezkednek el a két atommag erőterében. Ilyen az azonos atomokból
álló molekulák (O2, H2) között jön létre. Általánosabban:
olyan atomok között, amelyeknek az elektronegativitása azonos vagy közel
azonos.
▪ Ha nem egyenletes az elektronok eloszlása (különböző
atomokból álló molekulák [HCl]), vagyis az elektronpár eltolódik valamelyik
atom irányába, résztöltésű elektronkötésről (polar covalent bond, poláris
kovalens kötés, polarizált atomkötés) van szó. A résztöltésű
elektronkötés tehát két különböző elektronegativitású atom közötti
elektronkötés.
Ebben a kötő elektronpárok többet vannak
a nagyobb elektronegativitású atom körül, vagyis az eloszlás részpozitív (δ+)
és résznegatív (δ-). Kétsarkú molekula (dipólusmolekula)
jön létre. Minél nagyobb a különbség az elektronegativitásban, annál
kifejezettebb a kétsarkúság, nagyobb a résztöltés. Jellegzetes példa a víz: az
oxigén (a molekula közepe) δ-, a hidrogén (végek) δ+.
Az elektronkötések formái:
Kétféle elektronkötést különböztetünk meg: a szigma-kötést (σ-kötés) és a pi-kötést (π-kötés). (→pi-kötés, szigma-kötés)
 ■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
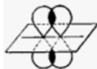
Az elektronhéjak átfedése miatt az atomok elektronpályái megváltoznak, molekulapályákká alakulnak. Pl. két hidrogénatom kötődésekor a hidrogénatomok gömb alakú elektronpályái tojásdaddá alakulnak. Az ábrán a fekete pontok jelölik a hidrogénatomok magjait. Jól látható, hogy az elektronfelhő (vörössel jelölve) legnagyobbrészt a két atommag között van; itt a legnagyobb az elektronsűrűség. (Forrás: Wikipédia.) Az ilyen molekulapályát σ-molekulapályának nevezzük.
A szigma-kötés van a legalacsonyabb energiaszinten, ezért minden elektronkötésben van szigma-kötés. Kötési energiája nagyobb, mint a pi-kötésé. Egy elektronkötésben csak egy szigma-kötés lehetséges, így a szigma-kötések száma egyezik a vegység (a központi atomhoz kötődő atomok) számával. (→vegység)
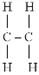
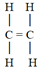 ■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
A szervezetben a hidrogén (H), az oxigén (O), a nitrogén (N), a szén (C), a kén (S) és a foszfor (P) képezi az elektronkötések zömét. Ez a hat elem, meghatározóan az első négy, az élő szervezet tömegének 99%-át adja.