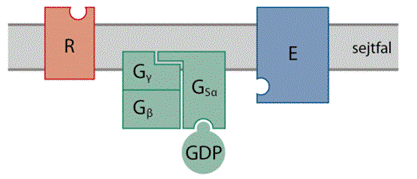
 G-fehérje-kapcsolt jelközvetítés A
jelfogó sejtkívüli vájolatához (a vázlatos ábrán R jelöli) kapcsolódik a
jelvivő, és megváltozik a jelfogó szerkezete, aminek következtében a sejtbeli
végen kötőhely válik szabaddá. Ehhez kapcsolódik a háromegységes (Gα, Gβ és Gγ)
G-fehérje α-alegysége, rendszerint egyféle, de – a jelfogó természetétől
függően – társulhat többféle is. A kötődés következtében módosul a Gα
szerkezete, megnyílik a GDP-t kötő zseb, és leválik a GDP. A sejtben a GTP
tízszer nagyobb töménységben van jelen, és – a harmadik foszfát miatt – nagyobb
hajlammal kötődik, mint a GDP, ezért a levált GDP helyét azonnal egy GTP
foglalja el. A GTP társulására megváltozik a teljes háromalegységes G-fehérje
szerkezete; a GTP-t kötő Gα tevősödik, egyrészt elválik a Gβ–Gγ-tól, másrészt
szerkezetváltozása következtében képes társulni a célenzimmel és tevősíti. A
célenzim rendszerint sejthártyabeli enzim (az ábrán E jelöli). A Gα GTPáz
tulajdonsága miatt egy idő után vízbelépéssel bontja a GTP-t GDP-re és foszfátra..
A GDP-t kötő Gα ismét tevőtlen állapotba kerül, újra egyesül és Gβ–Gγ-val, és a
folyamat kezdődhet elölről.
G-fehérje-kapcsolt jelközvetítés A
jelfogó sejtkívüli vájolatához (a vázlatos ábrán R jelöli) kapcsolódik a
jelvivő, és megváltozik a jelfogó szerkezete, aminek következtében a sejtbeli
végen kötőhely válik szabaddá. Ehhez kapcsolódik a háromegységes (Gα, Gβ és Gγ)
G-fehérje α-alegysége, rendszerint egyféle, de – a jelfogó természetétől
függően – társulhat többféle is. A kötődés következtében módosul a Gα
szerkezete, megnyílik a GDP-t kötő zseb, és leválik a GDP. A sejtben a GTP
tízszer nagyobb töménységben van jelen, és – a harmadik foszfát miatt – nagyobb
hajlammal kötődik, mint a GDP, ezért a levált GDP helyét azonnal egy GTP
foglalja el. A GTP társulására megváltozik a teljes háromalegységes G-fehérje
szerkezete; a GTP-t kötő Gα tevősödik, egyrészt elválik a Gβ–Gγ-tól, másrészt
szerkezetváltozása következtében képes társulni a célenzimmel és tevősíti. A
célenzim rendszerint sejthártyabeli enzim (az ábrán E jelöli). A Gα GTPáz
tulajdonsága miatt egy idő után vízbelépéssel bontja a GTP-t GDP-re és foszfátra..
A GDP-t kötő Gα ismét tevőtlen állapotba kerül, újra egyesül és Gβ–Gγ-val, és a
folyamat kezdődhet elölről.
Sokféle enzim válik működővé a GTP-kötött Gα-fehérjével kapcsolódva. Ilyen enzimek többek között az adenilát-cikláz, amely másodlagos hírvivőt, cAMP-t állít elő ATP-ből; a foszfolipáz-Cβ (PLCβ), amely két másodlagos hírvivőt, diacilglicerolt és inozitol-trifoszfátot is létrehoz; a cGMP-t bontó cGMP-foszfodiészteráz stb. Ismerünk G-fehérjékkel szabályozódó, ún. G-fehérje-vezérelt ioncsatornákat; köztük vannak Cl-, K-, Ca- és Na-csatornák is. Összességében igen sokféle folyamat (citokinek, hormonok képződése, ingerület-átvezetés, izomösszehúzódás, sejtmozgások, szervfejlődés, tanulás, emlékezés stb.) szabályozódik a G-fehérje-kapcsolt jelfogók általi jelközvetítéssel; ezek kapcsolódnak egymással is, mintegy hálózatot képeznek; elengedhetetlenek a szervezet egyensúlyállapotának megtartásában.
A jelfogónak a G-fehérjét serkentő hatása kétféleképpen szűnhet meg:
• Azonnal, ha leválik a jelvivő.
• A GRK (G-protein-coupled receptor kinase) hatására; ez a szabályozás fő formája. A GRK sajátosan csak a serkentett jelfogót foszforilezi, a jelfogón kialkult foszfátmintázatot felismerve hozzáfűződik a β-arrestin (β1/2-arrestin) fehérje, és fizikailag megakadályozza a jelfogó–G-fehérje társulást. Megszűnik a jelátadás, és megkezdődik a jelfogó–jelvivő bekebelezése: a β-arrestin hozzákapcsolja a jelfogót a bekebelezést végző rendszerhez (→AP2 [adaptin], klatrin). A jelfogó a jelvivővel együtt, hólyagocskába zárva, bekerül a sejtbe. A beltestecsben (endosome) elválasztódnak az újrahasznosuló jelfogók a lebontandóktól; az előbbiek ismét a sejthártyába kerülnek, az utóbbiak az emésztőtestecsbe (lysosome), ahol teljesen lebomlanak.