peptidek peptides peptidkötéssel kapcsolódó aminosavak (ábra). A peptidek a szervezetben szabadon is előfordulnak, működésük nagyon változatos. Az összekapcsolódott aminosavak számától függően di-, tri- stb. peptidekről beszélünk. A néhány aminosavat tartalmazó az oligopeptid, a 10+ aminosavból állót pedig egyezményesen polipeptideknek nevezzük. Nagyobb polipeptidben az aminosavak száma akár kétezer is lehet.
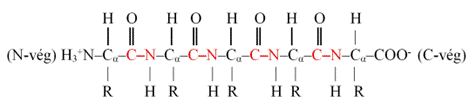 A peptid aminosavsora (peptidlánc) vázlatosan. A
molekula gerincét (peptidgerinc) az ismétlődő peptidkötésekkel [pirossal
jelölve] kapcsolódó szénatomok alkotják; ezek egy síkban helyezkednek el. A
molekula egyik végén amino- (N-vég, N terminal) a másikon karboxilcsoport
(C-vég, C terminal [carboxyl]) van. Megállapodás szerint az elöl lévő az N-vég, a
hátul lévő pedig a C-vég. Az aminocsoport pozitív, a karboxilcsoport negatív
töltésű – a peptidek tehát (miként az aminosavak) ikerionok. A bennük lévő
aminosavak az egymáshoz kötődések miatt nem teljesek; ezek nemzetközi neve amino
acid residue, magyarul aminosav-maradék. Az R az aminosavak
oldalláncait jelöli; ezek a peptidekben is változatlanok, és szokásosan
ellentett (transz) helyzetűek, vagyis az oldalláncok ellentétesen helyezkednek
el, egymástó távolodva, ezért elférnek, nem akadályozzák egymást – nincs
térbeli nehézség. Az azon- (cisz) helyzetben az oldalláncok az egyik oldalon
vannak, közöttük térbeli akadály lehetséges. A térbeli akadályoztatás
elektronok kilökődéséhez vezethet, ezért kell több energia az azonhelyzetű
molekula egybetartásához, és ezért nem marad meg. Az ellentett helyzet tehát
kisebb energiaigényű, következésképpen biztonságosabb.
A peptid aminosavsora (peptidlánc) vázlatosan. A
molekula gerincét (peptidgerinc) az ismétlődő peptidkötésekkel [pirossal
jelölve] kapcsolódó szénatomok alkotják; ezek egy síkban helyezkednek el. A
molekula egyik végén amino- (N-vég, N terminal) a másikon karboxilcsoport
(C-vég, C terminal [carboxyl]) van. Megállapodás szerint az elöl lévő az N-vég, a
hátul lévő pedig a C-vég. Az aminocsoport pozitív, a karboxilcsoport negatív
töltésű – a peptidek tehát (miként az aminosavak) ikerionok. A bennük lévő
aminosavak az egymáshoz kötődések miatt nem teljesek; ezek nemzetközi neve amino
acid residue, magyarul aminosav-maradék. Az R az aminosavak
oldalláncait jelöli; ezek a peptidekben is változatlanok, és szokásosan
ellentett (transz) helyzetűek, vagyis az oldalláncok ellentétesen helyezkednek
el, egymástó távolodva, ezért elférnek, nem akadályozzák egymást – nincs
térbeli nehézség. Az azon- (cisz) helyzetben az oldalláncok az egyik oldalon
vannak, közöttük térbeli akadály lehetséges. A térbeli akadályoztatás
elektronok kilökődéséhez vezethet, ezért kell több energia az azonhelyzetű
molekula egybetartásához, és ezért nem marad meg. Az ellentett helyzet tehát
kisebb energiaigényű, következésképpen biztonságosabb.
A peptideket alkotó aminosavak sorrendjét az NH2-csoportot tartalmazó aminosavtól (N-vég) kezdjük, és az aminosavak nevének három vagy egy betűs rövidítéseivel írjuk le. Pl.: Leu–Asp–Gly–Lys (leucin, aszparagin, glicin és lizin).
Az egy síkban lévő peptidgerincet az N–Cα–C–N kötések sora alkotja. Ezek a Cα melletti kötésekben (N–Cα, illetőleg Cα–C) kötésekben elfordulhatnak, kialakítva a peptidek térhelyzetét. Az N–Cα kötés elfordulásának szöge a φ-szög, Cα–C kötésé a ψ-szög. A szögeket a négy atom síkja szerint állapítják meg, azt fejezik ki, hogy Cα–C–N által meghatározott sík mennyire fordult el a N–Cα–C síkjához viszonyítva.
A peptidek tulajdonságait (savas, bázikus jelleg, kötődések, részvétel vegyfolyamatokban, oldhatóság stb.) alapjában az oldalláncok határozzák meg. A peptidek azonban nemcsak az oldalláncokon, hanem a szabad amino- (N-vég) vagy karboxilcsoportokkal (C-vég) is kapcsolódhatnak más molekulákhoz.
A peptidek a szervezetben szabadon is előfordulnak, működésük nagyon változatos, pl. peptidhormonok. Gyakori bennük a szerkezetüket rögzítő S–S-híd (inzulin, oxitocin stb.).