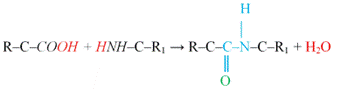 peptidkötés peptide bond akkor keletkezik,
ha az egyik aminosav karboxilcsoportjának α- (nem oldallánci) szénatomja a
másik aminosav α-aminocsoportjának nitrogénatomjával elektronkötéssel társul;
ez az amino- és a karboxilcsoportok vízkilépéssel végbemenő egyesülésével jön
létre (–CO–NH–). Az NH2-ből egy hidrogén, a COOH-ból egy OH-csoport
hasítódik le, és alakul vízzé (pirossal jelölve). R az egyik, R1 a
másik aminosav oldallánca. A peptidkötés hagyományosan írva, kékkel jelölve. A peptidkötésben
a hidrogén és az oxigén ellentett oldali (transz térhelyzetű). A folyamat
fordítva is végbemegy: a peptidkötés vízhozzáadással bontható.
peptidkötés peptide bond akkor keletkezik,
ha az egyik aminosav karboxilcsoportjának α- (nem oldallánci) szénatomja a
másik aminosav α-aminocsoportjának nitrogénatomjával elektronkötéssel társul;
ez az amino- és a karboxilcsoportok vízkilépéssel végbemenő egyesülésével jön
létre (–CO–NH–). Az NH2-ből egy hidrogén, a COOH-ból egy OH-csoport
hasítódik le, és alakul vízzé (pirossal jelölve). R az egyik, R1 a
másik aminosav oldallánca. A peptidkötés hagyományosan írva, kékkel jelölve. A peptidkötésben
a hidrogén és az oxigén ellentett oldali (transz térhelyzetű). A folyamat
fordítva is végbemegy: a peptidkötés vízhozzáadással bontható.
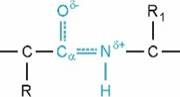 A peptidkötés
elektroneltolódással rögzített (resonance stabilized), ez a peptidkötésben lévő
nitrogén nem kötő elektronpárjának a kötés oxigénjére való áttevődésével jön
létre. Az elektronpárt átadó nitrogénnek részleges pozitív (δ+)
töltése van, a karbonil (C=O) oxigénje viszont részlegesen negatív (δ-),
ezért keletkezik közöttük gyakran hidrogénhíd, ha közelségbe kerülnek
egymáshoz. Az átalakulás következtében részleges kettőskötések alakulnak ki:
A peptidkötés
elektroneltolódással rögzített (resonance stabilized), ez a peptidkötésben lévő
nitrogén nem kötő elektronpárjának a kötés oxigénjére való áttevődésével jön
létre. Az elektronpárt átadó nitrogénnek részleges pozitív (δ+)
töltése van, a karbonil (C=O) oxigénje viszont részlegesen negatív (δ-),
ezért keletkezik közöttük gyakran hidrogénhíd, ha közelségbe kerülnek
egymáshoz. Az átalakulás következtében részleges kettőskötések alakulnak ki:
A részleges kettőskötés a szén- és a nitrogénatom, illetve a szén- és az oxigénatom közt rögzíti a kötést, ezért a kötés mozdulatlan, nem fordul el, szöge 120o. A peptidkötés atomjai és a hozzájuk kötődő 1-1 szénatom egy síkban vannak.
izopeptidkötés isopeptide bond olyan peptidkötés, amely a kapcsolódó két aminosavnak nem a COOH és az NH2 szén és nitrogénje (α-C és α-N) között jön létre; a nitrogén valamelyik másik szénatomhoz kötődik.