szerkezeti azonmások* constitutional isomers azonos atomösszetételű és molekulatömegű, de az atomok kapcsolódásában (összekapcsolódási rendjében) eltérő molekulák. Másként: azonos összegképletű, de különböző szerkezeti képletű vegyületek. A szerkezeti azonmások fizikai tulajdonságai, pl. forráspontjuk, különbözik. (→azonmás)
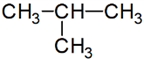
lánc azonmások* chain isomers az atomok, szokásosan a szénatom elágazásában és/vagy kötésükben eltérő azonmások. Pl.
sorrendi eltérés:
n-bután:
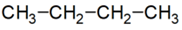
izobután:
kötési eltérés:
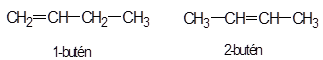
A legegyszerűbb szénhidrogéneknek, mint metán (CH4), etán (CH3–CH3) és propán (CH3–CH2–CH3), nincs azonmása, mert a szén és hidrogének kapcsolódása csak egyféleképpen lehetséges.
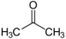 hatócsoportú
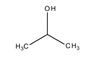
azonmások* functional (group) isomers
különböző hatócsoportot kapcsoló azonmások. Pl. az acetonban karbonil- (C=O), a
propanolban pedig hidroxilcsoport van.
hatócsoportú
azonmások* functional (group) isomers
különböző hatócsoportot kapcsoló azonmások. Pl. az acetonban karbonil- (C=O), a
propanolban pedig hidroxilcsoport van.
kötésváltó azonmások* tautomers csak a protonok és elektronok elhelyezkedésében más azonmások. A kötésátalakulás voltaképpen protonáthelyeződés* (prototropy): egy proton a molekula egyik helyéről a másikra tevődik át, rendszerint az elektronok eloszlási változásával, a mozgékony hidrogén áttevődésével és kötésváltozással jár. Ezek egyféle kötésben eltérő vegyületek, amelyek könnyen átalakulnak egymásba. Együtt vannak jelen, váltakozó egyensúlyi állapotban, és a vegyi folyamatokban szintén együtt vesznek részt. A kötésváltásnak* (tautomerism) számos formája ismert. Néhány gyakoribb:
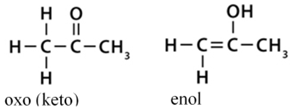 • oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→hatáscsoport, oxovegyületek)
• oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→hatáscsoport, oxovegyületek)
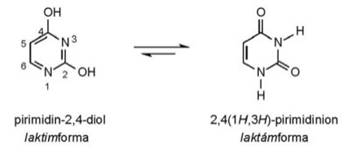 • laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, a
gyűrűs savamidokra (laktámokra) jellemző a hidrogénátrendeződés a
gyűrűben lévő amidcsoporton belül. Az uracil
(pirimidin-2,4-diol) egyensúlyi folyamata:
• laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, a
gyűrűs savamidokra (laktámokra) jellemző a hidrogénátrendeződés a
gyűrűben lévő amidcsoporton belül. Az uracil
(pirimidin-2,4-diol) egyensúlyi folyamata:
• Egyéb kötésváltó azonmások: enamin–imin: H−N−C=C / N=C−C−H, nitrozo–oxim: H−C−N=O / C=N−O−H, keten–inol: H−C=C=O / C≡C−O−H, foszfit–foszfonát: P(OR)2(OH) ⇌ HP(OR)2(=O), aminosav–ammonium-karboxilát (H2N−CH2−COOH / H3N+−CH2−CO−) stb.
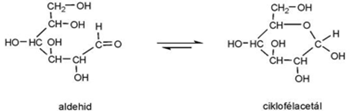 gyűrű–lánc azonmások* ring-chain isomers az azonmások egyike nyíltlánc, a másik gyűrűs. Olyan
aldehid-/ketocsoportot és OH-csoportot tartalmazó vegyületekben, például
szénhidrátokban fordul elő, amelyekben a proton áthelyeződésével a nyílt
vegyületből (láncforma) gyűrűs lesz, és fordítva. Az OH-csoport hidrogénje az
aldehidcsoportra vándorol, kialakítva a gyűrűformát. Az aldehidlánc utolsó
szénatomjához kettős kötéssel kapcsolódó oxigén helyett egyes kötéssel
OH-csoport társul. Az ábrán a glükóz (szőlőcukor) példája látható.
gyűrű–lánc azonmások* ring-chain isomers az azonmások egyike nyíltlánc, a másik gyűrűs. Olyan
aldehid-/ketocsoportot és OH-csoportot tartalmazó vegyületekben, például
szénhidrátokban fordul elő, amelyekben a proton áthelyeződésével a nyílt
vegyületből (láncforma) gyűrűs lesz, és fordítva. Az OH-csoport hidrogénje az
aldehidcsoportra vándorol, kialakítva a gyűrűformát. Az aldehidlánc utolsó
szénatomjához kettős kötéssel kapcsolódó oxigén helyett egyes kötéssel
OH-csoport társul. Az ábrán a glükóz (szőlőcukor) példája látható.