téralakzati azonmások configurational isomers összetételükben és a kötési sorrendben is egyező, csupán elektronkötésük körüli térszerkezetükben eltérő vegyületük. Egymásba csak valamelyik elektronkötésük felbomlásával és új elektronkötés kialakulásával alakulhatnak át; a kötések elfordulásával nem. A téralakzati azonmásoknak két alapformáját, a tükörképi és a nem tükörképi azonmásokat különböztetjük meg:
■ Tükörképi (térközponti) azonmások (enantiomers,
enantiomerek) egy vagy több térközpontot (térközponti szénatomot)
tartalmazó vegyület olyan két formája, amelyek egymásnak tükörképei, de fedésbe
– miként a jobb és bal kéz – nem hozhatók. Másképp: olyan molekulák, amelyeknek
velük fedésbe nem hozható tükörképi párja is van.
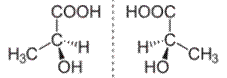 A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A kétféle tükörképi azonmás megkülönböztetésére az R,
S betűt alkalmazzuk (R–S azonmásság*); és a szénatomhoz
kapcsolódó molekulák rangsora szerint határozzuk meg. A rangsort az atomok
rendszáma és kapcsolódási sora adja. A legkisebb rangja a legkisebb rendszámú
atomnak (H) van. A hatócsoportok rang szerinti sora: ─OCH3 > ─OH > ─NH2 > ─COOH > ─CHO >
─CH2OH > ─CH3 > ─H. Az atomok rang szerinti sorát a rendszámuk határozza
meg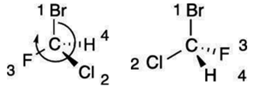 . A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
. A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
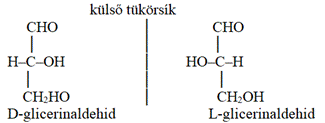 A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
■ Nem tükörképi azonmások* (diastereomers, diasztereomerek) egymásnak nem tükörképei, és egymással fedésbe sem hozhatók, fizikai és
vegyi tulajdonságaikban eltérők. Bennük a molekulák kapcsolódási rendje azonos,
egy vagy több nem kapcsolódó atom térbeli helyzete más. Kialakulhat egy vagy
több szénatom körül. Ilyenek a cisz–transz azonmások.
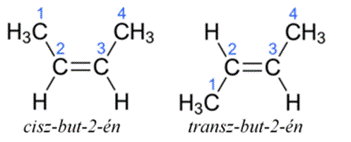 cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
A kétféle helyzet csak a kettőskötés átmeneti felszakadásával és újraegyesülésével alakulhat át egymásba. A hatócsoportok más térállása miatt különbözik az azonmások tulajdonsága, kölcsönhatása; megváltozik az alakja. A kettő tehát más-más molekula; ez legtöbbször a hagyományos nevükben is kifejeződik. (→cisz–transz)
A cisz–transz nevekkel előfordulhat félreértés, ezért a IUPAC bevezette a szigorúbban szabályozott Z–E rendszert, amely a szénatomokhoz kapcsolódó atomok/molekulák atomszámán alapszik, és rangsort állít fel ennek alapján. Ha a rangsorban nagyobb értékű molekula (példánkban a CH3, metilcsoport) ugyanazon oldalon van, Z (zusammen), ha különböző, E (entgegen) betűt kap. Pl. (2Z)-but-2-én, illetve (2E)-but-2-én.