anomer gyűrűs
szénhidrátazonmás (→térazonmás)
epimer egyes szénhidrátazonmás (→térazonmás)
iso- előtag a molekulák nevében a szénlánc elágazására utal
■ isoform (→testvérmás) ■ isomer (izomer→azonmás ■ isomerism azonmásság (→azonmás) ■ isomerization azonmásodás (→azonmás) ■ isotype (immunglobulin-válfajok) ■ isotope →neutonmás
szerkezeti azonmások*
constitutional isomers azonos atomösszetételű és molekulatömegű, de az atomok
kapcsolódásában (összekapcsolódási rendjében) eltérő molekulák. Másként: azonos
összegképletű, de különböző szerkezeti képletű vegyületek. A szerkezeti
azonmások fizikai tulajdonságai, pl. forráspontjuk, különbözik. (→azonmás)
lánc azonmások* chain isomers az atomok, szokásosan a szénatom
elágazásában és/vagy kötésükben eltérő azonmások. Pl.
sorrendi
eltérés:
n-bután:
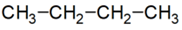
izobután:
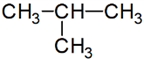
kötési
eltérés:
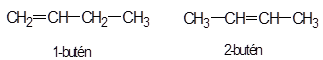
A
legegyszerűbb szénhidrogéneknek, mint metán (CH4), etán (CH3–CH3)
és propán (CH3–CH2–CH3), nincs azonmása, mert
a szén és hidrogének kapcsolódása csak egyféleképpen lehetséges.
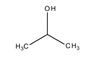
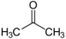 hatócsoportú
azonmások* functional (group) isomers
különböző hatócsoportot kapcsoló azonmások. Pl. az acetonban karbonil- (C=O), a
propanolban pedig hidroxilcsoport van.
hatócsoportú
azonmások* functional (group) isomers
különböző hatócsoportot kapcsoló azonmások. Pl. az acetonban karbonil- (C=O), a
propanolban pedig hidroxilcsoport van.
kötésváltó azonmások* tautomers csak a protonok és elektronok
elhelyezkedésében más azonmások. A kötésátalakulás voltaképpen protonáthelyeződés*
(prototropy): egy proton a molekula
egyik helyéről a másikra tevődik át, rendszerint az elektronok eloszlási
változásával, a mozgékony hidrogén áttevődésével és kötésváltozással jár. Ezek
egyféle kötésben eltérő vegyületek, amelyek könnyen átalakulnak egymásba. Együtt
vannak jelen, váltakozó egyensúlyi állapotban, és a vegyi folyamatokban szintén
együtt vesznek részt. A kötésváltásnak* (tautomerism) számos formája
ismert. Néhány gyakoribb:
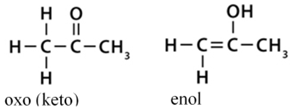 • oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→hatáscsoport, oxovegyületek)
• oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→hatáscsoport, oxovegyületek)
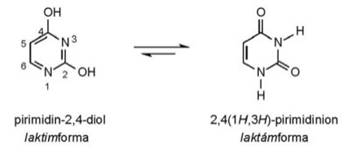 • laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, a
gyűrűs savamidokra (laktámokra) jellemző a hidrogénátrendeződés a
gyűrűben lévő amidcsoporton belül. Az uracil
(pirimidin-2,4-diol) egyensúlyi folyamata:
• laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, a
gyűrűs savamidokra (laktámokra) jellemző a hidrogénátrendeződés a
gyűrűben lévő amidcsoporton belül. Az uracil
(pirimidin-2,4-diol) egyensúlyi folyamata:
• Egyéb kötésváltó azonmások: enamin–imin: H−N−C=C / N=C−C−H, nitrozo–oxim: H−C−N=O / C=N−O−H,
keten–inol: H−C=C=O / C≡C−O−H, foszfit–foszfonát: P(OR)2(OH) ⇌ HP(OR)2(=O), aminosav–ammonium-karboxilát (H2N−CH2−COOH / H3N+−CH2−CO−)
stb.
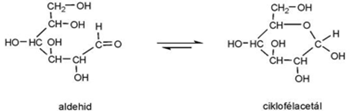 gyűrű–lánc azonmások* ring-chain isomers az azonmások egyike nyíltlánc, a másik gyűrűs. Olyan
aldehid-/ketocsoportot és OH-csoportot tartalmazó vegyületekben, például
szénhidrátokban fordul elő, amelyekben a proton áthelyeződésével a nyílt
vegyületből (láncforma) gyűrűs lesz, és fordítva. Az OH-csoport hidrogénje az
aldehidcsoportra vándorol, kialakítva a gyűrűformát. Az aldehidlánc utolsó
szénatomjához kettős kötéssel kapcsolódó oxigén helyett egyes kötéssel
OH-csoport társul. Az ábrán a glükóz (szőlőcukor) példája látható.
gyűrű–lánc azonmások* ring-chain isomers az azonmások egyike nyíltlánc, a másik gyűrűs. Olyan
aldehid-/ketocsoportot és OH-csoportot tartalmazó vegyületekben, például
szénhidrátokban fordul elő, amelyekben a proton áthelyeződésével a nyílt
vegyületből (láncforma) gyűrűs lesz, és fordítva. Az OH-csoport hidrogénje az
aldehidcsoportra vándorol, kialakítva a gyűrűformát. Az aldehidlánc utolsó
szénatomjához kettős kötéssel kapcsolódó oxigén helyett egyes kötéssel
OH-csoport társul. Az ábrán a glükóz (szőlőcukor) példája látható.
térazonmások*
stereoisomers (sztereoizomerek) azonos összetételű, azonos kötéssorrendű, de eltérő
térelrendeződésű vegyületek. A térszerkezeti különbség lehet az
elektronkötésben lévő és a nem elektronkötésbén lévő atomok és/vagy molekulák
között. Az előbbieket téralakzati azonmásoknak, az utóbbiakat térhelyzeti
azonmásoknak nevezzük. (→téralakzati azonmások, térhelyzeti azonmások)
téralakzati azonmások configurational
isomers összetételükben és a kötési sorrendben is egyező, csupán
elektronkötésük körüli térszerkezetükben eltérő vegyületük. Egymásba csak
valamelyik elektronkötésük felbomlásával és új elektronkötés kialakulásával
alakulhatnak át; a kötések elfordulásával nem. A téralakzati azonmásoknak két
alapformáját, a tükörképi és a nem tükörképi azonmásokat különböztetjük
meg:
■ Tükörképi (térközponti) azonmások (enantiomers,
enantiomerek) egy vagy több térközpontot (térközponti szénatomot)
tartalmazó vegyület olyan két formája, amelyek egymásnak tükörképei, de fedésbe
– miként a jobb és bal kéz – nem hozhatók. Másképp: olyan molekulák, amelyeknek
velük fedésbe nem hozható tükörképi párja is van.
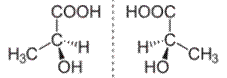 A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A kétféle tükörképi azonmás megkülönböztetésére az R,
S betűt alkalmazzuk (R–S azonmásság*); és a szénatomhoz
kapcsolódó molekulák rangsora szerint határozzuk meg. A rangsort az atomok
rendszáma és kapcsolódási sora adja. A legkisebb rangja a legkisebb rendszámú
atomnak (H) van. A hatócsoportok rang szerinti sora: ─OCH3 > ─OH > ─NH2 > ─COOH > ─CHO >
─CH2OH > ─CH3 > ─H. Az atomok rang szerinti sorát a rendszámuk határozza
meg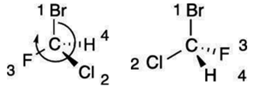 . A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
. A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
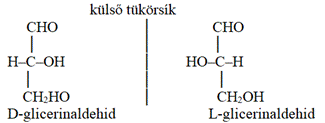 A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
■ Nem tükörképi azonmások* (diastereomers, diasztereomerek) egymásnak nem tükörképei, és egymással fedésbe sem hozhatók, fizikai és
vegyi tulajdonságaikban eltérők. Bennük a molekulák kapcsolódási rendje azonos,
egy vagy több nem kapcsolódó atom térbeli helyzete más. Kialakulhat egy vagy
több szénatom körül. Ilyenek a cisz–transz azonmások.
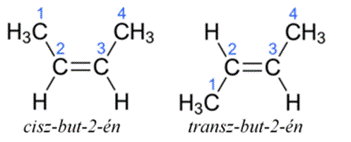 cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
A kétféle helyzet csak a kettőskötés
átmeneti felszakadásával és újraegyesülésével alakulhat át egymásba. A hatócsoportok
más térállása miatt különbözik az azonmások tulajdonsága, kölcsönhatása;
megváltozik az alakja. A kettő tehát más-más molekula; ez legtöbbször a
hagyományos nevükben is kifejeződik. (→cisz–transz)
A cisz–transz nevekkel
előfordulhat félreértés, ezért a IUPAC bevezette a szigorúbban szabályozott Z–E
rendszert, amely a szénatomokhoz kapcsolódó atomok/molekulák atomszámán
alapszik, és rangsort állít fel ennek alapján. Ha a rangsorban nagyobb értékű
molekula (példánkban a CH3, metilcsoport) ugyanazon oldalon van, Z
(zusammen), ha különböző, E (entgegen) betűt kap. Pl. (2Z)-but-2-én, illetve (2E)-but-2-én.
térhelyzeti azonmások*
conformational isomers, conformers, rotational isomers ugyanazon molekula egyszeres elektronkötése
mentén való elfordulásokból létrejöhető térszerkezeti változatok. Egymásba
könnyen átfordulnak. A térhelyzeti azonmások tehát az elektronkötések
felbomlása nélkül alakulhatnak át egymásba.
Ha az azonmásságot kialakító két molekula egyirányú, szün,
ha ellentétes, anti helyzetről beszélünk. Ezt nevezzük szün–anti
azonmásságnak. Pl.: a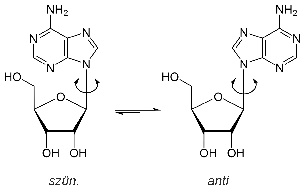 z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes.
z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes.
Az elforgatással az egyik (A) térhelzeti azonmás
átmenetformán (transition state) keresztül átalakul a másik (B) térazonmássá.
Az A és a B térazonmás helyi energiája a legkisebb, az átmenetállapoté a
legnagyobb. A forgatás az energiakülönbséget (energiagát*) küzdi le. Ha az
energiagát kicsi, a két térazonmás könnyen és gyorsan átalakul, szokásosan
mindkettő jelen van, váltakozó egyensúlyi állapotban. Ha az energiagát nagy, a
forgatás korlátozott, az átmenetalakzat tartósan jelen lehet külön
molekulaként; ezt a molekulát nevezzük átmeneti térazonmásnak*
(rotational isomer, rotamer). A hosszan megmaradó és ezért elkülöníthető
átmeneti térazonmást veszteglő térazonmásnak* (atropisomer) mondjuk.
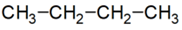

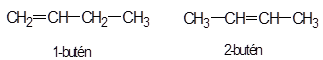


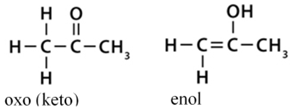 • oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→
• oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→ • laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő,
• laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, 
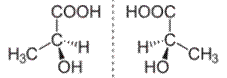 A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→
A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→ . A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
. A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)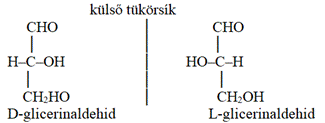 A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
 z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes.
z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes.