elektronburok electron configuration az elektronok elhelyezkedése az atomban vagy ionban; az elektronhéjak, elektronalhéjak és elektronhelyek rendszere. Ebben helyezkednek el az atom elektronjai. Ez határozza meg az elem vegytulajdonságát és részvételét a kötésekben.
elektronhéj shell az atommagtól az elektron energiaszintje szerinti távolságban lévő energiatartomány*. Az atomban az elektron energiaszintjétől függően csak meghatározott távolságra helyezkedhet el az atommagtól. A kisebb energiájú elektronok közelebb vannak a maghoz. Vagyis minél távolabbi elektronhéjon van az elektron, annál nagyobb az energiája. Az elektron az elektronhéjon belül több helyen is lehet, ezért mondjuk az elektronhéjat energiatartománynak, nem pedig elektronpályának.
Egy atomnak legfeljebb 7 elektronhéja lehet. A magtól távolodva növekszik az elektronhéjak energiatartományának az energiaszintje; a legkülső elektronhéj energiaszintje a legnagyobb. Az elektronhéjakat háromféleképpen jelölhetjük:
▪ Betűkkel: K, L, M, N, O, P, Q; a K van a maghoz legközelebb, a továbbiak a magtól elfelé haladva jelzik az elektronhéjakat.
▪ A főrészecsszámmal (n). A maghoz legközelebbi elektronhéj az 1-es vagy K-héj; főmrészecsszáma n = 1. A következő a 2-es vagy L-héj; főmrészecsszáma n = 2. A 3-as héj az M-héj (n = 3), a 4-es héj az N-héj (n = 4), az 5-ös az O-héj (n = 5), a 6-os a P-héj (n = 6), a 7-es pedig a Q-héj (n = 7).
▪ Egyszerűen számokkal: 1., 2. stb. elektronhéj; az 1. a maghoz legközelebbi.
Az egyes elektronhéjakon lehetséges legtöbb elektron meghatározott; a 2 ∙ n2 képlettel fejezhető ki (n a főmértékszám): az 1-es héjon (n = 1) legtöbb két elektron lehet, a 2-es héjon legtöbb nyolc (n = 2 [n2 = 4, 2 ∙ 4 = 8]), a 3-as héjon 18 stb.
Mivel minél távolabb van az elektron a magtól, energiája annál nagyobb, ha egy elektron egy külső héjról egy belsőre kerül, energia szabadul fel, és fordítva, belsőn lévő elektron energiát igényel ahhoz, hogy külsőbb héjra kerüljön. A leadott vagy felvett energia egyenlő a két elektronhéj közti energiakülönbséggel. A megfelelő elektronhéjakon tartózkodó elektronok nem sugároznak energiát.
Az atom legkülső elektronhéját vegyértékhéjnak* nevezzük; ezen vannak a vegyértékelektronok. Legfeljebb 8 vegyértékelektron lehet, kivéve a hidrogént és a héliumot, amelyeknek egyetlen elektronhéja van, legfeljebb 2 elektronnal. (→vegyértékelektron)
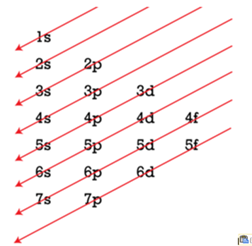
elektronalhéj subshell az elektronhéjon belüli energiatartomány. Négy elektronalhéj van; ezeket s, p, d, f betűkkel jelöljük, utalva a bennük lévő elektronhely (orbital) formájára, pl. az s (spherical) gömbölyű formájú elektronhely.
Az 1-es elektronhéjnak egyetlen alhéja van (1s), a 2-es elektronhéjnak kettő (2s, 2p), a 3-asnak 3 (3s 3p 3d), a 4-esnek négy (4s 4p 4d 4f) – az alapállapotban lévő atomoknak egy elektronhéjon belül nincs négynél több alhéja. A további alhéjak a gerjesztett atomokban jönnek létre. Az s-alhéjon, bármely energiaszinten legfeljebb két, a p-alhéjon legfeljebb hat, a d alhéjon legfeljebb 10, az f-alhéjon pedig legfeljebb 14 elektron lehet.
elektronhely* atomic orbital, electron orbital az elektronok mozgásának térbeli helye és viselkedése (pl. hullámtulajdonsága) az alhéjakon belül; az elektronburoknak az a része, amelyben az elektronok tartózkodási valószínűsége 0 és 1 között van. Az s-alhéjnak 1 elektronhelye van, a p-alhéjnak három, a d-nek öt, az f-nek pedig 7. Egy elektronhelyen legfeljebb 2 elektron lehet.
Az elektronhelyet a hazai szakirodalomban elektronpályának is mondják. A pálya szó útvonalfélére, valamilyen síkbeli haladás vonalára utal, nem pedig térbeli elhelyezkedésre. Ezért az elektronhely elnevezés kifejezőbb.
Az elektron nem kering úgy a mag körül, miként a Föld a Nap körül. Az atommag és az elektron töltésvonzása hat egymásra; a gyengébb (az utóbbi) felveszi az erősebb (az atommag) irányultságát. Vagyis az elektronok tényleges mozgási helyét az elektron energiája, a mag tényleges vonzásereje és az atom mágnestere szabja meg. Az elektronhely ekként az n, l és az ml elméletszámokkal jellemezhető. Egy elektronhelyen – a Pauli-elvből adódóan – legfeljebb 2 elektron lehetséges. (→elektron-elméletszámok, Pauli-elv)
Az elektron elhelyezkedése az eletronhelyen belül, hogy hol van, és hol lesz a következő pillanatban, nem mondható meg pontoson – ez a Heisenberg-féle határozatlansági elv. Csupán az elektron helyének valószínűségi eloszlását tudjuk meghatározni.
Az elektron legvalószínűbb helyét a részecselmélet szellemében az elektron állapotfüggvényével határozzák meg; ez az elektronnak a hely szerinti valószínűségi eloszlását fejezi ki. Jele: ψ. Az állapotfüggvényt a Schrödinger-egyenlettel számolják ki.