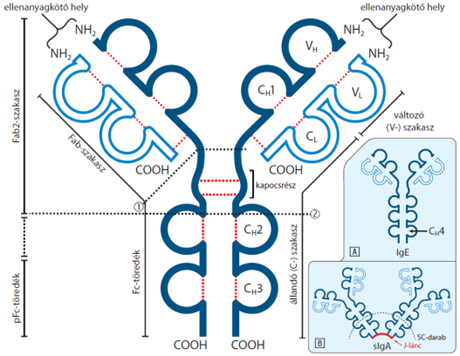
 ellenanyag-szerkezet Az ellenanyagok (immunglobulinok, Ig) jellegzetes Ig
gomolyokból felépülő két ellentétes β-lemezből állnak, amelyeket S–S hidak
kötnek össze. Egy-egy, egyforma könnyűlánc (L-lánc, light chain [24 kDa])
kapcsolódik egy-egy, egyforma nehézlánchoz (H-lánc, haevy chain [55-70 kDa]),
az utóbbiak meg egymáshoz S–S hidakkal (az ábrám piros pontozott vonalak [.....] jelölik). Az L- és H-láncokon is, ~110
aminosavból álló, azonos, de egymástól független, gömbszerű gomolyok (globular
domains) ismétlődnek; mindegyiket S–S híd fogja össze. A H-láncon szokásosan
négy gomoly van: három (CH1, CH2 és CH3)
állandó szerkezetű (állandó szakasz, constant [C] region), az N-végen lévőnek
(VH) változó a szerkezete (variable [V] region, V-szakasz, VH).
A H-láncok kötődési szakasza, a kapocsrész* (hinge), a CH2-nek a CH1-gyel
társuló részében van. Az L-láncnak csak két gomolya van: az egyik állandó (CL)
a másik változó (VL). Az Y karjai az antigénkötő hely (fragment antigen-binding
site, Fab), a két könnyűlánc és a nehézlánc VH és CH1
gomolya képezi. Az Y szára a jelfogóhoz kapcsolódó rész, a két CH2
és a két CH3 gomolyból tevődik össze. Ez az Fc-töredék (crystallizable
fragment) töredék. A Fab változó gomolyai (VL és VH)
ismerik fel és kapcsolódnak az antigénnel. Változékonyságuk határtalan
(elméletileg 1057-en változat lehetséges), következésképpen az
ellenanyagok változata is végtelen. A CH1 a VH gomolyhoz,
a CL a VL gomolyhoz kapcsolódik, és részt vesz az
antigének megkötésében.
ellenanyag-szerkezet Az ellenanyagok (immunglobulinok, Ig) jellegzetes Ig
gomolyokból felépülő két ellentétes β-lemezből állnak, amelyeket S–S hidak
kötnek össze. Egy-egy, egyforma könnyűlánc (L-lánc, light chain [24 kDa])
kapcsolódik egy-egy, egyforma nehézlánchoz (H-lánc, haevy chain [55-70 kDa]),
az utóbbiak meg egymáshoz S–S hidakkal (az ábrám piros pontozott vonalak [.....] jelölik). Az L- és H-láncokon is, ~110
aminosavból álló, azonos, de egymástól független, gömbszerű gomolyok (globular
domains) ismétlődnek; mindegyiket S–S híd fogja össze. A H-láncon szokásosan
négy gomoly van: három (CH1, CH2 és CH3)
állandó szerkezetű (állandó szakasz, constant [C] region), az N-végen lévőnek
(VH) változó a szerkezete (variable [V] region, V-szakasz, VH).
A H-láncok kötődési szakasza, a kapocsrész* (hinge), a CH2-nek a CH1-gyel
társuló részében van. Az L-láncnak csak két gomolya van: az egyik állandó (CL)
a másik változó (VL). Az Y karjai az antigénkötő hely (fragment antigen-binding
site, Fab), a két könnyűlánc és a nehézlánc VH és CH1
gomolya képezi. Az Y szára a jelfogóhoz kapcsolódó rész, a két CH2
és a két CH3 gomolyból tevődik össze. Ez az Fc-töredék (crystallizable
fragment) töredék. A Fab változó gomolyai (VL és VH)
ismerik fel és kapcsolódnak az antigénnel. Változékonyságuk határtalan
(elméletileg 1057-en változat lehetséges), következésképpen az
ellenanyagok változata is végtelen. A CH1 a VH gomolyhoz,
a CL a VL gomolyhoz kapcsolódik, és részt vesz az
antigének megkötésében.
Az immunglobulinok két változatában (IgE és IgM) a nehézláncon egy negyedik gömbegység (CH4) is van; ez sajátos sejtkapcsolatokat tesz lehetővé. Ezekben járulékos elemek (járulékos lánc és SC-darab) is találhatók.
▪ Járulékos lánc (J-lánc, joining chain) polipeptid, az IgA-ban és a IgM-ben fordul elő; a nyálkahártyai nyirokszövet (MALT) plasmasejtjei képezik. Összekapcsol két vagy több azonos immunglobulint, kettőst, többest képezve: IgA esetében kettőt vagy négyet, az IgM-nél ötöt. A társuló immunglobulinok nehézláncait egyesíti a C-végeknél (farokrész).
▪ SC-darab (secretory component), nevezik pIgR-töredéknek is. Az SC-darab a pIgR- (polymeric immunglobulin [Ig] receptor) szénhidrátfehérjéknek, ~70 kD nagyságú, a fehérjebontó enzimeknek ellenálló része. Körülfogja a kiválasztódó ellenanyagot (IgA), és védi a savas enzimek bontó hatásától. (A B kisábrán az sIgA [kiválasztó; s = secretory] kettős látható, a két immunglobulinját a J-lánc fogja össze, és körbeveszi az SC-darab.)
 Az oligoszacharidok elektronkötéssel kapcsolódnak a nehézlánc állandó
részéhez, de az IgM-ben főleg a J-lánchoz, az IgA-ban pedig az SC-darabhoz.
Az oligoszacharidok elektronkötéssel kapcsolódnak a nehézlánc állandó
részéhez, de az IgM-ben főleg a J-lánchoz, az IgA-ban pedig az SC-darabhoz.
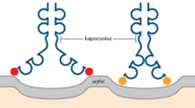
A kapocsrész* (hindge) a CH1 és a CH2 között van az Y szának felső részén; a nehézláncokat rögzíti egymáshoz egy vagy több S –S-kötéssel. Ez biztosítja az Ig-k hajlékonyságát, amely az antigének sokfélesége miatt szükséges. Minél nagyobb a kapocsrész (minél több aminosavból épül fel), annál rugalmasabb az ellenanyag. Az ellenanyagok kapocsrésze teszi lehetővé, hogy az egymáshoz közel vagy távol álló kötőhelyekhez is kapcsolódjanak.