fehérjemintázat a fehérjék szerkezeti elemeiből keletkező jellegzetes, törzsökös alakulat sajátszerű feladat ellátására; a fehérjéket sokszor ennek alapján ismerik fel. Többé-kevésbé önálló elemként viselkedik, amely elveszhet, többszöröződhet vagy változhat. Létrejöhet a fehérjék elsődleges és másodlagos szerkezetéből is. A fehérjék bonyolult felépítése a szerkezeti elemeknek szinte végtelen formálódási, társulási változatát teszi lehetővé, vagyis megszámlálhatatlan mintázat jön létre. A molekulák kizárólag ezeket azonosítva kapcsolódnak; ez a biológiai folyamatok fajlagosságának kulcsa. Néhány nagyon gyakori, sajátos mintázatot külön elnevezéssel illetnek, gyakorlati jelentőségük miatt.
■ Elsődleges szerkezeti mintázatok (vonalas mintázatok) sajátos feladatra (kötés, felismeréshely) összeállt 3–10 aminosav. Egysíkú mintázatok; innen a vonalas elnevezés. A nemzetközi irodalomban sokféle nevük van: sequence motif (szerkezetmintázat*), core motif, ligand-binding surfaces, ligand recognition pockets és linear motifs. Gyakoribb elsődleges szerkezeti mintázatok:
▪ A cinkujj mintázat két ciszteinből és két hisztidinből álló aminosavszakasza, amely a szerkezetet összetartó cink iont köti.
▪ A foszforilezési mintázat (linear phosphorylation motif), amely a foszforilezés helyét (phosphosite) kijelölő aminosavsor.
▪ Walker-mintázatok az ATP-t kötő fehérjék jellegzetes törzsökös mintázatai. Kétfélét: Walker-A- és Walker-B-mintázatot különböztetünk meg. (→Walker-mintázat)
▪ Az RGG/RG mintázat argininben (R) és glicinben (G) gazdag (RGG [arginin–glicin–glicin]). Ezernél is többféle fehérjében van jelen, számos sejtbiológiai folyamatban (génátírás, elő-mRNS kivágása, DNS-hiba jelzése, átfordítás, sejtvégzet szabályozása stb.) vesz részt. Ismert három és két RGG-s formája, és azoknak is számos változata; az RG-tag különáll.

Az ábrán az RGG/RG mintázatoknak a FUS (fused in sarcoma) RNS-t kötő fehérjében lévő három RGG-s formája (tri-RGG, kékkel jelölve) látható. A feltüntetett RGGRG mintázat RG- (arginin–glicin) tagja a sor végén van.
■ Másodlagos szerkezeti mintázatok (secondary structural motifs) a másodlagos szerkezeti elemek (α-csavarulat, β-lemez stb.) kapcsolódásából létrejövő, jellegzetes szerkezeti formák; törzsökös térszerkezeti egységek, többé-kevésbé önálló feladattal (kapcsolódás, felismerési hely stb.). Nevezik super secondary structuresnek is, utalva arra, hogy ezek a szerkezetek a másodlagos szerkezeti elemeknek már magasabb fokú szerveződései, de még nem harmadlagosak. A legegyszerűbbek 2–3 szomszédos másodlagos szerkezeti elemből formálódnak, a bonyolultabbak pedig ezekből tevődnek össze. Az ilyen mintázatok gyakran ismétlődnek egy-egy fehérje valamelyik részében, illetve más fehérjékben is hasonlóan fordulnak elő. Jellegzetességük, hogy hasonlóságuk ellenére az aminosav-összetételük nagyon eltérő is lehet. A másodlagos elemekből alakult mintázatok állhatnak α-elemekből (α-mintázatok); β-elemekből (β-mintázatok), pl. a görög mintázat (Greek-key motif), amelyet ellentétesen futó β-lemezek és az ezeket osszekötő β-fordulások alkotnak; legtöbbjükben azonban mindkettő előfordul (αβ-mintázatok), pl.az αβ-hordók (αβ barrels), amelyek nyolc α-csavarmenetből és nyolc β-lemezből állnak.
Néhány α-csavarodási alapmintázat:
▪ α-csavarodás–kanyar–α-csavarodás* mintázat (helix-turn-helix motif, HTH) rövid, visszaforduló kapcsolóval (aminosavakkal) összekötött két α-csavarodás. Az egyik legyakoribb DNS-hez kapcsolódó mintázat: a C-végi α-csavarodás illeszkedik a DNS nagygödrébe, az oldalágai pedig bázisfajlagosan kapcsolatba lépnek a nukleotidokkal. A génműködést szabályozó fehérjék legtöbbjében megtalálható.
Sokféle változata ismert (dihelical, trihelical, winged helix-turn-helix motif stb.).
▪ α-csavarodás–hurok–α-csavarodás* (egyszerűen: csavarodás–hurok–csavarodás*) mintázat (basic helix-loop-helix motif, bHLH) hurokkal lazán összekötött két α-csavarodás; az egyik rövidebb. Rugalmas mintázat, amely lehetővé teszi, hogy két ilyen mintázatot hordozó fehérje összekapcsolódjék, kettőst képezzen: a két rövid α-csavarodás fonódik össze. A hosszabbikon vannak a DNS-sel kölcsönhatásba lépő törzsaminosavak. Az átírásfehérjék egyik törzsmintázata, a kettős fehérjék szokásos keletkezési eleme.
Néhány α-csavarodás–hurok–α-csavarodás mintázat:
▪ cinkujj mintázat* (zinc finger motif, nevezik zinc-finger domainnak is) RNS-hez, DNS-hez kötődő mintázat; a nukleinsavakhoz kapcsolódó fehérjékben általános. Egy α-csavarodásból és két ellentétes lefutású β-lemezből áll, amelyeket négy aminosav (két cisztein, két hisztidin) segítségével cink ion köt össze. Van olyan is, amelyben négy cisztein van. Ezek a mintázatok ismétlődnek egymás után, jellegzetes ujjszerű kitüremkedésekkel. Az α-csavarodás aminosavai kapcsolódnak a DNS-sel a nagygödrében. Ez az egyik leggyakoribb mintázat; a fehérjeállomány ~3%-át teszi ki,
▪ leucinos zármintázat* (leucine zipper motif) két azonos α-csavarodásból áll, amely rövid szakaszon fonadékot (coiled coil) képezve társul, hasonlóan az ollóhoz. Az α-csavarmenet minden hetedik aminosava leucin. A leucinok a C-végen összerendeződnek, és víztaszító hatással hidrogénkötések jönnek létre. Az N-vég pozitív töltésű, ez a kötőgomoly, fajlagosan kapcsolódik a DNS ACGT bázissorával – az indítóhoz kötődve serkenti az átíródást. Az átírásfehérjék jellegzetes mintázata. Kialakulhat egyetlen polipeptidben, de két polipeptid között is.
▪ EF-kéz mintázat (EF hand), amelyik Ca2+-t kötő mintázat; a kalmodulin E- és F-csavarodása és összekötő szakasza alapján kapta a nevét.
 ■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.
■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.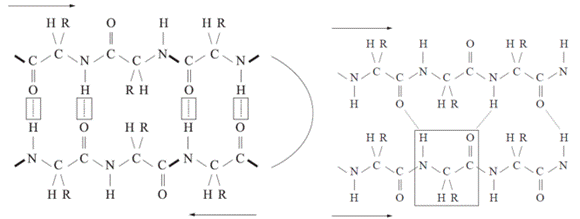 Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.
Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.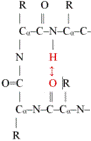 ■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.
■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.