fehérjeszerkezet A
fehérjék szerkezetében négyféle szerkezeti szintet (elsődleges, másodlagos,
harmadlagos és negyedleges) különböztetünk meg. Ez kiegészül a második és a
harmadik szint közötti két másodfeletti elemmel (gomoly, mintázat). Mindegyik
szintet az aminosavak sora határozza meg.
elsődleges szerkezet a peptidkötéssel kapcsolt aminosavmaradék-sor.
Voltaképpen a polipeptid. Az átlagos fehérje 300–400 aminosav-maradékból áll,
tömege: ~40 kDa. Van 50 és 2000 aminosav-maradékból összetevődő is, a fehérjék
aminosav-maradék tartománya tehát: 50–2000 aminosav-maradék.
másodlagos szerkezet az aminosavsor elfordulásaiból keletkező alakzat,
amelyet az egymáshoz közel kerülő atomok közt kialakuló hidrogénkötések
rögzítenek. Hidrogénhíd keletkezik a peptidkötés O- és N-atomja között; ez
könnyen kialakul az oxigén és a nitrogén részleges ellentétes töltése miatt. A
másodlagos kapcsolódások tehát a polipeptid gerincében jönnek létre, az
aminosavak oldalláncai nem vesznek részt benne.
Elfordulás az aminosavak oldalláncainak
különbözősége (kiegyensúlyozatlan állapot) révén következik be, és a
peptidkötés elektroneltolódása miatt csak az α-szénatom kétoldali kötésében
lehetséges, ezek szigma-kötések. Az N–Cα kötés elfordulásának szöge
a φ-szög, Cα–C kötésé a ψ-szög (→peptidkötés). A φ–ψ szögpárok által
létrehozott térhelyzetben az N–Cα–C–N atomsorból szabályosan
ismétlődő szerkezetek jönnek létre; ezek a másodlagos szerkezetek. Kialakulásuk
a szögpárok értékeitől függ; azokat az értékeket, amelyeknél kialakulhatnak, a
Ramachandra-leképezés mutatja. A szögpár nagysága azonban a peptidkötések
atomjai és az oldalláncok helyzete miatt behatárolt; a másodlagos szerkezetek
létrejöttéhez szükséges értékek a polipeptidnek csak egyes részein (elfordulási
sziget) jönnek létre, függően az aminosavsortól: attól, hogy milyen aminosavak
kapcsolódnak egymással.
A legjellegzetesebb másodlagos szerkezeti elemek az
α-csavar, a β-lemez és a β-fordulat.
 ■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.
■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.
Az α-csavarodás a polipeptidnek csak
hosszabb-rövidebb szakaszain alakul ki: egyes helyeken megszakad, mert a
hidrogénhíd nem jön létre. Ennek több oka lehet:
• A prolin gyűrűs szerkezetében a nitrogénatomnál nem
áll rendelkezésre hidrogénatom, és a fordulása is korlátozott; ezért nincs
gyűrűs aminosav az α-csavarvonal szerkezetben.
• Egymást taszító aminosavak között,
például két arginin között (negatív töltésű az oldallánc).
• Túl nagy az oldallánc; a társulás
térben nem lehetséges, ilyen a fenilalanin.
Az α-csavarodás elhelyezkedhet a fehérje bármely
részén; átlagosan 12 aminosav-maradék hosszúságú, az N-vége részpozitív, a
C-vég résznegatív, vagyis kétsarkú (dipole) szerkezet.
■ β-lemez (β sheet). Megnyúltan csavarodó
peptidláncból alakul ki a lánc visszakanyarodásaival (β-fordulás). A peptidlánc
ebben is csavarvonalszerű, de egy kanyarulatban csak két aminosav van, ezért
lapos. A visszakanyarodás következtében néhány aminosavnyi peptidszakasz
(β-redő, β strand) párhuzamosan helyezkedik el – egy irányban vagy ellentétesen
(az egyiknek az N-vége és a másiknak a C-vége van egymás mellett) –, közöttük
pedig hidrogénkötések képződnek, amelyek itt is a peptidkötések karbonil- és
NH-csoportja között (CO…NH) jönnek létre.
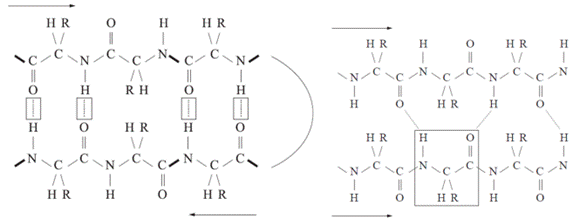 Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.
Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.
A többszörösen egymáshoz kötődött β-szálak alakítják ki
a β-lemezt, amelyből az oldalláncok kilógnak: felettük és alattuk helyezkednek
el. Az egymáshoz kapcsolódó β-szálak származhatnak egyetlen polipeptidből, de
kapcsolódhat hozzájuk másik polipeptid β-szála is (ábra). A β-szálak
különbözősége miatt a β-lemez nem sík, hanem redőzött (pleated β sheet).
Az aminosavak oldalláncai a lemez síkja
felett vagy alatt nyúlnak ki úgy, hogy a sorban egymást követő aminosavak
oldalláncai ellentétes kinyúlásúak, ezért redőszerű, hajtogatott. A párhuzamos
β-redőket hosszabb-rövidebb aminosavszakaszok kapcsolják össze; nemegyszer úgy,
hogy a β-lemez síkja felett/alatt α-csavar szerkezeteket alakítanak ki. Az
ellentétesen futó β-redőket néhány helyen aminosavas visszafordulások kötik
össze; ilyen pl a hajtűfordulás* (hairpin turn), amely két ellentétes irányú
β-szál között keletkezik; összesen két aminosav-maradékból áll. A β-lemez
lapszerű, gyakorta hajtékolt, nagyritkán hengeres formájú, és szokásosan a
fehérje belsejében van: a víztaszító peptidgerinc ugyanis szabadon van.
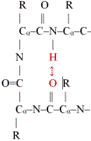 ■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.
■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.
■ Rendezetlen fehérjeszakaszok. Ezek a fenti
mintázatok egyikét sem tartalmazó részei a fehérjéknek, általában a fehérjék
zömét alkotják. A fehérjék alkalmazkodó képességét (kapcsolódás más
molekulával, térszerkezeti változás stb.) biztosítják, lehetővé téve a fehérjék
tevékenységének szabályozását. Talán idevehető a kapocsrész (hinge
region), amely változó hosszúságú hajlékony aminosavmaradék-sor, szokásosan két
gomoly között. Lehetővé teszi, hogy a gomolyok elmozduljanak egymáshoz
viszonyítva feladatuk ellátására. Nincs mindegyik fehérjében. A korábbi
irodalomban találkozunk a Ω-hurok (Ω loop) elnevezéssel, amely
rendszertelen, ismétlődő részek nélküli bonyolult szerkezetű fehérjealakzat.
Megkülönböztetése nem megalapozott.
másodfeletti elemek a →fehérjegomolyok és a →fehérjemintázatok.
harmadlagos szerkezet tertiary protein structure a fehérje (egyetlen polipeptid) háromirányú (3D)
elrendeződése, működőképessé válása; a hatócsoportok a felszínre kerülnek,
lehetővé téve, hogy kapcsolatba lépjenek más molekulákkal. A harmadlagos
szerkezet az egymástól távoli aminosavak közötti kölcsönhatások, alapvetően az
aminosavak oldalláncai között létrejövő kötések (leginkább hidrogénkötések,
ritkábban S–S- és ionos kötések), valamint a víztaszító hatás következménye. A
harmadlagos szerkezetet tehát a peptidkötések mellett kialakuló más elektron-
és nem elektronkötések hozzák létre, tartják fenn. A harmadlagos szerkezet
elsősorban a gombolyagfehérjékben alakul ki, a szálas fehérjékben (→keratin, kollagén, fibroin) kevéssé kifejezett, nem különül el élesen; térszerkezetüket
valamelyik másodlagos szerkezeti elem uralja. A fehérjék a harmadlagos
szerkezeti formában állandók, az energia szempontjából ez a leggazdaságosabb
helyzetük (native state).
A harmadlagos térszerkezetet is
alapvetően az aminosavak sorrendje határozza meg, és önmagától is kialakul. A
dajkafehérjék (chaperonok) elősegítik a harmadlagos szerkezet formálódását:
megakadályozzák, hogy a sejtplazmában állandóan keletkező fehérjék – a
harmadlagos szerkezet lassú formálódása miatt – egymással összekapaszkodjanak
fehérjehalmazokká.
Lényeges, hogy a fehérjék harmadlagos
szerkezete környezeti és más hatásokra (más fehérje társulása, foszforilezés
stb.) felszakadhat, tehát nem állandó. Ennek biológiai jelentősége van, hiszen
a térszerkezet változása, változtatása a fehérjék ki-be kapcsolásának a
leggyakoribb módja, a fehérjeműködés alapvető szabályozója.
negyedleges szerkezet quaternary protein structure két vagy több harmadlagos szerkezetű polipeptid
kapcsolódásából létrejövő nagymolekula (többes fehérje). Az egyes
polipeptideket alegységeknek nevezzük. A negyedleges szerkezet az alegységek
egymáshoz viszonyított térhelyzetét jellemzi. A polipeptidek közötti
kölcsönhatásban ugyanazok a kötések (London-erők, hidrogénkötések, ionkötések
és S–S híd) vesznek részt – vagyis alapvetően gyenge kötések.
A polipeptidek száma szerint
megkülönböztetünk kéttagú (dimer, kettős), háromtagú (trimer, hármas), négytagú
(tetramer, négyes) stb., pártagú (oligomeric proteins) és soktagú (polymer)
fehérjéket. Ezek ekként, tehát kéttagúként, háromtagúként stb. hatásosak.
Kapcsolódhat azonos (homo-…mer) vagy különböző polipeptidlánc (hetero-…mer).
Az összekapcsolódott polipeptidek
szétválhatnak, majd újra egyesülhetnek, függően a működésüktől. A szétválást,
újra egyesülést az teszi lehetővé, hogy azokon a felületeken, ahol a kötődés
létrejön, egymást kiegészítő molekulák vannak – a kiegészítő láncok egymást
felismerik –, és hogy a nem kiegészítő láncok között nem képződik erős
kapcsolódás. A polipeptidek között tehát egy sajátságos kölcsönhatás van, amely
a fehérjék működését is meghatározza, szabályozza – ez a fehérjék önrendelkező
képessége.
Negyedleges szerkezetűnek tartjuk a más
molekulát (hem, szénhidrát, RNS, lipid stb.) tartalmazó fehérjét is.
 ■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.
■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg. Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.
Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik. ■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.
■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.