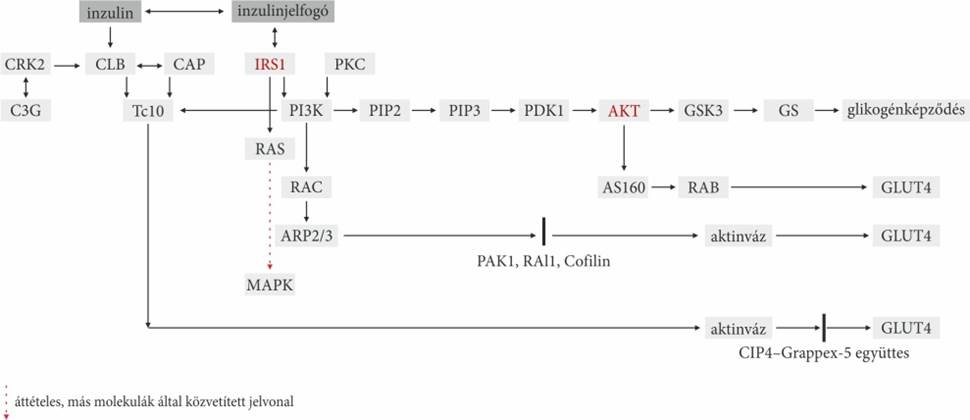
 inzulin jelátviteli útjai Az inzulin és az inzulinjelfogó kapcsolódásával indul
el. A kapcsolódás hatására a
β-alegységének szerkezete módosul, és a jelfogó foszfotirozinjai foszforilezik
egymás tirozinjait (kereszt foszforilezés); foszfotirozinok keletkeznek. A
foszfotirozinok kötőhelyek, hozzájuk többféle, de csak az SH2- vagy PTB gomolyt
hordozó fehérje kapcsolódhat. A jelvivő molekula irányítja, hogy a fehérje
melyik foszfotirozinhoz csatlakozzék, de közvetlenül a foszfotirozinok körüli
aminosavsorrend szabja meg a kötődés helyét. Egyazon kettőzött jelvivő–jelfogó
együttesen sokféle célfehérje foszforileződhet, sokféle sejtválasz keletkezhet.
Ez lényegi különbség, például a G-fehérjékhez kapcsolt jelátvitellel szemben. A
jelmolekulával társult inzulinjelfogó foszfotirozinjához a, PTB gomollyal bíró
IRS1 (inzulinreceptor-szubsztrát-1) kapcsolódik és foszforileződéssel
gerjesztődik, ez a másodlagos jelvivő.
inzulin jelátviteli útjai Az inzulin és az inzulinjelfogó kapcsolódásával indul
el. A kapcsolódás hatására a
β-alegységének szerkezete módosul, és a jelfogó foszfotirozinjai foszforilezik
egymás tirozinjait (kereszt foszforilezés); foszfotirozinok keletkeznek. A
foszfotirozinok kötőhelyek, hozzájuk többféle, de csak az SH2- vagy PTB gomolyt
hordozó fehérje kapcsolódhat. A jelvivő molekula irányítja, hogy a fehérje
melyik foszfotirozinhoz csatlakozzék, de közvetlenül a foszfotirozinok körüli
aminosavsorrend szabja meg a kötődés helyét. Egyazon kettőzött jelvivő–jelfogó
együttesen sokféle célfehérje foszforileződhet, sokféle sejtválasz keletkezhet.
Ez lényegi különbség, például a G-fehérjékhez kapcsolt jelátvitellel szemben. A
jelmolekulával társult inzulinjelfogó foszfotirozinjához a, PTB gomollyal bíró
IRS1 (inzulinreceptor-szubsztrát-1) kapcsolódik és foszforileződéssel
gerjesztődik, ez a másodlagos jelvivő.
■ A
tevékeny (foszforilezett) IRS kétféle enzimet (RAS, PI3K) is köthet, és
foszforilez.
▪ A PI3K (foszfoinozid-3-kináz) a PIP2-t PIP3-má
alakító enzim. A PIP (foszfatidil-inozitol-4-foszfát) foszfolipid; PIP3
formában kapcsolja, és foszforilezi a PDK1-t (foszfatidil-inizitol-függő
kináz-1), ez az enzim az AKT-ot tevősíti, amely azonos a fehérje-kináz-B-vel.
Az AKT kétféle molekulával is kapcsolatba léphet:
- A GSK3-mal, azon keresztül a GS-sel, és
fokozódik a glikogén képződése.
- A másik az AS160 – RAB vonal: az AKT az
AS160-at (GLUT4-et szállító fehérje) foszforilezi a GTP-áz részén. Ennek
következtében, a GEF (GDP/GTP exchange factor) segítségével, GTP felvételével
tevősödik a RAB-fehérje; ez fokozza a GLUT4-t, a sejtek cukorfelvételét.
A PI3K
tevősítésével serkentődik a CYP17A1 enzim is, amely a
prognenolon–17OH-prognenolon átalakulást segíti elő, és ezzel fokozza az
androgének keletkezését is (az ábrán nincs feltüntetve).
- Másik láncfolyamat indulhat PI3K-tól a RAC (az
aktinvázat szabályozó fehérje-kinz) irányába. Ez az ARP2/3, majd a PAK1, RAl1, Cofilin és az aktinvázon át a GLUT4-et
fokozza.
•
Az IRS1-től (a PI3K-tól független jelközvetítés) a RAS (GTPáz) kötésével
beindul a MAPK-jelvonal, a sejtburjánzás. Az IRS1 és a RAS kapcsolódásához a GRB2 kapcsoló- és a SOS
cserélőfehérje együttese szükséges. A MAPK tevősítésével gátlódik az androgének
képződése.
■ A
jelvivővel társult jelfogó – függően a jelvivőtől – IRS1 helyett CLB-t is
köthet a foszfotirozinjához. A CBL állványfehérje,
amelyik a CAP (CBL-associated protein) közvetítésével kapcsolódik az
inzulinjelfogóhoz. A CAP az N-végével a sejthártyához rögzül, a C-végével köti
a CLB-t. Másrészt a TC10-et helyezi a sejthártyához. A CLB foszforilelézésével
a CLB –CAP együttes elszakad a jelfogótól, és lehetővé válik, hogy a CRK2–C3G
együttes kapcsolódjék hozzájuk. A C3G cserérőfehérje (insulin-regulated guanine
nucleotide exchange factor, GEF), amely TC10-fajlagos: a tétlen GDP-t kötő
TC10-et átalakítja GTP-t kötő hatékony TC10-zé. A TC10 tevékenysége átmeneti, a
C3G hatásától függ. A TC10 – a RAC1-hez hasonló – Rho-családhoz tartozó kis
GTPáz, a sejtvázra hat. A TC10 a sejthártyához irányítja CIP4–Grappex-5
együttest, és ezáltal fokozza GLUT4 sejthártyához jutását.
■ Végeredményben az inzulin jelátvitelén keresztül a
sejtek cukorfelvétele fokozódik leginkább, GLUT4 közreműködésével. A sejtek glükózfelvétele következtében
csökken a vércukorszint.
Ugyanez
a folyamat játszódik le az IGF1 és az IGF1-jelfogó társulásakor, de akkor is,
ha az inzulin az IGF1- jelfogóhoz vagy fordítva: az IGF1 az inzulinjelfogóhoz
fűződik.
Az inzulin sejtburjánzó hatása a RAS–MAKT
jelvitellel jön létre.
Kóros
körülmények között (inzulinérzéketlenség, elhízás, soktömlős petefészekbaj)
részben vagy egészben az IRS1 szerinjei foszforileződnek. Mivel ezek az enzimek
nem tevősítik sem PI3K-t, sem MAPK-ot: elmarad az inzulin- anyagcserét, a
sejtburjánzást és az androgénképzést befolyásoló hatása, főleg az
androgénképződés fékezése – valószínűleg ezért keletkezik több androgén.
