jelközvetítés* signaling pathway a jelzés továbbadásának sejten belüli folyamata. Az idegsejtek ingerületvezetésétől eltekintve, molekulák végzik; a jelfogótól a végrehajtó molekula keletkezéséig vagy tevősítéséig, a jelzésvégrehajtásig terjed. Ha a jelátadás már önmagában sejtválaszt eredményez, például megnyílik az ioncsatorna, a jelútnak ez a része kimarad. Ha a jelátadás közvetlenül átírásfehérjét tevősít, a jelközvetítés többnyire egymolekulás: az átírásfehérje bejut a sejtmagba, közvetve vagy közvetlenül kötődik a génhez, és elindítja a sejtválaszt – ez jellemző például a szteroidok jelközvetítésére. Legtöbbször azonban fehérjék stb. gerjesztődnek egymás után foszforileződéssel vagy csupán két fehérje társulására létrejövő térszerkezeti változás következtében.
jelközvetítési láncfolyamat Szokásosan a jelátvitellel gerjesztett enzim másik fehérjét tevősít; ezt sejtbeli hírvivőnek*, (intracellular messenger) mondjuk. Avagy valamilyen gyorsan terjedő kismolekula (például cAMP) vagy ion (kalcium) megjelenésével jár; ez utóbbiakat másodlagos hírvivőnek* (secondary messenger) nevezzük. Előfordul, hogy ugyanaz a másodlagos hírvivő többféle jelátadás (más-más jelvivő–jelfogó kapcsolat) hatására is megjelenik a sejtben.
A másodlagos hírvivő vagy a sejtbeli hírvivő további fehérjé(ke)t, enzime(ke)t gerjeszt, ezek megint újabbat és így tovább, vagyis a folyamat ismétlődő lépésekből áll, ezért nevezzük láncfolyamatnak. A folyamatban szereplő molekulák a jelközvetítők* (intracellular mediators). Előfordul, hogy valamely tevősített jelközvetítő a sejt egyik részéből, akár távolabbi pontról is, a másikba, leginkább a sejthártyához vándorol, hogy ott kapcsolódjék másik fehérjével – egy-egy láncszem csupán ezért iktatódik be.
A jelközvetítés a végrehajtó molekula (általában átírásfehérje) gerjesztésével zárul. A folyamat nagyon gyors, és teljesen szabályozott. Egy-egy láncfolyamat tehát a jelfogó bekapcsolásától sejtbeli fehérjék egymást követő tevősítésén át a végrehajtó molekuláig terjed. A láncnak bármely tagja többféle enzimet is bekapcsolhat, így a folyamat több irányban is haladhat, de egyszerre rendszerint csak egy irányban megy végbe.
A jelközvetítés az enzimláncon keresztül tehát meglehetősen bonyolult és szerteágazó lehet. Ennek számos előnye van:
• Egyfajta sejtműködést, például a cukorfelvételt, többszörös jelközvetítéssel, sőt többféle jelvitellel is biztosítja a sejt. Ezek között külön-külön és együttesen is összeköttetés (cross talk) van, egyébként nem valósulhat meg az összehangolt szabályozás. Ez a lényegi különbség a jóval egyszerűbb vagy akár csak egyetlen molekulával végbemenő jelközvetítéssel szemben. Például: ha az inzulin jelútban közvetlen kapcsolat lenne a jelfogó és a glikogén-foszforiláz között, a Ca2+ nem kapcsolódhatna be a szabályozásba, azaz a sokoldalú irányítás nem lenne lehetséges. (→inzulinjelút)
• A közvetítések elágazásai további biztonsági, ellenőrző utakat hoznak létre.
• Lehetővé teszi a fehérjekapcsolatok kétirányú kölcsönhatását, azaz, hogy a folyamat oda-vissza is mehet, elősegítve a rugalmas szabályozást.
• Ugyancsak a soklépcsős láncfolyamattal valósítható meg az, hogy a jel a sejt több pontját is elérje, vagy eljusson az egyik szervecskétől a másikba stb.
• Egy-egy többfelé ágazó jelközvetítés rendszerint sokféle sejtfolyamatot vált ki. Ha ezek külön-külön jelközvetítéssel mennének végbe, jóval több molekula részvételére lenne szükség és jóval körülményesebb lenne – a láncfolyamat tehát „takarékos” is - a törzsfejlődés folyamán alakult ilyenné.
A jelzés a jelközvetítéssel általában felerősödik azáltal, hogy minden lépéssel több és több célmolekula gerjesztődik. Például: egyetlen adenilát-cikláz nagyon sok cAMP-t képez; ezek pedig sok-sok fehérje-kinázt serkentenek, azok még több foszforilázt stb. Vannak azonban olyan jelközvetítések is, amelyekben egy molekula csak egy célmolekulával találkozik, úgymond „dobozba (cassette) zárt”.
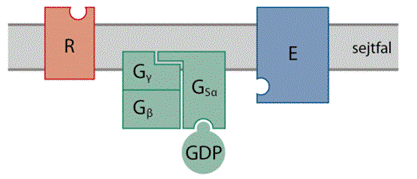
jelközvetítők zömében enzimek, de kapcsoló- cserélő- és állványfehérjék, vagy más feladatuk is lehet. Az állvány- és a kapcsolófehérjék bevonásának a célja a jelátadónak és célmolekuláinak az összehozása. A jelközvetítésben legtöbbször G-fehérjék vagy más néven GTP-ázok a kapcsolófehérjék: bekapcsolt állapotukban GTP-t kötnek; ennek segítségével foszforilezik az első jelközvetítő fehérjét. A cserélőfehérjék pedig a G-fehérjék bekapcsolásában vesznek részt, segítik a GDP leválását, lehetővé téve a GTP kötődését – mert a G-fehérjék maguk erre nem képesek. A jelközvetítés enzimei leginkább fehérje-kinázok (foszfátcsoportot szállítók); ezek a tirozin vagy a szerin, illetőleg a treonin oldalláncát foszforilezik ATP felhasználásával. A szerin-treonin-kinázok a treoninra és a szerinre is képesek foszfátot kapcsolni, ami az így módosított enzimet serkentheti vagy gátolhatja is, az adott enzimtípustól függően. Gyakoriak az ATPázok, GTPázok, valamint a foszfatázok (levágnak a célmolekuláról foszfátcsoportot [PO43-], defoszforilezés) és a foszforilázok (foszfátiont kapcsolnak ATP felhasználása nélkül), továbbá másodlagos hírvivőként a cAMP (cyclic adenosine monophosphate), cGMP (cyclic guanozin monophosphate), diacilglicerol (DAG), a zsírsavak, az inozitol-triszfoszfát (IP3), sejthártyához kötött foszfoinozitidek és a Ca-ionok. A nitrogén-monoxid (NO) bizonyos értelemben szintén tekinthető másodlagos hírvivőnek is, hiszen a sejtben is viszi a jelzést.
jelszakasz* a jelközvetítés valamely része.