 laminin laminin ~900 kDa tömegű
szerkezeti szénhidrátfehérje; az alaphártya meghatározó eleme. Három, α-, β- és
γ-láncból tevődik össze; ezeket S–S-hidak kötik egymáshoz. Szerveződése a
sejtcsövezetben megy végbe, majd szénhidrát kötődik hozzá a Golgi-rendszerben.
Ebben a formában kerül a sejten kívülre. A láncok különböző polipeptidek;
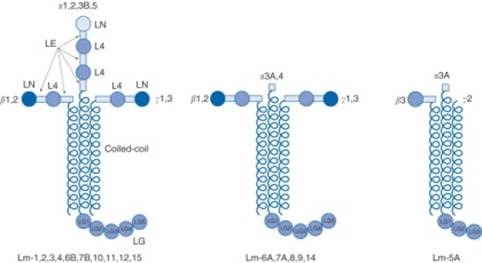
tizenegyféle (5 α, 4 β és 3 γ) ismert, lehetővé téve 15 testvérmás
kialakulását. Az egyes laminineket a láncok szerint számozva különböztetjük
meg, pl. az α1-, β1- és γ1-láncot tartalmazó a laminin 111; a laminin 511 pedig
az α5-, β1- és γ1-polipeptidből áll. A lamininek kereszt, Y vagy pálcika
alakúak, függően a láncok szerkezetétől. Közös elemeik: az N-végi gomoly (LN),
az EGF-szerű gomoly (LE), a laminin-4 gomoly (L4) (ezek a rövid karok) és a
fonadékos hosszú kar. Az α-lánc sajátos szerkezete a C-végi nagy, gömbgomoly
(LG), amely öt egységből (LG1–5) tevődik egybe. (Ábra forrása: Encyclopedia of Respiratory System; Miner és Nguyen, 2006.) A különböző lamininek
szövetsajátosak.
laminin laminin ~900 kDa tömegű
szerkezeti szénhidrátfehérje; az alaphártya meghatározó eleme. Három, α-, β- és
γ-láncból tevődik össze; ezeket S–S-hidak kötik egymáshoz. Szerveződése a
sejtcsövezetben megy végbe, majd szénhidrát kötődik hozzá a Golgi-rendszerben.
Ebben a formában kerül a sejten kívülre. A láncok különböző polipeptidek;
tizenegyféle (5 α, 4 β és 3 γ) ismert, lehetővé téve 15 testvérmás
kialakulását. Az egyes laminineket a láncok szerint számozva különböztetjük
meg, pl. az α1-, β1- és γ1-láncot tartalmazó a laminin 111; a laminin 511 pedig
az α5-, β1- és γ1-polipeptidből áll. A lamininek kereszt, Y vagy pálcika
alakúak, függően a láncok szerkezetétől. Közös elemeik: az N-végi gomoly (LN),
az EGF-szerű gomoly (LE), a laminin-4 gomoly (L4) (ezek a rövid karok) és a
fonadékos hosszú kar. Az α-lánc sajátos szerkezete a C-végi nagy, gömbgomoly
(LG), amely öt egységből (LG1–5) tevődik egybe. (Ábra forrása: Encyclopedia of Respiratory System; Miner és Nguyen, 2006.) A különböző lamininek
szövetsajátosak.
Az alaphártyai laminin kölcsönhatásban van sejtfelszíni jelfogókkal (integrinek, α-distroglikan…), ez irányítja hálózatszerű szerveződését; nélküle nem képződne alaphártya. Csak a három rövidkaros lamininek képesek az alaphártya létrehozására, a többi ezekhez kapcsolódva vesz részt az alaphártya felépítésében. A jelfogóhoz a hosszú kar C-végi gomolya kötődik. Kapcsolódás jön még létre a proteoglikan-arginin és γ1-lánc között, tovább erősítve a lamininhálózat és a sejtfelszín összekötődését.
A laminin hálózatos kialakulása részben Ca2+-függő és Ca2+-független visszafordítható folyamat – ellentétben a kollagénhálózattal, amelyet elektron-keresztkötések rögzítenek. Az integrinek és az α-distroglikan jelfogók sejtbeli gomolya olyan állványfehérjéket köt, amelyek a sejtvázzal kapcsolódnak, így jön létre az alaphártya és a sejtváz összekötődése, lehetővé téve a sejtek tapadását és mozgását.