elektronkötés* covalent
bond (egyéb elnevezések: atomkötés, elektronpárkötés,
kovalens kötés, homopoláris kötés) a vegyülő atomok egy-egy
párosítatlan elektronnal létrejövő kapcsolódása molekulává; közös
elektronpárral létrejövő kötés. A közös elektronpár a vegyértékhéjon van,
meghatározott irányú: a két atom között helyezkedik el. A közös elektronpárt kötő
elektronpárnak nevezzük, szemben az vegyértékhéjon lévő nem kötő
elektronpárral, amelynek szabad elektronpár a neve.
Az
elektronkötéseket jellemző legfontosabb ismérvek:
■ Kötésszám a kötő elektronpárok száma.
Azt a kötést, amelyben egy elektronpár vesz részt,
egyszeres kötésnek hívjuk. Ebben tehát mindkét részt vevő atom egy-egy
elektronnal van jelen. A több vegyértékű atom képes több egyszeres kötést
létrehozni. Ezek száma (kötésszám) attól függ, hogy hány elektron társulhat a
vegyértékhéjon, a kötések kialakulásakor lévő elektronokhoz. A két kötő
elektronpárral létrejövő kötést kettős, a három kötő elektronpárral
létrejövőt pedig hármas kötésnek nevezzük.
Az elektronkötést a vegyülő atomok
szerkezeti képletében az atomok vegyjele közötti vízszintes vonallal jelöljük (C–H).
A kettős, illetve a hármas kötéseket két (C=O), illetve három (C º
C) vízszintes vonallal jelöljük.
Az atom külső elektronhéján
(vegyértékhéjon), vagyis a vegyértékhéjon nem lehet több nyolc elektronnál. Egy
atom tehát nem létesíthet több mint négy egyszeres kötést, mivel egy egyszeres
elektronkötésben két elektron van. Kívétel a hidrogén és a hélium, mert ezekben
legfeljebb 2 elektron lehet vegyértékhéjon.
Ha a vegyértékhéjon nyolc elektron van,
az atom telített, ez az állékony állapot, a molekula ennek elérésére törekszik,
ezért jönnek létre az elektronkötések. (Ezt nevezzük nyolcas vagy
nemesgázszabálynak, oktettszabály)
Egy kötést létesíthet pl. a hidrogén, a
klór, kettőt az oxigén, hármat a nitrogén, négyet a szénatom.
■ Kötéstávolság (kötéshossz) az egymással
kötésben lévő atomok magjai közötti közepes távolság. Ez jól meghatározott,
noha az atomok egymás felé rezegnek. Az elektronkötésben is nagyon jelentős,
mert ha az atomok a közepes kötéshossznál
közelebb kerülnek egymáshoz, már taszítják egymást; a kötési energia csökken. A
szokványos kötési távolság 0.07–0,3 nm (70–300 pm). A kettős kötések távolsága
kisebb, mint az egyes kötéseké. Minél nagyobb az atom, annál messzebb vannak a
magok egymástól, ezért annál hosszabb a kötéstávolság.
■ Kötési energia két atom közötti kötés
képződését vagy felszakítását kísérő energiaváltozás 1 mol molekulában; az
előbbi negatív, az utóbbi pozitív előjelű. Értéke: kJ/mol. Pl. H2
kötésenergiája 438 kJ/mol, a vízzé pedig 463 kJ/mol.
A kötési energia nagysága függ az atomok
méretétől (minél nagyobb az atom, annál kisebb a kötési energia, mert hosszabb
a kötéstávolság), az atom töltésétől, a kötő elektronpárok számától és az
elektronegativitástól, vagyis attól, hogy az atom mennyire vonzza a kötő
elektronpárt. (→elektronegativitás) A kettős kötés energiája nagyobb, mint az
egyszeres kötésé, de nem kétszer akkora, mert a szigma-kötés energiája nagyobb,
mint a pi-kötésé.
■ Kötésszög a kapcsolódó atomok kötései által
bezárt szög. Kialakulásában a szabad elektronoknak is jelentős szerepe van. A
kötésszög a molekula téralakzatát határozza meg.
Az
elektronkötések töltésviszonyai:
Ha a két atommag körül az elektronok eloszlása:
▪ Egyenletes, semleges elektronkötésről (apolar
covalent bond, apoláris kovalens kötés) beszélünk: a kötő elektronpárok
egyformán helyezkednek el a két atommag erőterében. Ilyen az azonos atomokból
álló molekulák (O2, H2) között jön létre. Általánosabban:
olyan atomok között, amelyeknek az elektronegativitása azonos vagy közel
azonos.
▪ Ha nem egyenletes az elektronok eloszlása (különböző
atomokból álló molekulák [HCl]), vagyis az elektronpár eltolódik valamelyik
atom irányába, résztöltésű elektronkötésről (polar covalent bond, poláris
kovalens kötés, polarizált atomkötés) van szó. A résztöltésű
elektronkötés tehát két különböző elektronegativitású atom közötti
elektronkötés.
Ebben a kötő elektronpárok többet vannak
a nagyobb elektronegativitású atom körül, vagyis az eloszlás részpozitív (δ+)
és résznegatív (δ-). Kétsarkú molekula (dipólusmolekula)
jön létre. Minél nagyobb a különbség az elektronegativitásban, annál
kifejezettebb a kétsarkúság, nagyobb a résztöltés. Jellegzetes példa a víz: az
oxigén (a molekula közepe) δ-, a hidrogén (végek) δ+.
Az
elektronkötések formái:
Kétféle elektronkötést különböztetünk meg: a szigma-kötést
(σ-kötés) és a pi-kötést (π-kötés). (→pi-kötés, szigma-kötés)
 ■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
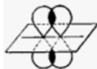
Az elektronhéjak átfedése miatt az atomok
elektronpályái megváltoznak, molekulapályákká alakulnak. Pl. két hidrogénatom
kötődésekor a hidrogénatomok gömb alakú elektronpályái tojásdaddá alakulnak.
Az ábrán a fekete pontok jelölik a hidrogénatomok magjait. Jól látható, hogy az
elektronfelhő (vörössel jelölve) legnagyobbrészt a két atommag között van; itt
a legnagyobb az elektronsűrűség. (Forrás: Wikipédia.) Az ilyen molekulapályát σ-molekulapályának
nevezzük.
A szigma-kötés van a legalacsonyabb
energiaszinten, ezért minden elektronkötésben van szigma-kötés. Kötési
energiája nagyobb, mint a pi-kötésé. Egy elektronkötésben csak egy szigma-kötés
lehetséges, így a szigma-kötések száma egyezik a vegység (a központi atomhoz
kötődő atomok) számával. (→vegység)
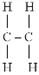
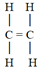 ■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
A
szervezetben a hidrogén (H), az oxigén (O), a nitrogén (N), a szén (C), a kén (S) és a foszfor (P) képezi
az elektronkötések zömét. Ez a hat elem, meghatározóan az első négy, az élő
szervezet tömegének 99%-át adja.
kiralitás chirality kézszerűség; az a
jelenség, hogy valamely molekula tükörképi párja nem hozható vele fedésbe. A chiral
a görög ’kéz’ jelentésű szóból ered. (→téralakzati azonmások)
királis chiral kézszerű, térközponti; chiral molecule (királis
molekula) olyan molekula, amely egyetlen összemérhetőségi művelettel sem
hozható fedésbe a tükörképével.
Ellentéte az achilar molecule (akirális
molekula); ez olyan molekula, amelynek tükörképi párja vele fedésbe
hozható. Magyarul: tükörmolekula. Az azonmásság szempontjából nincs
jelentősége.
kiralitáscentrum chiral center/atom térközpont*, térközponti
szénatom*; négy különböző vegységet (atomot és/vagy atomcsoportot) tartalmazó
szénatom. (Egyéb nevei: sztereocentrum, , asszimetriás
szénatom, asszimetriacentrum, királis szénatom; chiral
carbon, asymmetric carbon, optically active carbon, stereo carbon, stereo
center, chiral center).
sejtkör molekulatörténései A sejtkört alapvetően háromféle fehérje vezérli és
szabályozza. Ezek a ciklinek, a CDK (ciklin dependen kinase) és a CDK gátlók
(CDKI). A sejtkör alatt szakaszfüggően keletkeznek. A ciklin a CDK-vak
kapcsolódik, csak együtt hatásosak. A CDK szerin/treonin fehérje-kináz,
foszforilez, de csak azt a fehérjét, amelyet a ciklin kapcsol, önmagában
hatástalan. A ciklin a szabályozó egység, ő választja ki a foszforilezendő
fehérjét. A CDK gátlók akadályozó hatásukkal szabályoznak.
Természetesen más fehérjék is részt
vesznek. A két legjelentősebb a CAK és az APC. Az CDK a ciklinhez kapcsolódva
válik tevékennyé, de nem lesz teljes értékű. A megfelelő foszforilezéséhez
szükséges, hogy a CAK a T-hurokra foszfátcsoportot helyezzen. A CDK tehát csak
a ciklin és a CAK együttes hatására képes megfelelően foszforilezni.
Az APC egy E3-ubikvitin-ligáz, a sejtkör lebontandó fehérjéit jelöli
(kapcsolódik hozzájuk), hogy a 26S fehérjebontacsban szétessenek. Fehérjebontással
szabályoznak. Meghatározók, amikor a ciklin-B-ket kell hirtelen lebontani az
M-szakaszban.
■ G1,
G1–S átmenet A pRb a
kulcsszereplő, kapcsolódik az E2F átírásfehérjéhez, ennek következtében
a kettős áthelyeződik az E2F indítójának tevősítő részéről a gátló részére. Az
E2F társul a kettősödési társával, a DP1, ez része a pRb–E2F együttesnek, amely
a DNS-hez az E2F indítójánál kapcsolódik. Az pRb–E2F célgénjei elősegítik a
G1–S átmenetet, de a DNS-kettőződését is. Néhány célgén: DNS-polimeráz,
A-ciklin, timidin-kimáz, dihidrofolát-reduktáz, CDK1/2 stb.
A G1–S átmenet a pRb gátló hatásának
megszüntetésével, a pRb foszforilezésével indul. A felszabadult E2F beindítja a
célgéneket, az S-szakaszhoz szükséges enzimek termelését. Megtörténik az
előkészület a DNS kettőzésre.
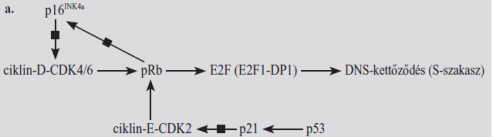 A pRb foszforilezését ciklin-D–CDK4 vagy CDK6 végzi a G1-szakasz
közepétől az R-pontig.
A pRb foszforilezését ciklin-D–CDK4 vagy CDK6 végzi a G1-szakasz
közepétől az R-pontig.
A ciklin-D–CDK4/6 a sejtkörnek ebben az időszakban
keletkezik osztódás jelzések hatására, amelyeket sokféle jelút közvetít.
Elsősorban a MAPK; innen cMYC, cFOS, cJUN átírásfehérjék szállítják az üzenetet
a DNS-hez.
A folyamat
fokozatos, és önmagát erősíti: a pRB folyamatosan válik el az E2F1–DP1 fehérjétől, egyre több gén íródik át, többek között
a ciklin-E génje is. Az így keletkező ciklin-E–CDK2 pár is foszforilezi a
pRb-t, ami további E2F1–DP1 felszabadulásához
vezet, ez pedig még inkább serkenti a ciklin-E gént, még több ciklin-E–CDK2
keletkezik, tovább fokozva a pRB foszforilezését, főleg a G1-szakasz végén és
a G1–S átmenetben.
Voltaképp a ciklin-E–CDK2 irányítja a sejtet az S-szakaszba. Valószínű azonban, hogy a ciklin-E–CDK2 más módon is segíti
az átmenetet az S-szakaszba. A CDK2–ciklin-E saját gátlóját, a p27Kip1 CDK-gátlót is
foszforilezi, vagyis gátolja, így a hatása még kifejezettebb.(Ábrán nincs
jelölve.)
Az R-ponttól jelennek meg ciklin-D–CDK4/6 gátlói, és
elkezdődik a ciklin-D lebomlása. A p21 és a p16 a meghatározó CDK-gátló, az
átmenet fő szabályozója. A p21 a p53 hatására képződik, akadályozza mind a
három CDK-t (CDK2, -4 és -6). A p16 (az ábrán p16INK4a) gátolja a
ciklin-D–CDK4/6 tevékenységét. A pRB foszforilezésére képződik, annak
ellensúlyozására.
■ S-szakasz Az S-szakaszban a ciklin-E–CDK2 hatása még tart, de
fokozatosan alábbhagy – a ciklin-E lebomlik –, helyét a ciklin-A–CDK2 veszi át,
és irányit. A ciklin-E–CDK2 a kettőződéshez szükséges fehérjéket, enzimeket
gyűjti össze. Ha elegendő az egyszeri kettőződéshez, a ciklin-A– CDK2 szintje
emelkedi, és visszaszorítja a ciklin-E–CDK2 képződését. Ezzel, valamint a
DNS-kettőződési rendszer egyik tagjának, a CDC6-nak a foszforilezésével
akadályozza meg a kétszeres kettőződést.
A ciklin-A–CDK2 az S-szakaszban
a sejtmagban van, előmozdítja a DNS-kettőződés indítását és véghezvitelét. A
szakasz végén kapcsolódik a CDK1-gyel.
A DNS-másolódás időben szabályozott. Azt az időrendet,
amelyben egyes DNS-részek másolódnak a nemzetközi irodalom replicatiom
timingnak nevezi, magyarul osztódásidőzítés*. Törzsökös folyamat,
szabályozatlansága betegséghez vezet. Elsősorban a kromatin állapota irányítja.
A DNS kettőződés végén két, testvér kromatidból álló
kromoszóma keletkezik, tehát négy kromatida. Ezt nevezik tetradnak, magyarul
négyes.
■ G2, G2–M átmenet. A
ciklin-A–CDK1 és a ciklin-B–CDK2 irányítja; az utóbbi a G2-szakasz
végén képződik, az osztódásba (M-szakaszba) lépés előtt fokozottan – ez indítja
az osztódást olyan fehérjék foszforilezésével, amelyekre szükség van az
M-szakaszban. A ciklin-A–CDK1 a késői S-szakasztól a G2-szakaszig
marad meg, itt a ciklin-B veszi át a helyét.
A
ciklin-A–CDK2, amely az S-szakaszban a sejtmagban van, a G2-ben
bejut a sejtközpontba, és kötődik az osztódási orsóhoz. A részletek nem
ismertek
■ M-szakasz (M- [mitosis] phase, mitozis) a sejt két sejtté
válásának az ideje: a sejt kettőzött DNS-állománya a sejtplazmával
együtt egyenlően szétosztódik két sejtbe; két azonos sejt keletkezik, amelyeket
leánysejteknek nevezünk. Lényegében két eseményből áll: a
kettőződött DNS egyenlő szétválásából, és a sejtplazma lefűződéséből
(cytokinesis). A ciklin-A–CDK1 és a ciklin-B–CDK1
teszi lehetővé az M-szakaszba lépést. A ciklin-B–CDK1 már az S-szakasz végén
megjelenik, a sejtmagban folyamatoson a sejtosztódás felé irányítja
sejtet. Mennyisége és tevékenysége állandó az osztódásig, ahol hirtelen
megszűnik a ciklin-B lebontása miatt. Ez szükséges ahhoz, hogy a sejt elhagyja
az M-szakaszt, újra a G1-szakaszba jusson. A ciklin-B–CDK1 hirtelen lebontását az APC (anaphase-promoting
complex) végzi, amely E3
ubikvitin-ligáz. Az enzim jelöli a lebontandó ciklin-B-ket hozzájuk kötődéssel;
a 26S fehérjebontacsban esnek szét.
Az M-szakaszt öt alszakaszra bontjuk.
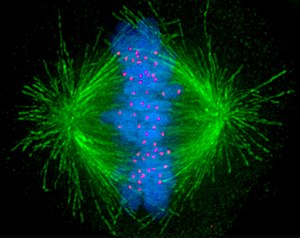 ● Előszakasz. Az előszakaszban (prophase,
● Előszakasz. Az előszakaszban (prophase, profázis) alapvetően
háromféle változás megy végbe:
▪ Kialakul a kétsarkú sejt és az osztódási orsó.
Az S-szakaszban kettőződött sejtközép – amely körül csillagalakban, folyvást
változó mikrcsövecskék vannak – a szakaszban a sejt két végére vándorol,
kialakítva a kétsarkú sejtet. A továbbiakban ez a két pont határozza meg a
sejtben végbemenő mozgásokat.
A sejtközépből kinyúló mikrocsövecskék közöl az
ellentétes irányba nézők hozzák létre az osztódási orsót. Az osztódási
hálózat tehát a sejtközpontokból elágazó mikrocsövecskék rendszere, amely
meghatározza a sejtben végbemenő mozgások irányultságát.
▪ Tömörödnek a kromoszómák. A 46 kromoszóma
elhelyezése a sejtben is rendkívüli, a megkettőződött kromoszómák, amelyek
mindegyikéből két azonos kromatida lesz, tehát 92. A kromatidapárok egymással
maradnak, a befűződéseknél kapcsolódnak össze. A 92 kromatida mozgatása sejtben
csak úgy lehetséges, hogy a kromoszómák számottevően tömörönek, és jóval
kisebbek lesznek. Valóban a kromatin nagyfokú tömörödése miatt vastagodnak a
kromoszómák, annyira, hogy a középszakaszban már fénymikroszkóppal is jól láthatók;
ezek a középszakaszi kromoszómák (metphase chromosoms). Természetesen a
kromoszómák működése teljesen megszűnik. A magvacska bomlik, de a maghártya még
ép.
▪ A sejtváz átalakulása. A sejtek állékonyságát
biztosító áthidaló hosszú mikrotubulusok eltűnnek, miként a köztesfonalak is
(intermedier filaments). A sejt változékonnyá alakul, lekerekedik és
környezetével is lazul a kapcsolata. A plazmahálózat és a Golgi-rendszer is
kezd szétesni.
● Előközépszakasz (prometaphase, prometafázis).
Kétféle meghatározó esemény időszakasza:
▪ A maghártya lebomlása. A maghártya belső faláz
tapadó, laminból álló rácsrost lebomlik, és felszakad a maghártyatér, belőle
hólyagcsák keletkeznek (maghártyahólyagcsák), továbbá eltűnnek az átjárások is.
A magtér szabadon hozzáférhető: a mikrotubulusok belenőnek a kromoszómákhoz.
▪ A mjkrotubulusok kötődése a kromoszómákhoz. A
testvérkromatídák együtt vannak, egymáshoz fekvő oldalukon a befűződés fogja
össze őket. A kromatídák másik oldalán korongszerű fehérjeképződmény jön létre,
a kinetokor, magyarul mozgóözépehhez kapcsolódnak mikrocsövecskék. Minden
kromatidának saját kinetokorja van, a pároké ellenkező irányba néz.
(→kinetokor)
● Középszakasz (metaphase, metafázis). Ebben kialakul az egyenlítői lemez
(equatorial/metaphase plate) a sejt közepén, benne a kromoszómákkal. Ez
viszonylag sok időt vesz igénybe: a kromoszómákat a mikrocsövecskék mozgatják
ide-oda (a mikrocsövecske rövidül, hosszabbodik) míg egészen pontosan nem
kerülnek a helyükre az egyenlítői síkban. A végén minden kromatida mindkét
sejtsaroktól tökéletesen egyenlő távolságra van. A teljesen egy síkba
rendeződött kromoszómákat tartalmazó képződményt középszakaszi lemeznek*
(metaphase plate) nevezzük. Ez biztosítja, hogy a kromatidapárok egyik tagja a
sejt egyik sarkába, a másik a másik sarkában kerül, a leánysejtekben pontosan
egyforma DNS lesz.
●
Utószakasz (anaphase, anafázis). Két egymást átfedő esemény játszódik
benne:
▪ A kromoszómák szétválása. A testvér kromatídák
még összekapaszkodnak, fehérjeössztes tartja egybe őket a befűződésben, de a
kohezin is össszetartozást hoz létre a kromatídák egész hosszában. Ezek a
kapcsolatok hirtelen jelre megszűnnek, a kromatidák elválnak, s egyedileg
mozognak a hozzájuk közelebbi sarkokhoz, a kinetokorral kapcsolódott
mikrocsövecskék húzzák őket úgy, hogy tubulinkettősök képződve egyre
rövidülnek.
▪ Menyúlik az osztódási orsó. Ez a sarki
mikrocsövecskék további növekedésével jön létre, miközben a sejt közepén az
egymás melletti sarki csövecskék kinezinnel összetapadnak.
● Végszakasz. A végszakaszban
(telephase) a sejtosztódás befejező része. Újraképződik a maghártya, lazul a
kromatin: a kromoszómák kezdenek kromatinkötegekké alakulni. A sejtplazma még
egységes, de formálódik az osztódási barázda. A sejtközpont tovább irányítja mikrocsövecskéket.
A sejtplazma szétválása már az
utószakaszban elindul: az osztódási orsó, kromoszómákat tartalmazó egyenlítői
síkjának megfelelően, vagyis a sejt közepén, a sejtfelszínen barázda jelenik
meg. Oka, hogy ezen a területen, a sejthártya alatt aktinfonalakból és rövid
miozinkötegeből, összehúzódásra képes gyűrű képződik (összehúzódó gyűrű). Az
aktin–miozin kölcsönhatás következtében a gyűrű folyamatosan kisebbedik, húzza
a sejthártyát, és egyre inkább mélyül az osztódási barázda, végül a sejt
szétválik (cytochinesis).
 ■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.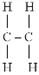

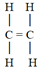 ■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés. A pRb foszforilezését ciklin-D–CDK4 vagy CDK6 végzi a G1-szakasz
közepétől az R-pontig.
A pRb foszforilezését ciklin-D–CDK4 vagy CDK6 végzi a G1-szakasz
közepétől az R-pontig. ● Előszakasz. Az előszakaszban (prophase,
● Előszakasz. Az előszakaszban (prophase,