dezubikvitináz deubiquitinase, DUB (egyéb nevei: deubiquitylating
enzyme/peptidase/isopeptidase, USP14 [ubiquitin-specific protease], UCHL5
[ubiquitin C-terminal hydrolase L6], PSMD14 [26S proteasome non-ATPase
regulatory subunit 14], ubiquitin protease/hydrolase/isopeptidase) fehérjebontó
enzim (proteáz), amely az izopeptid kötéssel kapcsolt, kisméretű ubikvitint választja
le a korábban így megjelölt (ubikvitinilált) fehérjéről – a leválasztott
ubikvitin újra hasznosul. Segíti az ubikvitin érését, bontja a több ubikvitin
összekapcsolódásával létrejött ubikvitinláncokat is. ~100-féle DUB ismert,
enzimcsaládot alkot, amelyet hat csoportra osztanak (DUB1–6). Mindegyikben
megtalálható a leválasztásért felelős gomoly, amely nagyságában és aminosav-sorrendjében
is eltér a különböző DUB-okban, de szerkezetében egyező: ujj, tenyér
és hüvelykujj elnevezésű alegységei vannak. Ezek az emberi jobb kéznek
megfelelően helyezkednek el.
A fehérjebontacsban a DUB1 (USP14) és a DUB2 (UCHL5)
választja le az ubikvitint az izopeptidkötések szétbontásával. A DUB1 egyesével
választja le az ubikvitineket, a DUB2 egyszerre a teljes láncot. A
dezubikvitinázok hatása azonban kétélű, az ubikvitinek leválasztásával egyrészt
előkészítik a fehérjéket a lebontásra, de ezzel a fehérjék állékonyságát is
növelik, ezért azok a káros/szükségtelen fehérjék, amelyek elkerülik a fehérjebontacsot,
felszaporodhatnak a sejtplazmában, pl. a ráksejtekben, vírusfertőzött
sejtekben. Ez az alapja a dezubikvitinázt gátló gyógyszeres kezeléseknek.
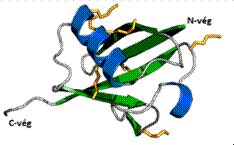 ubikvitin ubiquitin, Ub 76 aminosavból
álló, kis (8500 Da) molekulatömegű, törzsökös fehérje, sajátos kulcsolódó
β-mintázattal* (β-grasp fold), amely α-csavar és β-lemez mintázat egymásba
fonódásából jön létre. Felszínén hét lizin van, amelyek a K6, K11, K27, K29, K33, K48, K63 helyzetben találhatók – az
ábrán sárga végződések jelölik. (Ábraforrás: Wikipedia – módosítva.) Az
ubikvitin fűződéssel keletkezik, és négyféle gén kódolja; ezeket UB és számok
jelölik. Az UB11 és UB12 a ribotestecs kisebb, az UB13 a
nagyobb alegységének egy-egy fehérjéjével egyesül. Az UB14 együtt képezi
a kettőt.
ubikvitin ubiquitin, Ub 76 aminosavból
álló, kis (8500 Da) molekulatömegű, törzsökös fehérje, sajátos kulcsolódó
β-mintázattal* (β-grasp fold), amely α-csavar és β-lemez mintázat egymásba
fonódásából jön létre. Felszínén hét lizin van, amelyek a K6, K11, K27, K29, K33, K48, K63 helyzetben találhatók – az
ábrán sárga végződések jelölik. (Ábraforrás: Wikipedia – módosítva.) Az
ubikvitin fűződéssel keletkezik, és négyféle gén kódolja; ezeket UB és számok
jelölik. Az UB11 és UB12 a ribotestecs kisebb, az UB13 a
nagyobb alegységének egy-egy fehérjéjével egyesül. Az UB14 együtt képezi
a kettőt.
ubikvitinjelölés
(ubikvitinkód) ubiquitination,
ubiquitylation a
célfehérje társítása egy vagy több ubikvitinnel. A kapcsolódás elektronkötéssel
jön létre három enzim, az ubikvitinserkentő (E1), az ubikvitinkötő (E2) és az
ubikvitin-ligáz (E3) segítségével. A folyamat több lépésből áll:
▪ Az
első a sejtplazmában lévő tétlen ubikvitin tevősítése, ami kötőhely kialakítása
az ubikvitinben az E2 kapcsolódásához. Ezt az E1 enzim végzi: kötődik az
ubikvitinhez tioészterkötéssel, és foszforilezi ATP felhasználásával.(A
tioészterkötés az ubikvitin C-végi karboxilcsoportja és az E1 ciszteinjének
tiolcsoportja között jön létre.). E1-ubikvitin molekula keletkezik.
▪ A
második lépés az E2 enzim és az E1-ubikvitin kötődése. Az E2 az ubikvitin
kötőhelyéhez kapcsolódik, szintén tioészterkötéssel úgy, hogy az E1 és az
ubikvitin közti tioészterkötés áttevődik az E2-re, az E1 enzim pedig leválik;
E2-ubikvitin keletkezik.
▪ Az E3
ismeri fel a lebontandó fehérjét, és kapcsolódik hozzá. A célfehérjével társult
E3 kötődik az E2-ubikvitinhez, megint csak tioészterkötéssel, amely az E2 és az
E3 között alakul ki. Négy fehérjéből (E2, E3, ubikvitin és a célfehérje) álló
képződmény formálódik, amelyben az E2 és az E3 együtt segíti a célfehérje és az
ubikvitin fűződését izopeptidkötés létrehozásával. Ebben az ubikvitin C-végi
glicinének karboxilcsoportja kötődik a célfehérje N-végi lizinének az
ε-aminocsoportjával. (A célfehérje és az ubikvitin a kötésnél elágazik, az N
(nitrogén) α-helyzetű – ezért izopeptid a kötés.) (→peptidkötés)
Ritkán
az ubikvitin nem a lizin ε-aminocsoportjához, hanem az N-végi első
aminocsoporthoz (metionin) vagy a cisztein/szerin/treonin oldallánchoz kötődik.
▪ A második
ubikvitin az első ubikvitin megfelelő lizinjéhez kapcsolódik, szintén izopeptid
kötéssel. A következő ubikvitin a másodikhoz, az azutáni a harmadikhoz stb.
kötődik ugyan így; míg ki nem alakul a megfelelő számú ubikvitinlánc.
A célfehérjék az ubikvitin K6, K11, K27,
K29, K33, K48, K63 helyzetű lizinjével az N-végi metioninnal (met1) kötődhetnek,
függően az E2, E3 enzimektől, és a célfehérjétől. Így igen sokféle (a kapcsolt
ubikvitinek számában, kötődésében és kapcsolódási helyzetében eltérő) jelölési
alakzat jöhet létre. Ez teszi lehetővé, hogy az ubikvitinjelölés több nagyon
különböző sejtfolyamatnak is a tartozéka legyen. Pl. a fehértestecs a K48 vagy
a K11 helyzetű lizinhez kötődő négy vagy több ubikvitinnel kapcsolt fehérjéket
ismeri fel; a lebontandó fehérjék ezzel jelölődnek. (→fehérjebontás, fehérjetestecs)
A K63 helyzetű
lizinhez kapcsolt ubikvitinjelölés az immun-, a gyulladásos és a sejtburjánzási
jelzésfolyamatok irányítási módja; jelentős továbbá az önfalásban és a
DNS-hibák javításában is. Ezt a jelölést az UBC13 végzi, amely szokatlan E2
enzim, kettős képez az MMS2 vagy UEV1 fehérjével, ekként hatékony. Az
UBC13–MMS2 a DNS-hibák javításának, az UBC13–UEV1 a jelzésfolyamatok
szabályozója. Az ubikvitin K63 lizinjéhez ubikvitinlánc kapcsolódik, ez kötődik
a célfehérjével, szolgál kapcsolóhelyként a jelközvetítő fehérjéknek. Megjegyzés:
az ubikvitinjelölést hagyományosan a fehérjebontással társították; a fehérjék
„halál csókjának” (degradation tag) nevezték. Ma már tudjuk, hogy ez messze nem
így van.
ubikvitinkötő enzim, E2 ubiquitin-conjugating
enzyme, UBC SH-enzim
jellegzetes ubikvitinkötő gomollyal. Ennek szerepe van az E2 négy alapvető
feladatában: az E1, illetve az E3 megkötése, az ubikvitin-E1–3 együttes
létrehozás és az ubikvitin–célfehérje izopeptidkötéssel való társításában. Az
E2 az E3-enzimeknek csak a töredékével létesít kapcsolatot; 35 féle ismert.
ubikvitinserkentő enzim, E1
(UBA) ubiquitin-activating
enzyme, UBA SH-t
tartalmazó egyetlen peptid három (adenilező, foszforilező és ubiquitin
mintázati) gomollyal. Foszforilezi az ubikvitint ATP felhasználásával,
létrehozva kapcsolódási helyet az E2 számára. Kevesebb mint tízféle
ubikvitinserkentő enzim ismert; az UBA1 és az UBA6 tevékenysége részleteiben is
feltárt. Az UBA1 a sejtplazmában és a magban is előfordul, az UBA6 csak a
plazmában. A sejtmagi UBA1kapcsolódik a kettős DNS-töréshez a PARP
közreműködésével. (→PARP)
