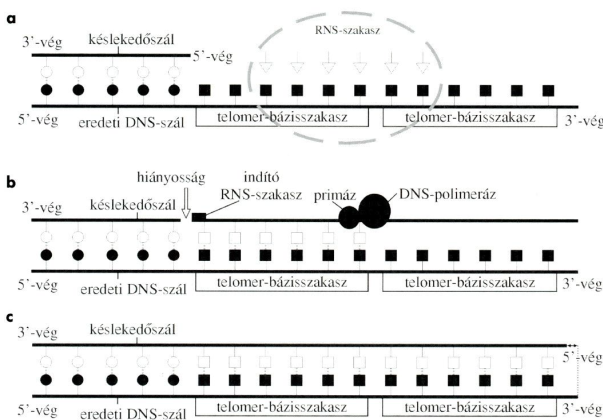
 végrész* telomere (
végrész* telomere (telomer)
a kromoszómák végződése, tömör kromatinba csomagolt sajátos nukleinfehérje
rendszer, amely megóvja a kromoszómákat attól, hogy a DNS-hibajavító rendszer
tévesen kettős törésnek nézze, és kivágja vagy vég a véghez egyesítse stb.
Vagyis akadályozza a kromoszóma elhajlását, kóros átalakulását, valamint a
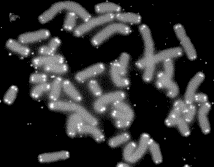
kóros sejtburjánzást és a rákosodást is. Az ábrán az osztódó sejt
kromoszómáinak végein látható fénylő részek a végrészek. (Forrás: Wikipédia.)
A végrész a végrész-DNS*-ből (telomeric DNA) és a hozzákapcsolódó sajátos fehérjékből, a végrészfehérjékből* (telomeric proteins) tevődik össze:
● Végrész-DNS. Rövid kétszálas fej–láb 5’→3’ irányú TTAGGG ismétletek sokaságából (500–3000 ismétlet, 2–10 kb hosszú) és 3’-végi guaninban gazdag, 50–300 nukleotidot tartalmazó egyszálas túlnyúlásból (overhang) áll. A túlnyúlás visszahajlik a kétszálú DNS-be, és azzal együtt hurkot formál, amelyet visszahajló T-huroknak* nevezünk (fold-back t-loop).
A TTAGGG ismétleteket telomere repetitive DNA sequencesnek nevezik, magyarul: végrészismétletek*. Az ismétletek száma nemcsak az emberek közt eltérő, de az egyénben is változik: a korosodással csökken.
A túlnyúlásban gyakoriak a másodlagos szerkezetek, mint a G-négyesek és az R-hurkok.
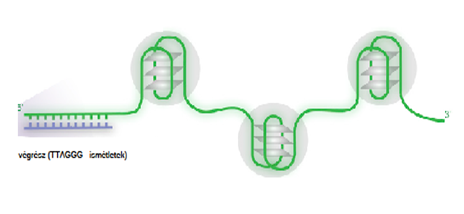
▪ A G-négyesek (guaninnégyesek, G-quadruplexes, GQs), amelyek törzsökös másodlagos DNS-mintázatok; az ábrán látható túlnyúlásban három G-négyes van. Kialakulásukat segíti, hogy a túlnyúlás különösen gazdag guaninban; előfordulnak benne sok guanint tartalmazó sajátos ismétletek is, pl. GGGCTA. Jellemző az is, hogy a túlnyúlásban kevés a cisztein.
A G-négyeseknek meghatározó szerepük van túlnyúlás védelmében. Ezek állékony szerkezetek, egymás után kialakulva tömör szerkezetet hoznak létre, így gátolják a túlnyúlás lebontását, vég a vég egyesülését más kromoszómával. A G-négyesek felismerő mintázatok, hozzájuk kapcsolódnak a helikázok és más fehérjék. Gátolják a végrészek telomerázok általi megnyújtását, ekként a ráksejtek elpusztításának célpontjai lehetnek.
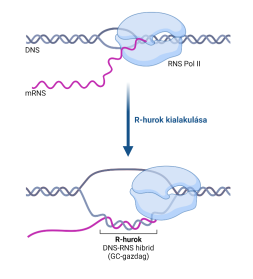 ▪ Az R-hurok háromszálú nukleinsavszerkezet, amely egy DNS–RNS
keresztezésből és a kapcsolódó, nem minta egyszálú DNS-ből áll. Az R-hurkok
különféle körülmények között képződhetnek, és a sejt megtarthatja vagy törli
őket.
▪ Az R-hurok háromszálú nukleinsavszerkezet, amely egy DNS–RNS
keresztezésből és a kapcsolódó, nem minta egyszálú DNS-ből áll. Az R-hurkok
különféle körülmények között képződhetnek, és a sejt megtarthatja vagy törli
őket.
Általában olyan DNS-bázissorok (főleg magas GC-tartalmúak) átíródásával hozhatók létre, amelyek elősegítik a haladó RNS-polimeráz mögötti RNS összekapcsolódását. Legalább 100 bp DNS–RNS kereszteződés szükséges az állékony R-hurok kialakításához.
Meglepően sok van a végrészeken, a kettőződésben keletkező hibák, a DNS-törések kialakulásában is van jelentőségük. Elősegítik a végrészek átrendeződéses hosszabbítását. (→végrészrövidűlés)
A visszahajló T-hurok szintén meghatározó a kromoszómák védelmében; úgymond „lefedi” a végrészt (telomeric capping). A visszahajlás következtében ugyanis a DNS-javító fehérjék nem nézik törésvégnek a végrészt, és nem bontják le. Gátolja még a kromoszómák elhajlását, az egymással való kapcsolódásukat, átrendeződésüket. A végrész átíródásában, másolódásában valószínűleg nincs szerepe.
Kialakulását elősegítik az ismétletek, ezekhez könnyen kapcsolódnak a túlnyúlás bázisai. A T-hurok nemcsak a túlnyúlást foglalja magában, hanem különböző hosszúságú kétszálas DNS-szakaszt is.
A túlnyúlás bázissoraiban előfordulnak sajátos hibák, mint a 8oxoG, amelyek kettőződési hibákat okozhatnak. (→8oxoG)
● Végrészfehérjék. Hat fehérje, a TRF1, TRF2, POT1, RAP1, TIN2 és a TPP1 képződmény, amelyet védletnek* (shelterin, telosome) nevezünk. (→POT1, RAP1, TIN2, TPP1, TRF1, TRF2)
A védlet fehérjéi eltérően kötődnek a végrészhez. A vázlatos ábrán ez látható.
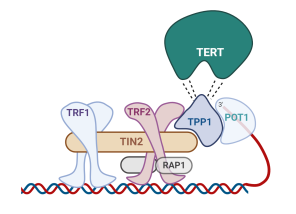 ▪ A TRF1 és a TRF2
kettős formában kötődik a kétszálú DNS-hez a C-végi MYB gomollyal. A
kapcsolódás vonzza a RAP1-et, amelyik az egyik TRF2-höz kapcsolódik.
▪ A TRF1 és a TRF2
kettős formában kötődik a kétszálú DNS-hez a C-végi MYB gomollyal. A
kapcsolódás vonzza a RAP1-et, amelyik az egyik TRF2-höz kapcsolódik.
▪ A POT1 sajátosan az egyszálú túlnyúláshoz kötődik, és kettőst képez TPP1-gyel, így fejti ki hatását. A POT1–TPP1 kettős toborozza a telomerázt.
▪ A TIN2 összekapaszkodik a TRF1, TRF2–RAP1, és POT1–TPP1 kettős fehérjékkel.
▪ A TIN2–TPP1–POT1 önállóan – a TRF1-hez és a TRF2-höz való kapcsolódás nélkül – is előfordul, ezért a védlet alegységének tartják.
A végrészen számos védlet van: A TRF1–TRF2–RAPI–TIN2 négyesek szakaszosan kapcsolódnak a kétszálú végrészhez, a POT1 – TPP1 szintén szakaszosan az egyszálúhoz. A kettő csak ott kapcsolódik össze, ahol közel kerülnek egymáshoz; az ábra ilyen helyzetet mutat.
A védlet jelen van minden sejtben, függetlenül a burjánzási állapotától, és megmarad a sejtkör egészében, a végrészek oltalmazója. Tevékenysége többrétű:
▪ Állványfehérjeként szolgál más fehérjék kapcsolódásához, például a TIN2–TPP1 kapcsolódás toborozza a telomerázt a végrészhez.
▪ Megakadályozza, hogy az ATM és az ATR kinázok a kromoszómavéget tévesen kétszálú DNS-törésnek érzékeljék, és elindítsák a javítási folyamatokat. A TRF1 gátolja a DNS-kettőződési ártmányt (replication stress); TRF2 feltartóztatja az ATM-jelzést és a végegyesítést (non-homologous end-joining, NHEJ); a POT1 pedig az ATR-jelzést akadályozza meg. (→DNS-hibajavítás)
▪ Gátolja a G1–S és a G2–M átmenetet, a sejtöregedést és a sejtvégzetet.
▪ A telomeráz kötésével elősegíti a végrész-DNS hosszabbítását, a TTAGGG ismétletek telomeráz általi hozzákapcsolását, akadályozva a sejtvégek rövidülését, és ezzel befolyásolja a sejt élettartamát:
Az emberi sejtekben ugyanis, kivéve a csírasejteket, az éretlen sejteket és néhány őssejtet, a végrész minden sejtosztódással rövidül; végül olyan röviddé válik, hogy elveszti a védletet, megszűnik a hurok. Az egyenes végeket a DNS-hibajavítók törésnek érzékelik, kapcsolódnak hozzá, és megállítják a sejtkört, nincs további sejtosztódás. A végrészek a hasonmás és/vagy vég–vég egyesítés következtében átalakulnak, nem védik a kromoszómát, beindul a sejtvégzet, a sejt elpusztul. Ezért nevezik a végrészt a sejt biológiai órájának. (→végrészrövidülés)
■ Végrészkromatin. A végrészeket tömör kromatin burkolja, benne a kromatin tömörödés jellemzői, a metilezett H3 és H4 (H3K9me3, H4K20m) gyakoriak. A tömör kromatin védi a végrészeket a hibás átrendeződésektől és gátolja a gének átírását; távhatással is. Ez azt jelenti, hogy a végrész kromatin a közelében (a végrész alatti szakaszban) lévő géneket is némítja. A jelenséget a nemzetközi irodalom telomere position effect (TPE) elnevezéssel illeti, magyarul végrészhatásnak* mondhatjuk. Ennek ismeretében meglepő, hogy a végrész átíródik, végrész-RNS keletkezik.