elektronártmány* oxidative
stress a szabadgyökök túlzott többlete a sejtben. Következménye: sejtkárosodás. Keletkezhet
a szabadgyökök fokozott képződése miatt, de a gyökgátlók (antioxidants) hiányos
tevékenységéből eredően is. Pl. az energiatermecsi szuperoxid-dizmutáz vagy a
peroxibontacsban a katalázok csökkent működése miatt. (→szabadgyök)
elektronátmenet
oxidation-reduction [redox]
reaction, oxidoreduction (oxidoredukció,
redoxifolyamat, redoxireakció) egy vagy több elektron átadása,
átvétele egyetlen vegyfolyamatban; elektronáramlás megy végbe. Az egyik
molekula elektront ad le (oxidation) (elektronátadó molekula), a másik
elektront vesz fel (reduction) (elektronfelvevő molekula) ; a kettő az
elektronátmenet-pár.
Az elektronátadó atomnak pozitív (pozion), az
elektronfelvevő negatív (negion) töltésűvé válik. Pl. magnézium és oxigén
vegyülésekor magnézium-oxid keletkezik (MgO), amely Mg2+ és O2-
ionokból álló ionvegyület. A Mg ad át két elektront (oxidation), amelyet az
oxigén felvesz (reduction), majd a keletkezett ionok rácshálózatba rendeződve rögzült
ionvegyületet formálnak.
Az elektronáramlással járó biológia folyamatok
létezésünk alapjai, a sejtműködéshez szükséges energia ezekkel képződik. A
biológiai elektronátmeneti folyamatok rendszerint többlépcsősek, a molekulák
változása rendkívül gyors egymásutánban megy végbe, és összetett. Miután az elektron legtöbbször nem önmagában, hanem proton kíséretében, azaz H atom formájában adódik át, ezért
általában nincs lényeges töltésváltozás, pl. mikor a glükóz bontásában
elektronok H atom formájában adódnak át a NAD-nak, nem lesz a „maradék” szénhidrát töltött.
elektronátmenetség oxidation reduction potential, ORP az elektronleadó/elektronfelvevő
képesség mértéke, amelyet voltban (V) adunk meg, és ORP-vel jelölünk.
Értéke mindig csak más rendszer elektronátmenetségéhez viszonyítva
értelmezhető. Az eletronátmenet egyensúlyáról tájékoztat. A pozitívabb
elektronátmenetségű a rendszer ad át elektront a negatívabbnak. Minél
pozitívabb a rendszer vagy szer ORP-értéke, annál kifejezettebben ad át
elektront. (NAD,
elektronburok electron
configuration az elektronok elhelyezkedése
az atomban vagy ionban; az elektronhéjak, elektronalhéjak és elektronhelyek
rendszere. Ebben helyezkednek el az atom elektronjai. Ez határozza meg az elem
vegytulajdonságát és részvételét a kötésekben.
elektronhéj shell az atommagtól az elektron energiaszintje szerinti távolságban lévő energiatartomány*.
Az atomban az elektron energiaszintjétől függően csak meghatározott távolságra
helyezkedhet el az atommagtól. A kisebb energiájú elektronok közelebb vannak a
maghoz. Vagyis minél távolabbi elektronhéjon van az elektron, annál nagyobb az
energiája. Az elektron az elektronhéjon belül több helyen is lehet, ezért
mondjuk az elektronhéjat energiatartománynak, nem pedig elektronpályának.
Egy atomnak legfeljebb
7 elektronhéja lehet. A magtól távolodva
növekszik az elektronhéjak energiatartományának az energiaszintje; a legkülső
elektronhéj energiaszintje a legnagyobb. Az elektronhéjakat háromféleképpen jelölhetjük:
▪ Betűkkel: K, L, M, N, O, P, Q;
a K van a maghoz legközelebb, a továbbiak a magtól elfelé haladva jelzik az
elektronhéjakat.
▪ A főrészecsszámmal (n). A maghoz legközelebbi elektronhéj az 1-es vagy K-héj; főmrészecsszáma
n = 1. A következő a 2-es vagy L-héj; főmrészecsszáma n = 2. A 3-as héj az M-héj (n = 3), a 4-es héj
az N-héj (n = 4), az 5-ös az O-héj (n = 5), a 6-os a P-héj (n = 6), a 7-es
pedig a Q-héj (n = 7).
▪ Egyszerűen számokkal: 1., 2.
stb. elektronhéj; az 1. a maghoz legközelebbi.
Az egyes elektronhéjakon lehetséges
legtöbb elektron meghatározott; a 2 ∙ n2 képlettel fejezhető ki (n a
főmértékszám): az 1-es héjon (n = 1) legtöbb két elektron lehet, a 2-es héjon legtöbb
nyolc (n = 2 [n2 = 4, 2 ∙ 4 = 8]), a 3-as héjon 18 stb.
Mivel minél távolabb
van az elektron a magtól, energiája annál nagyobb, ha egy elektron egy külső
héjról egy belsőre kerül, energia szabadul fel, és fordítva, belsőn lévő
elektron energiát igényel ahhoz, hogy külsőbb héjra kerüljön. A leadott vagy
felvett energia egyenlő a két elektronhéj közti energiakülönbséggel. A
megfelelő elektronhéjakon tartózkodó elektronok nem sugároznak energiát.
Az atom legkülső
elektronhéját vegyértékhéjnak* nevezzük; ezen vannak a
vegyértékelektronok. Legfeljebb 8 vegyértékelektron lehet, kivéve a hidrogént
és a héliumot, amelyeknek egyetlen elektronhéja van, legfeljebb 2 elektronnal.
(→vegyértékelektron)
elektronalhéj subshell az elektronhéjon belüli
energiatartomány. Négy elektronalhéj van; ezeket s, p, d, f betűkkel
jelöljük, utalva a bennük lévő elektronhely (orbital) formájára, pl. az s (spherical)
gömbölyű formájú elektronhely.
Az 1-es elektronhéjnak egyetlen
alhéja van (1s), a 2-es elektronhéjnak kettő (2s, 2p),
a 3-asnak 3 (3s 3p 3d), a 4-esnek négy (4s 4p 4d 4f) –
az alapállapotban lévő atomoknak egy elektronhéjon belül nincs négynél több
alhéja. A további alhéjak a gerjesztett atomokban jönnek létre. Az s-alhéjon,
bármely energiaszinten legfeljebb két, a p-alhéjon legfeljebb hat,
a d alhéjon legfeljebb 10, az f-alhéjon pedig
legfeljebb 14 elektron lehet.
elektronhely* atomic orbital, electron orbital az elektronok mozgásának térbeli helye és
viselkedése (pl. hullámtulajdonsága) az alhéjakon belül; az elektronburoknak az
a része, amelyben az elektronok tartózkodási valószínűsége 0 és 1 között van.
Az s-alhéjnak 1 elektronhelye van, a p-alhéjnak
három, a d-nek öt, az f-nek pedig 7. Egy elektronhelyen legfeljebb 2 elektron
lehet.
Az elektronhelyet a
hazai szakirodalomban elektronpályának is mondják. A pálya szó
útvonalfélére, valamilyen síkbeli haladás vonalára utal, nem pedig térbeli
elhelyezkedésre. Ezért az elektronhely elnevezés kifejezőbb.
Az elektron nem kering úgy a mag körül, miként a Föld a
Nap körül. Az atommag és az elektron töltésvonzása hat egymásra; a gyengébb (az
utóbbi) felveszi az erősebb (az atommag) irányultságát. Vagyis az elektronok
tényleges mozgási helyét az elektron energiája, a mag tényleges vonzásereje és
az atom mágnestere szabja meg. Az elektronhely
ekként az n, l és az ml elméletszámokkal
jellemezhető. Egy elektronhelyen – a
Pauli-elvből adódóan – legfeljebb 2 elektron lehetséges. (→elektron-elméletszámok, Pauli-elv)
Az elektron elhelyezkedése az
eletronhelyen belül, hogy hol van, és hol lesz a következő pillanatban, nem
mondható meg pontoson – ez a Heisenberg-féle határozatlansági elv. Csupán az
elektron helyének valószínűségi eloszlását tudjuk meghatározni.
Az elektron legvalószínűbb helyét a részecselmélet szellemében
az elektron állapotfüggvényével határozzák meg; ez az elektronnak a hely
szerinti valószínűségi eloszlását fejezi ki. Jele: ψ. Az állapotfüggvényt a
Schrödinger-egyenlettel számolják ki.
elektronburok-feltöltődés nem tetszőleges; mindig a kisebb
energiájú elektronhéj töltődik fel először. Az elektronhéjon belül a kisebb
energiájú alhéj (s-alhély) telítődik elsőként. Az alhéj elektronhelyeinek
feltöltődése a Hund-szabály szerinti, azaz az alhéj mindegyik elektronhelyére
egy azonos önperdületű elektron kerül, mielőtt bármelyikre is a második
elektron helyeződne.
A másik feltöltődési szabály az Aufbau
principle, magyarul feltöltődésszabály*, melynek értelmében a
p-alhéj feltöltődését követő elektron a következő elektronhéj s-alhéjára kerül,
feltöltődik az s-alhéj, és csak azután folytatódik az előző héj d-alhéjának
feltöltődése. Hasonló az f-alhéj töltődése is.
 Hund-szabály Hund’s Law azt mondja ki, hogy az elektron
alhéjának legkisebb energiaállapota (alapállapota) az, amelyben a legtöbb
párhuzamos önperdületű elektron van. Pl. a p-alhéjon három elektronhely van. Az
első p-alhéjon lévő elektron az első helyre kerül, a második elektron azonos önperdletű
és a második helyre, a harmadik szintén azonos önperdületű a harmadik elektronhelyre
áll: _↑__ _↑__ _↑__, mert ez a legkisebb energiájú állapot. A negyedik
elektron ellentétes önperdületű, és az első hely elektronjának párja lesz: _↑↓__
_↑__ _↑__, mivel négy elektron esetén ez a legkisebb energiaigényű állapot.
Stb.
Hund-szabály Hund’s Law azt mondja ki, hogy az elektron
alhéjának legkisebb energiaállapota (alapállapota) az, amelyben a legtöbb
párhuzamos önperdületű elektron van. Pl. a p-alhéjon három elektronhely van. Az
első p-alhéjon lévő elektron az első helyre kerül, a második elektron azonos önperdletű
és a második helyre, a harmadik szintén azonos önperdületű a harmadik elektronhelyre
áll: _↑__ _↑__ _↑__, mert ez a legkisebb energiájú állapot. A negyedik
elektron ellentétes önperdületű, és az első hely elektronjának párja lesz: _↑↓__
_↑__ _↑__, mivel négy elektron esetén ez a legkisebb energiaigényű állapot.
Stb.
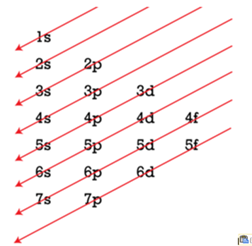
feltöltődésszabály Aufbau principle az
alhéjak töltődésére utal: az elemek állékonx állapotában mindig a kisebb
energiájú alhély töltődik fel először; az elektronok beépülése a kisebb
energiájú alhélyaktól a nagyabb energiájúak irányában halad. Először az első
elektronhéj s-alhéja, majd a második elektronhéj s-alhéja után a p-alhéja
töltődik. A harmadik elektronhéjban a s-, majd p-alhéj telítődése utáni elektron
nem a d-alhéjra, hanem a 4. elektronhéj s-alhéjára kerül; ennek ugyanis
valamivel alacsonyabb az energiaszintje, mint a harmadik héj d-alhéjáé. A negyedik
héj s-alhélyának feltöltését követő elektron azonban a 3. elektronhéj d-alhéját
kezdi tölteni. Az ábra ferde nyílai az elektronhéjak, elektronalhéjak
feltöltődési sorrendjét mutatják. (Forrás: LibreTexts/Chemistry)
elektronburok-leírás Az
elektronburok leírásánál általában az
elektronhéjat és alhéjat adjuk meg, az előbbit számmal, az utóbbit betűvel (1s
= az 1-es elektronhéj 0. alhéja). Ehhez hozzátesszük felső kitevőben az adott
alhéjon lévő elektronok számát: 1s2 [két elektron van a 0.
alhéjon]). Pl. a klór (Cl) 17 elektront tartalmaz, ezek eloszlása
(electron configuration): 1s22s22p63s23p5–
az 1. elektronhéj s-alhéján kettő, a 2. elektronhéj s-alhéján kettő, p-alhéján
hat; a 3. elektronhéj s-alhéján kettő, p-alhéján öt.
Egyszerűsíthető a leírás az adott
elem elemtáblázati vízszintes szakaszának nyolcadik főcsoportjába tartozó nemesgáz
vegyjelének felhasználásával. Ennek a nemesgáznak az elektronszerkezete ugyanis
azonos az adott elem elektronleírásának első részével. Pl. a klór elemrendszeri
szakaszába a neon tartozik; elektronszerkezete: Ne1s22s22p6,
a klóré: Cl1s22s22p63s23p5.
A klór dőlten írt része azonos a neon elektronszerkezetével, ezért
helyettesíthető a neon vegyjelével: Ne. Ekként a klór leírható a neon
vegyjelével, kiegészítve a többlettel: Cl [Ne] 3s23p5.
elektronegativitás az
atomnak az a képessége, hogy mennyire vonzza az elektronkötésben lévő
elektronpárt.
Coulomb-törvény szerint az
elektronegativitás (F, vonzerő) = K× q1 × q2 / r2 (az F az erő, a K állandó = 8,99 × 109 N × m2 × C-2; q1 az egyik, q2 a másik
részecske töltése, az r (radius) pedig a köztük lévő távolság.
Ez azt jelenti, hogy minél kisebb az atomtörzs (a kötő
eletronpár nélküli atom) és minél nagyobb a töltése, annál nagyobb a vonzereje,
az elektronegativitása.
Az elektronegativitást más atom
elektronegativitásához viszonyítjuk, vagyis viszonyszám, ezért kiterjedéstelen
mennyiség. Értéke a Pauling-lépték szerint 0,7–4 között van. A leginkább
elektronegatív atom a fluor (F), értéke 4 (3,98), ezt az oxigén követi. A
nemesgázok elektronegativitása nem meghatározható, mert az elektronszerkezetük
tökéletes. (→Coulomb-törvény, elemtáblázat)
Ha a molekulában lévő két atom egyformán
elektronegatív, az elektronok arányosan helyezkednek el az atomok körül, a
molekula semleges, nincs töltése (semleges elektronkötés). Ha valamelyik atom
erősebben elektronegatív, az elektronpár nagyobb részben helyezkedik el
körülötte, a molekulában részlegesen pozitív és részlegesen negatív részek
jönnek létre (kétsarkú elektronkötés, dipole moment). (→töltés, vegykötés)
elektronelvonó más
atomtól elektront átvevő atom. Ilyenek a nagy elektronvonzó képességű atomok,
pl. jellemzően az oxigén. A sejtekben az egyik legjelentősebb elektronfelvevő a
NAD+. Az oxigénnel végbemenő elektronelvonást a vegyészetben égésnek nevezzük.
elektronelvonó szer* (oxidáló
szer) olyan vegyület, amelyik az elektronátmeneti folyamatban elektront
vesz fel (elektrontöbbletű lesz); az elektront másik vegyületből vonja el, az
elektronhiányossá válik. Erős elektronelvonó szerek az oxigén, ózon, klór,
fluor, bróm, hidrogén-peroxid (H2O2) stb. Az
elektronelvonó szerek fertőtlenítő hatásúak.
elektronfelvétel* reduction atom, molekula vagy ion által egy/több elektron
felvétele, aminek következtében elektrontöbbletű atom/ion/molekula keletkezik.
Az elektronátvétel az elektronleadás ellentéte, de annak folyománya: valamely atom,
molekula vagy ion egy/több leadott elektronjának az átvétele.
elektronfogékonyság* electronaffinity (elektronaffinitás)
a semleges atom vagy molekula elektronfelvételénél felszabaduló
energiamennyiség – negatív ionképződés. Jóformán csak az elemtáblázat 6–7. főcsoportbeli
elemeinek negatív gázionná válására vonatkozik. Ezek az elemek a telítetlen
külső elektronhéjukra veszik fel az elektront, negatív ionná válnak, érvényesül
az atommag vonzó hatása, és energia szabadul fel. Az energiavesztés miatt az
atom alacsonyabb energiaállapotba kerül. Az elektronfogékonyság egysége az 1
mol gázállapotú atom negatív gázionná válásakor felszabaduló energia (pl. Cl =
349 kJ/mol).
Ha a külső elektronhéj telített
(pl. nemesgázok), elektronfelvételkor az elektron csak új elektronhéjra
kerülhet. Ilyenkor a mag vonzása nem érvényesül, mert a telített héjon lévő
elektronok teljesen árnyékolnak. Az új elektronhéj létrehozásához energia kell,
vagyis telített elektronhéjú atom elektronfelvételéhez energia szükséges, az
atom magasabb energiaállapotba kerül: szerkezete kevésbé állékony.
elektronkötés* covalent
bond (egyéb elnevezések: atomkötés, elektronpárkötés,
kovalens kötés, homopoláris kötés) a vegyülő atomok egy-egy
párosítatlan elektronnal létrejövő kapcsolódása molekulává; közös
elektronpárral létrejövő kötés. A közös elektronpár a vegyértékhéjon van,
meghatározott irányú: a két atom között helyezkedik el. A közös elektronpárt kötő
elektronpárnak nevezzük, szemben az vegyértékhéjon lévő nem kötő
elektronpárral, amelynek szabad elektronpár a neve.
Az
elektronkötéseket jellemző legfontosabb ismérvek:
■ Kötésszám a kötő elektronpárok száma.
Azt a kötést, amelyben egy elektronpár vesz részt,
egyszeres kötésnek hívjuk. Ebben tehát mindkét részt vevő atom egy-egy
elektronnal van jelen. A több vegyértékű atom képes több egyszeres kötést
létrehozni. Ezek száma (kötésszám) attól függ, hogy hány elektron társulhat a
vegyértékhéjon, a kötések kialakulásakor lévő elektronokhoz. A két kötő
elektronpárral létrejövő kötést kettős, a három kötő elektronpárral
létrejövőt pedig hármas kötésnek nevezzük.
Az elektronkötést a vegyülő atomok
szerkezeti képletében az atomok vegyjele közötti vízszintes vonallal jelöljük (C–H).
A kettős, illetve a hármas kötéseket két (C=O), illetve három (C º
C) vízszintes vonallal jelöljük.
Az atom külső elektronhéján
(vegyértékhéjon), vagyis a vegyértékhéjon nem lehet több nyolc elektronnál. Egy
atom tehát nem létesíthet több mint négy egyszeres kötést, mivel egy egyszeres
elektronkötésben két elektron van. Kívétel a hidrogén és a hélium, mert ezekben
legfeljebb 2 elektron lehet vegyértékhéjon.
Ha a vegyértékhéjon nyolc elektron van,
az atom telített, ez az állékony állapot, a molekula ennek elérésére törekszik,
ezért jönnek létre az elektronkötések. (Ezt nevezzük nyolcas vagy
nemesgázszabálynak, oktettszabály)
Egy kötést létesíthet pl. a hidrogén, a
klór, kettőt az oxigén, hármat a nitrogén, négyet a szénatom.
■ Kötéstávolság (kötéshossz) az egymással
kötésben lévő atomok magjai közötti közepes távolság. Ez jól meghatározott,
noha az atomok egymás felé rezegnek. Az elektronkötésben is nagyon jelentős,
mert ha az atomok a közepes kötéshossznál
közelebb kerülnek egymáshoz, már taszítják egymást; a kötési energia csökken. A
szokványos kötési távolság 0.07–0,3 nm (70–300 pm). A kettős kötések távolsága
kisebb, mint az egyes kötéseké. Minél nagyobb az atom, annál messzebb vannak a
magok egymástól, ezért annál hosszabb a kötéstávolság.
■ Kötési energia két atom közötti kötés
képződését vagy felszakítását kísérő energiaváltozás 1 mol molekulában; az
előbbi negatív, az utóbbi pozitív előjelű. Értéke: kJ/mol. Pl. H2
kötésenergiája 438 kJ/mol, a vízzé pedig 463 kJ/mol.
A kötési energia nagysága függ az atomok
méretétől (minél nagyobb az atom, annál kisebb a kötési energia, mert hosszabb
a kötéstávolság), az atom töltésétől, a kötő elektronpárok számától és az
elektronegativitástól, vagyis attól, hogy az atom mennyire vonzza a kötő
elektronpárt. (→elektronegativitás) A kettős kötés energiája nagyobb, mint az
egyszeres kötésé, de nem kétszer akkora, mert a szigma-kötés energiája nagyobb,
mint a pi-kötésé.
■ Kötésszög a kapcsolódó atomok kötései által
bezárt szög. Kialakulásában a szabad elektronoknak is jelentős szerepe van. A
kötésszög a molekula téralakzatát határozza meg.
Az
elektronkötések töltésviszonyai:
Ha a két atommag körül az elektronok eloszlása:
▪ Egyenletes, semleges elektronkötésről (apolar
covalent bond, apoláris kovalens kötés) beszélünk: a kötő elektronpárok
egyformán helyezkednek el a két atommag erőterében. Ilyen az azonos atomokból
álló molekulák (O2, H2) között jön létre. Általánosabban:
olyan atomok között, amelyeknek az elektronegativitása azonos vagy közel
azonos.
▪ Ha nem egyenletes az elektronok eloszlása (különböző
atomokból álló molekulák [HCl]), vagyis az elektronpár eltolódik valamelyik
atom irányába, résztöltésű elektronkötésről (polar covalent bond, poláris
kovalens kötés, polarizált atomkötés) van szó. A résztöltésű
elektronkötés tehát két különböző elektronegativitású atom közötti
elektronkötés.
Ebben a kötő elektronpárok többet vannak
a nagyobb elektronegativitású atom körül, vagyis az eloszlás részpozitív (δ+)
és résznegatív (δ-). Kétsarkú molekula (dipólusmolekula)
jön létre. Minél nagyobb a különbség az elektronegativitásban, annál
kifejezettebb a kétsarkúság, nagyobb a résztöltés. Jellegzetes példa a víz: az
oxigén (a molekula közepe) δ-, a hidrogén (végek) δ+.
Az
elektronkötések formái:
Kétféle elektronkötést különböztetünk meg: a szigma-kötést
(σ-kötés) és a pi-kötést (π-kötés). (→pi-kötés, szigma-kötés)
 ■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
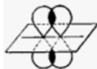
Az elektronhéjak átfedése miatt az atomok
elektronpályái megváltoznak, molekulapályákká alakulnak. Pl. két hidrogénatom
kötődésekor a hidrogénatomok gömb alakú elektronpályái tojásdaddá alakulnak.
Az ábrán a fekete pontok jelölik a hidrogénatomok magjait. Jól látható, hogy az
elektronfelhő (vörössel jelölve) legnagyobbrészt a két atommag között van; itt
a legnagyobb az elektronsűrűség. (Forrás: Wikipédia.) Az ilyen molekulapályát σ-molekulapályának
nevezzük.
A szigma-kötés van a legalacsonyabb
energiaszinten, ezért minden elektronkötésben van szigma-kötés. Kötési
energiája nagyobb, mint a pi-kötésé. Egy elektronkötésben csak egy szigma-kötés
lehetséges, így a szigma-kötések száma egyezik a vegység (a központi atomhoz
kötődő atomok) számával. (→vegység)
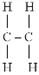
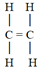 ■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
A
szervezetben a hidrogén (H), az oxigén (O), a nitrogén (N), a szén (C), a kén (S) és a foszfor (P) képezi
az elektronkötések zömét. Ez a hat elem, meghatározóan az első négy, az élő
szervezet tömegének 99%-át adja.
elektronleadás* (elektronvesztés) oxidation (oxidáció) atom, molekula vagy ion egy/több
elektronjának leadása; az elektront leadó atom pozitív ionná válik; növekszik
az elektronátmenet-száma . Vegyfolyamatban a leadott elektront másik atom,
molekula, ion veszi fel; a folyamat csak így mehet végbe, vagyis
elektronátmenet formájában. Az atom stb. egyébként az elektront magas
hőmérséklet vagy egyéb energiaforrás, pl. foton hatására is leadhatja, és ionná válhat.
biológiai elektronleadás (biológiai
elektronvesztés) biological oxidation
az szervezetben végbemenő elektronleadás, a sejtek energiaátalakításának
folyamatai, pl. →sejtlégzés.
elektronpár az elektronhelyen a párjával
mozgó elektron. Azokat az atomokban, amelyekben minden elektron kötött, párban
van, nem keletkezik mágnesesség, mivel a két ellentétes mágneses irányultságú
elektron a mágnesteret keltő hatást kioltja (diamegnetic).
■ Kötő
elektronpár olyan párosított sajátperdületű vegyérték-elektronpár,
amelyik két (vagy több) atommag körül helyezkedik el, mindegyik atomtörzs
erőterébe tartozik. A kötésben tehát párosítatlan sajátperdületű elektronok
vesznek részt, párosított sajátperdületű párt képezve. Kétféleképpen, összeállással
(kolligáció) vagy részesedéssel (datív kötés) alakul ki.
• Összeállás* (a vegyértékelektronok összeállása). Az
egyik elektron az egyik atomból, a másik elektron a másik atomból származik. Mindkét
egyesülő atom vegyértékhéján van egy vagy több különböző önperdületű páratlan
elektron, amelyek közül egy-egy a két atomról párt képez úgy, hogy mindkét
atommag körül megtalálható.
▪ Részesedés*. A kötőelektronpár az egyik atomról
származik, ez helyezkedik el a két atommag körül, tartozik a két atomtörzs
erőterébe.
■ Szabad
elektronpár a kötésben nem résztvevő vegyérték-elektronpár; nem kötő vagy magányos
elektronpárnak is nevezzük.
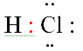 A képletekben az elektronokat csak akkor jelöljük, ha hangsúlyozni
akarjuk őket. Legtöbbször kettősponttal jelölünk: piros kettősponttal a kötő
elektronpárt. A képletben a köttőelektronpár a hidrogén és a klór körül is előfordul
– a többi csak a klór körül. A vegyértékhéjon
a szabad és a kötő elektronok együttes száma nem lehet több nyolcnál. (→vegyképlet)
A képletekben az elektronokat csak akkor jelöljük, ha hangsúlyozni
akarjuk őket. Legtöbbször kettősponttal jelölünk: piros kettősponttal a kötő
elektronpárt. A képletben a köttőelektronpár a hidrogén és a klór körül is előfordul
– a többi csak a klór körül. A vegyértékhéjon
a szabad és a kötő elektronok együttes száma nem lehet több nyolcnál. (→vegyképlet)
elektronrészecsszám* electron quantum number az elektron energiáját kifejező számértékek. Négyféle
van. Csak egész- vagy félegészszám lehet. Gyakran betűkkel jelöljük.
▪ főrészecsszám*, héjenergia* (principal quantum number, jele: n)
az elektronnak az elektronhéj szerinti
energiaszintjét jelölő szám. Az elektronhéj száma; a Bohr-féle
atomelmélet energiaszintjét jelölő sorszám: n = 1, 2, 3, 4, 5, 6 vagy 7 (nem
lehet 0 vagy negatív). Minél nagyobb az elektron n értéke, annál
távolabb van az atommagtól – tehát a magtól távolibb elektronok n értéke
a nagyobb. Az n = 1 az az energia, amely az elektronnak a H atomból való
eltávolításához szükséges; értéke: ~13 eV. Az n = 2, 3… gerjesztett állapot.
(→Bohr-féle atomelmélet, elektronburok)
▪ mellékrészecsszám, perdületszám*,
alhéjenergia* (angular momentum quantum number; jele: l [az 1-gyel való
összetévesztés miatt írható L-lel is]) az elektronalhéjakra vonatkozik, az
elektronpálya egybevágóságát írja le. Az l értéke a főrészecsszámtól (n)
függ; nem lehet nagyobb, mint n−1 (0, 1, 2, 3… n−1); például ha n = 3, az l
lehet 0, 1 vagy 2 (2 = 3−1). Az l értékeit az alhéjak betűivel (s, p, d,
f) adjuk meg: az l = 0 az s-alhéjnak, az l = 1 a p-alhéjnak, az l = 2 a
d-alhéjnak, az l = 3 pedig az f-alhéjnak felel meg. (→elektronburok)
▪ mágnességi részecsszám* (magnetic quantum
number) az elektronhelyeket adja meg az alhéj energiatartományában. Jele: ml.
Értéke a perdületszám (l) függvénye = −l → l. Ha l = 0, az
ml is 0 – ez felel meg a s-alhéj egyetlen elektronhelyének.
Ha l = 1, az ml lehet −1, 0, 1 – megfelel a p-alhéj
elektronhelyeinek; ha l = 2, az m1 lehet −2, −l, 0, 1,
2 (a d-alhéj elektronhelyei); ha l = 3, az ml, lehet −3, −2, −1, 0,
1, 2, 3 – megfelelően az f-alhéj hét elektronhelyének. (→elektronburok)
▪ sajátperdületszám* (spin quantum number) az
elektron sajátperdületi állapotát jelöli. Értéke kétféle: +1/2 (spin up) vagy −1/2
(spin down).
Két
elektronnak egy atomban nem lehet ugyanaz a négy részecsszáma, a Pauli-féle
kizárási elvből adódóan. Azaz a részecsszámokkal minden egyes elektron
leírható.
elektronsági szám* oxidation
number, oxidation state (oxidációs állapot, oxidációs szám)
azoknak az elektronoknak a száma, melyeket egy atom lead vagy felvesz ahhoz,
hogy egy másik atomhoz kötődjék, elektronkötést hozzon létre. Azt fejezi ki,
hogy az atom hány elektron leadására, cseréjére vagy felvételére képes az adott
molekulában. Pl. a Mg atom elektronátadási száma majdnem mindig +2, mert Mg2+
ion formájában két elektront vehet fel a kötés kialakítására; 2 elektron hiánya
van. hasonlóan, az O atom elektronátadási száma általában i-2, mert vegyületeiben
legtöbbször két elektront adhat le. Az elektronsági számból tehát könnyen
felismerhető, hogy az adott atom elektronátadóként vagy elektronfelvevőként
vesz részt elektronátadási folyamatban.
Az ion elektronsági száma a töltésszáma. Az elem
elektronsági száma = 0. A molekula és az ionvegyület elektronsági száma egyenlő
az atomjai, illetve ionjai elektronsági számának összegével, pl. a Mg2+
és az O2- egymással alkotott vegyületében az elektronsági
számok összege: +2 és -2 = 0; azaz a vegyület elektronsemleges. Hasonlóan a
magnézium-hidroxid (MgOH) ionvegyület esetében: Mg2+ (O2-H+)2
= +2 és -1 kétszer = 0. Az összetett ionok összesített elektronsági száma a
töltésszámuk.
elektronvesztés-gátló
→gyökfogó
párosítatlan elektron a külső elektronhélyon
(vegyértékhéj) pár nélkül keringő elektron; ez vesz részt a vegykötésben. Párosítatlan
elektron más elektronhéjon kivételes. Az az atom, amelyikben párosítatlan sajátperdületű
elektron van, mágnesezhető (paramagnetic); kölcsönhatásban van a mágneses
mezővel.
Az elektron párosítatlanul rendszerint
átmenetileg fordul elő (gyök), mert az ilyen atomok hevesen lépnek
kölcsönhatásban más atomokkal az elektronpár létrehozására (→szabad gyökök).
Rendszerint párosítatlanná válik az elektron a kötések kialakulásakor.
vegyértékelektron valence electron a külső elektronhéjon
(vegyértékhéj, valence shell) lévő elektron; ez vesz részt a vegykötésben, mert
az atommaghoz legkevésbé rögzített. Mivel az atom legkülső héjának elektronjai
közül bármelyik részt vehet a kötésben, a külső elektronhéj elektronjait
vegyértékelektronoknak nevezzük; legfeljebb
nyolc lehet. Ezek határozzák meg az elemek
vegyértékét és vegyi tulajdonságait: kapcsolódási képességét más elemekkel.
Szokásosan a legkülső elektronhéjhoz tartozó s- és p-alhéjakon lévő
elektronok a vegyértékelektronok. Pl. a
foszforban (1s2 2s2 2p6 3s2
3p3) öt van (3s2 3p3) – a legkülső elektronhéj
a 3-as; az s-alhéjon kettő, a p-alhéjon 3 elektronnal. Telített a vegyértékhéj,
ha rajta 8 elektron van; kivéve a hidrogént és a héliumot, amelyben legfeljebb
2 elektron lehet – ez a telítettségi állapot. Azok
az elemek, amelyeknek nyolc vegyértékelektronja van (s2p6), állékonyak, szerkezetük meglehetősen állandó,
atomos állapotban is előfordulnak, vegyfolyamatokban nem vesznek részt;
például: nemesgázok. Az atomok, molekulák a telítettségi állapot elérésére
lépnek a vegyfolyamatokba.

 ■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.
■ Szigma-kötés (σ-kötés)
két atomtörzs közötti egyszeres átfedő kötés; az elektronhéjak a
kötés tengelye (a két atommagot összekötő egyenes) mentén fedik egymást, ennek
megfelelően a legnagyobb elektronsűrűség a két atom között alakul ki. Az
elektronok a tengely körül egybevágóan, ezért szabadon forognak.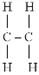

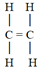 ■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.
■ Pi-kötés (π-kötés) szigma-kötéssel
összekapcsolt két atomhoz, ugyancsak szigma-kötéssel kötődött atomok közt jön
létre. Az első szerkezeti képletben két szénatom van szigma-kötéssel kötődve.
Mindegyikhez két hidrogén kötődik, ugyancsak szigma-kötéssel. A pi-kötés a
hidrogénatomok között jön létre. A képen látható, hogy a pi-kötés merőleges a
szénatomok kötéstengelyére (a szénatomokat kapcsoló szigma-kötésre), és hogy a
tengely síkjának két oldalán a kötés egybevágó, továbbá, hogy az elektronpályák
a sík felett és alatt is átfednek (sötétített terület). (Forrás: Google.) A
pi-kötésben tehát két átfedés van az elektronpályákban, szemben a szigma-kötés
egyszeres átfedésével. A kötés a p-alhéjak elektronpályái között alakul ki. A
második szerkezeti képlet azt mutatja, hogy a pi-kötés miatt a két szénatom
közt kettős kötés lesz; az egyik szigma-, a másik pi-kötés.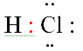 A képletekben az elektronokat csak akkor jelöljük, ha hangsúlyozni
akarjuk őket. Legtöbbször kettősponttal jelölünk: piros kettősponttal a kötő
elektronpárt. A képletben a köttőelektronpár a hidrogén és a klór körül is előfordul
– a többi csak a klór körül. A vegyértékhéjon
a szabad és a kötő elektronok együttes száma nem lehet több nyolcnál. (→
A képletekben az elektronokat csak akkor jelöljük, ha hangsúlyozni
akarjuk őket. Legtöbbször kettősponttal jelölünk: piros kettősponttal a kötő
elektronpárt. A képletben a köttőelektronpár a hidrogén és a klór körül is előfordul
– a többi csak a klór körül. A vegyértékhéjon
a szabad és a kötő elektronok együttes száma nem lehet több nyolcnál. (→