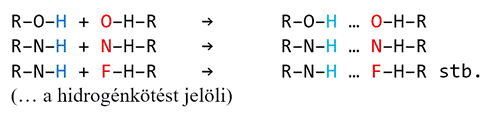hidrogénkötés (hidrogénhíd, H-híd) összekapcsolás
hidrogénatom részvételével: az egyik molekula hidrogénje kapcsolódik a másik
molekula nagy elektronegativitású atomjának szabad elektronpárjához (az
elektronkötésben nem résztvevő vegyérték elektronpár); hidat képez közöttük.
Viszonylag erős (~0,2 eV, 12–30 kJ/mol) kapcsolódás: egy nagyságrenddel haladja
meg a kétsarkú kölcsönhatások erejét, és egy nagyságrenddel gyengébb az
elektronkötés erejénél.
Oka az, hogy a
hidrogén protonja meglehetősen kicsi, ennek következtében a pozitív töltése
kifejezett, hiszen a töltés jóval kisebb felületen oszlik el, mint a nagy
protonoknál. Az elektronkötésben a hidrogén az egyetlen elektronjával vesz
részt, protonja viszonylag szabaddá válik, és erős vonzerejével vonzza a
közelében lévő elektronegatív atom elektronjait, lehetővé téve a kapcsolódást.
A hidrogénkötés kialakulásának tehát három feltétele van:
▪ olyan molekula,
amelynek valamelyik elektronkötésében hidrogén vesz részt,
▪olyan másik
molekula, amelynek van nem kötő elektronpárú, erősen elektronegatív atomja,
▪és hogy a két
molekula viszonylag közel (0,3 nm) kerüljön egymáshoz.
A hidrogénhíd csak az oxigén, a nitrogén
és a fluor (pillératomok) között létesül – a feltételek csak ezek
kapcsolódásaiban adottak. A hidrogénkötéshez szükséges részpozitív hidrogén
jóformán csak az O–H, N–H, F–H kötődésekben keletkezik, a hidrogénkötés pedig
csakis az O–H, N–H és F–H csoportok O–H, N–H és F–H csoportokkal való
társulásakor jöhet létre: pl.
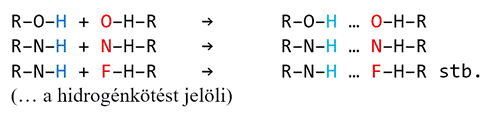
Más, például a szénatomhoz (C) kapcsolt
hidrogén nem képes hidrogénkötésre, mert a C–H csoport elektromosan semleges:
az elektronok eloszlása az atomok között egyenlő. Jóllehet részleges
pozitivitás, negativitás ezekben is létrejöhet, de ez nem elegendő a
hidrogénhíd kialakításához.
A hidrogénhíd
általában molekulák között jön létre, pl. DNS-ben, fehérjékben, de előfordul
molekulán belül is, pl. az acetilacetonban.
hidrogén-peroxid hydrogen peroxide gyenge sav, erős
elektronelvonó; szerepe van a szabadgyökök keletkezésében. Képlete: H2O2. A víznél sűrűbb, halványkék,
oldatban szagtalan, színtelen és keserű ízű, párolog (párolgása a szemeket
ingerli). Fertőtlenítő hatású, az orvosi gyakorlatban pl. a sebek
fertőtlenítésére használjuk.