aminosavak amino
acids a fehérjék építőelemei; láncot
képezve hozzák létre a fehérjéket a peptideken keresztül. Az aminosavak a
természet legfontosabb négy elemét (C, H, N, O) tartalmazzák; némelyikhez kén
is kapcsolódik, amelynek helyére a szelén is beléphet. Két részből állnak:
▪ Állandó rész. Ez az α-szénatomból a
hozzákapcsolódó hidrogénatommal és karboxilcsoporttal (COOH), valamint az aminocsoportból
(NH2) tevődik össze. Azt a szénatomot nevezzük α-szénatomnak,
amelyhez a karboxilcsoport kötődik.
▪ Változó rész, amely az oldalláncból (R); ez
szintén az α-szénatomhoz kapcsolódik. Az egyes aminosavak az oldalláncban
különböznek, tulajdonságukat az oldallánc határozza meg. Az oldalláncok
lehetnek egyszerűek, a legegyszerűbb egyetlen hidrogénatom, összetettebbek, sőt
bonyolultabbak, például gyűrűs szerkezetet tartalmazók is. Bizonyos aminosavak
oldalláncai víztaszítók, mások vízkedvelők. Vannak (pozitív vagy negatív)
töltéssel bíró (kétsarkú) és semleges oldalláncok.
Az
aminosavak szénatomjait kétféleképpen is jelölik: 1., 2. 3…, ahol az 1. a cooh-csoport szénatomja, vagy α, β, γ… Megkülönböztetünk
α-, β-, γ-aminosavakat attól függően, hogy az aminocsoport az α-, β- vagy a γ-szénatomhoz
(másként: az 1-es, 2-es vagy 3-as szénatomhoz) kötődik. Pl. az α-, a β- és a γ-aminovajsav
(butánsav):
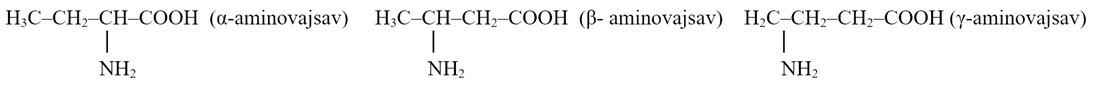
Ezek összegképlete azonos (C4H9O2N1),
szerkezetükben különböznel (szerkezeti azonmások).
A
fehérjét alkotó aminosavak mind α-aminosavak (α-amino-karbonsavak, R–CH(NH2)–COOH),
mert a hidrogén, az amino- és a karboxilcsoport, valamint az oldallánc is
ugyanahhoz a szénatomhoz kötődik. A szervezetben azonban előfordul másféle
aminosav is, pl. a β-alanin, amely a koenzim-A összetevője.
 A karboxilcsoport savas, az aminocsoport bázikus
tulajdonságú hatócsoport, ezért az aminosavak vizes közegben (ilyen a
sejtplazma) ikerion formájában is lehetnek. A COOH vizes közegben könnyen ad le
egy protont, amelyet a víz szállít, H2O+ formájában, és az NH2
is felveheti, és ikerion jön létre; egyazon aminosavnak pozitív és negatív
töltésű hatócsoportja is van. A karbonilcsoport negatív (COO-), a H3N-csoport
pozitív töltésű (H3N+). (Az ábrán R = oldallánc; C* =
α-szénatom) A töltés nélküli és az ikerionos forma a vizes közegben
egyensúlyban van, az ikerionok némi túlsúlyával.
A karboxilcsoport savas, az aminocsoport bázikus
tulajdonságú hatócsoport, ezért az aminosavak vizes közegben (ilyen a
sejtplazma) ikerion formájában is lehetnek. A COOH vizes közegben könnyen ad le
egy protont, amelyet a víz szállít, H2O+ formájában, és az NH2
is felveheti, és ikerion jön létre; egyazon aminosavnak pozitív és negatív
töltésű hatócsoportja is van. A karbonilcsoport negatív (COO-), a H3N-csoport
pozitív töltésű (H3N+). (Az ábrán R = oldallánc; C* =
α-szénatom) A töltés nélküli és az ikerionos forma a vizes közegben
egyensúlyban van, az ikerionok némi túlsúlyával.
Fehérjeépítőnek 21 aminosavat tekintünk, ezek:
alanin (Ala, A), arginin (Arg, R), aszparagin (Asn, N),
aszparaginsav (Asp, D), cisztein (Cys, C), fenilalanin (Phe, F), glutamin (Gln,
Q), glutaminsav (Glu, E), glicin (Gly, Gln, G), hisztidin (His, H), izoleucin
(Ile, I), leucin (Leu, L), lizin (Lys, K), metionin (Met, M), prolin (Pro,P), szelenocisztein
(Sec), szerin (Ser, S), treonin (Thr, T), triptofán (Trp, W), tirozin (Tyr, Y),
valin (Val, V).
■ Víztaszító oldalláncú aminosavak:
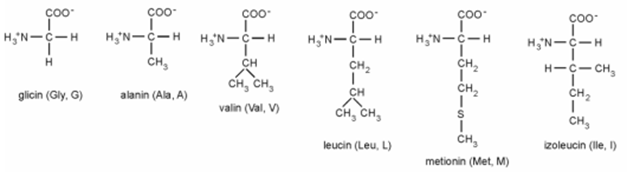
■ Vízkedvelő oldalláncú aminosavak:
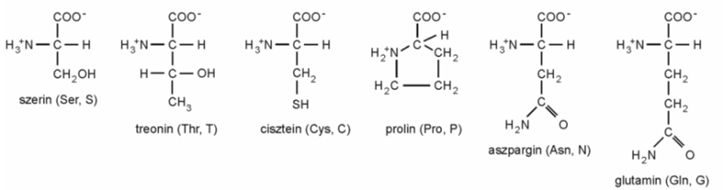
■ Pozitív töltésű oldalláncúak:
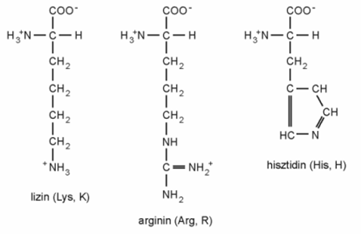
■ Negatív töltésű oldalláncúak:
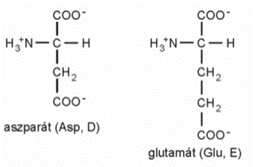
■ Gyűrűs oldalláncúak:
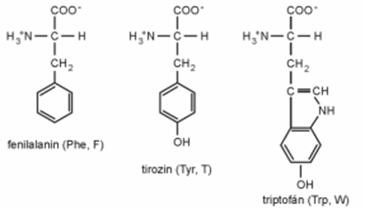
A
200-nál többféle aminosav közül a többit nem soroljuk a fehérjét képezők közé,
mert vagy D-aminosavak, vagy az aminocsoportot nem az α-szénatomon kapcsolják,
vagyis β-/γ-aminosavak. Szervezetünk a 21 féle fehérjeképző aminosav közült
csak tízfélét képes előállítani, a többit a táplálékkal vesszük fel; ezek a táplálékaminosavak*
(essential amino acids, esszenciális aminosavak). A tápláléaminosavakat
a növények képezik a mikrobák által, a légköri nitrogén megkötésével
előállított ammónnia felvételével.
Az
aminosavak α-szénatomjai (néhány kivétellel, pl. glicin – az oldallánca
egyetlen hidrogén) térközpontok, vagyis négy különböző vegységet (atomot
és/vagy atomcsoportot) kötnek, ezért tükörképi azonmások jönnek létre
(→téralakzati azonmások). A tükörképi azonmások vegyi és a fizikai tulajdonsága
egyforma, kivéve, hogy kristályos formájukban a síkban sarkított fényt
(polarized light) ellenkezőleg forgatják (fényforgató azonmások), aminek
következtében eltérhet a biológiai hatásuk. Ezek téralakzatát
hagyománytiszteletből D és L betűvel jelöljük, de egyre inkább terjed az R–S
jelölés. A fehérjeképző aminosavak mind L-szerkezetűek; megfelel az
S-szerkezetnek.
Az aminosavak sorrendjének váltakozásával rendkívül
sokféle (~1012 nagyságrendű) fehérje keletkezhet. Természetesen nem
mindegyik fehérjében fordul elő az összes aminosav, valamint a fehérjék
aminosav-összetétele változhat is a fehérje működésekor: más aminosav kötődik
be, aminek következtében a fehérje is megváltozhat, más fehérjévé alakulhat. Az
aminosavak legnagyobb része a fehérjékben van, a sejtekben szabad aminosavak
csak nagyon kis mennyiségben fordulnak elő.
aminosavak tevősödése amino
acid activation (más néven: aminoacylation, tRNA charging) az
aminosav és a tRNS kapcsolódása. (→szállító RNS – aminosav kapcsolódás)
aminosav–tRNS kapcsolódás
(→szállító RNS)
bázispárcsere* single
nucleotide variation, SNV egyetlen bázispár cserélődése másik illeszkedő
bázispárra a DNS bázissorában. Lehet bázishasonló*, amikor purinbázis
cserélődik purinbázisra, illetőleg pirimidinbázis pirimidinbázisa; és lehet
báziselütő*: purinbázis–pirimidinbázis csere. A cserélődött bázis kiegészül az
illeszkedő párjával. A bázispárcsere a DNS bármely részén előfordul; leginkább
a gének között, de a gének kódoló (1 százalék) és nem kódoló részében is.
Különösen gyakori az ismétletekben. A bázispárcseréből alakult bázissor a bázispárcserés
változat (single nucleotide variant, SNV).
A
kódoló szakaszban lévő bázispárcseréből keletkező fehérje (aminosavsor) formája
szerint háromféle ismert:
azonaminosavas párcsere* synonymous
mutation (nevezik single amino acid samesense change-nek is) olyan
báziscserélődés, amely nem változtatja meg a fehérje aminosavait. Keletkezhet
ugyanis olyan bázishármas, amelyik ugyanazt az aminosavat kódolja, például
GTT>GTC változás; mindkettő valint kódol. Az emberi DNS-ben ugyanis 64
bázishármas kódol 20 aminosavat, azaz egy-egy aminosavat több bázishármas is
képezhet. Ezt a jelenséget a nemzetközi irodalom degeneracy of genetic code-nak
nevezi, magyarul génkódbőségnek* mondhatjuk. A polipeptid képződése vagy
alakulása azonban módosulhat, például változhat az átíródás, átfordítódás
üteme, a közteskivágás stb., ezért az egyedségben valamilyen módon
megnyilvánul.
néma azonaminosavas párcsere* silent mutation
(néma másulás, néma mutáció) olyan aminosav-változást nem okozó egyetlen
bázispár-cserélődés, amely az egyedségben jóformán nem nyilvánul meg. A polipeptidlánc
képződése és további alakulása változatlan.
 egy aminosavas párcsere* missense mutation, non-synonymous mutation (más néven single amino acid missense change,
missense mutation) egyetlen aminosavcserét okozó
bázispár-cserélődés: a polipeptidlánc egyik aminosavának helyére másik épül be.
Szabálytalanul (másként) működő vagy nem működő fehérje keletkezik. Az ábrán a
prolint, a glicint és a tirozint kódoló bázishármas látható. A TA bázispár
cserélődik GC-re, aminek következtében nem tirozint, hanem szerint kódoló
bázishármas alakul ki az mRNS-en. A keletkező fehérjében egy tirozin helyett
szerin lesz. A polipeptid további képződése változatlanul folytatódik.
Összetételében más fehérje keletkezik, de az aminosavsor és a fehérje hossza
sem változik. A létrejövő fehérje működése megváltozhat, változhat a szerkezete
is. Ez elsősorban attól függ, hogy milyen aminosav cserélődik: ha lényegesen
más tulajdonságú épül be, mint az eredeti, nagyobb zavar keletkezhet a fehérje
működésében.
egy aminosavas párcsere* missense mutation, non-synonymous mutation (más néven single amino acid missense change,
missense mutation) egyetlen aminosavcserét okozó
bázispár-cserélődés: a polipeptidlánc egyik aminosavának helyére másik épül be.
Szabálytalanul (másként) működő vagy nem működő fehérje keletkezik. Az ábrán a
prolint, a glicint és a tirozint kódoló bázishármas látható. A TA bázispár
cserélődik GC-re, aminek következtében nem tirozint, hanem szerint kódoló
bázishármas alakul ki az mRNS-en. A keletkező fehérjében egy tirozin helyett
szerin lesz. A polipeptid további képződése változatlanul folytatódik.
Összetételében más fehérje keletkezik, de az aminosavsor és a fehérje hossza
sem változik. A létrejövő fehérje működése megváltozhat, változhat a szerkezete
is. Ez elsősorban attól függ, hogy milyen aminosav cserélődik: ha lényegesen
más tulajdonságú épül be, mint az eredeti, nagyobb zavar keletkezhet a fehérje
működésében.
 záróhármashiba* nonsense mutation záró bázishármas* (stop
codon) kialakulásához vezető egyetlen bázispár cserélődése, amelynek
következtében csonkfehérje* (truncated protein) keletkezik. A fehérje egy része
hiányzik, és általában nem működik. Szerkezete attól függ, hogy a báziscsere
következtében melyik bázishármas alakul záróvá. Az ábrán a prolint, a glicint
és a tirozint kódoló bázishármas látható. A GC bázispár csrélődik CG-re, aminek
következtében nem tirozint kódoló hármas, hanem záróhármas (UAG) keletkezik az
mRNS-en, és az átfordítódás idő előtt befejeződik, hiányos fehérje jön létre.
záróhármashiba* nonsense mutation záró bázishármas* (stop
codon) kialakulásához vezető egyetlen bázispár cserélődése, amelynek
következtében csonkfehérje* (truncated protein) keletkezik. A fehérje egy része
hiányzik, és általában nem működik. Szerkezete attól függ, hogy a báziscsere
következtében melyik bázishármas alakul záróvá. Az ábrán a prolint, a glicint
és a tirozint kódoló bázishármas látható. A GC bázispár csrélődik CG-re, aminek
következtében nem tirozint kódoló hármas, hanem záróhármas (UAG) keletkezik az
mRNS-en, és az átfordítódás idő előtt befejeződik, hiányos fehérje jön létre.
A nem kódoló DNS-szakaszon lévő
bázispácsere szintén befolyásolhatja a fehérjeképződést: hatással lehet a
mRNS-re, a nem kódoló RNS-re, az átírásfehérje kapcsolódására, az átfordításra
és a közteskivágásra is.
Az egy aminosavas párcserét és a záróhármashibát közös néven másaminosavas párcserének (nonsynonymous SNV) nevezzük.
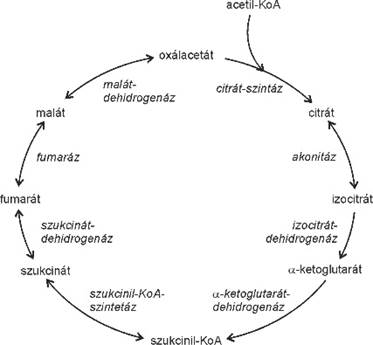 citrát-kör (Krebs-kör, Szent-Györgyi–Krebs-kör,
citromsavkör) tricarboxylic acid (TCA) cycle a sejtlégzés harmadik szakasza (→sejtlégzés),
energiatermelő körfolyamat, amely az anyagcsere-folyamatok sokaságában vesz
részt, az energiatermecs alapállományában megy végbe. Lévén körfolyamat, nincs
kezdete, sem vége; különböző molekulák más-más pontjain kapcsolódhatnak bele.
Talán az acetil-koenzim-A (acetil-KoA) társulás a leggyakoribb, amely a 4
szénatomos oxálacetáthoz (oxálecetsav) csatlakozik. A 2 szénatomos acetát
kötődik az oxálacetáthoz, és 6 szénatomos citrát keletkezik a citrát-szintetáz
közreműködésével; a KoA szabaddá válik, újrahasznosul.
citrát-kör (Krebs-kör, Szent-Györgyi–Krebs-kör,
citromsavkör) tricarboxylic acid (TCA) cycle a sejtlégzés harmadik szakasza (→sejtlégzés),
energiatermelő körfolyamat, amely az anyagcsere-folyamatok sokaságában vesz
részt, az energiatermecs alapállományában megy végbe. Lévén körfolyamat, nincs
kezdete, sem vége; különböző molekulák más-más pontjain kapcsolódhatnak bele.
Talán az acetil-koenzim-A (acetil-KoA) társulás a leggyakoribb, amely a 4
szénatomos oxálacetáthoz (oxálecetsav) csatlakozik. A 2 szénatomos acetát
kötődik az oxálacetáthoz, és 6 szénatomos citrát keletkezik a citrát-szintetáz
közreműködésével; a KoA szabaddá válik, újrahasznosul.
A következő lépésben a citrát elektronleadással
átalakul (izocitráton keresztül) az 5 szénatomos α-ketoglutaráttá és CO2-vé;
az elektront a NAD+ veszi fel, NADH +H+ keletkezik. Az
α-ketoglutarátból a 4 szénatomos szukcinil-KoA képződik, KoA kötődésével. Ez
szintén elektronleadással jár, itt is NADH + H+ jön létre és CO2
szabadul fel.
A
további vegyületek a körben mind négy szénatomosak. A szukcinil-KoA szukcináttá
alakul; a KoA leválik és energia szabadul fel, amely elegendő a GDP
foszforilezéséhez, GTP-vé alakításához.
A szukcinátból két elektron leadásával fumarát lesz, az
elektronokat a FAD veszi fel, FADH2 keletkezik.
A fumarátból malát lesz, a malátból pedig oxálacetát,
és ezzel zárul a kör. A szukcinil-KoA – oxálacetát szakasz egyes lépései
visszafordíthatók, a többi nem. A citrát-kör egésze megfordíthatatlan.
A citrát-kör végeredményben a piruvátból származó két
szénatomos acetilcsoport bontása elektronelvonással úgy, hogy mind a két
szénatom CO2-vé alakul; a szükséges oxigént vízmolekulából nyeri, a
hidrogénjeit a NAD+ és a FAD veszi fel. A folyamat tiszta mérlege:
az energiatermecs alapállományában lévő oxálacetáthoz több lépésben, köztes
termékeken keresztül hozzáadjuk a következőket: acetil-KoA + 3 NAD+
+ FAD + GDP + Pi. Visszanyerődik a KoA, keletkezik két molekula CO2,
valamint 3 NADH+H+, 1 FADH2 és 1 GTP. A 3NADH+H+
körülbelül kilenc, a FADH2 pedig két ATP létrejöttéhez szükséges
energiát hordoz.
A
citrát-kör azonban nemcsak a sejtlégzésben vesz részt, hanem az
anyagcsere-folyamatok zömében:
▪ Aminosavak lebontásában és újrahasznosításában cukorforrásként.
18-féle aminosavból keletkezhet glükóz, kizárólagosan a citrát-körön keresztül.
Néhány (Ala, Gly, Ser, Cys, Thr, Trp) piruvátra bomlik, majd oxálacetáttá
alakul. A Glu, Gln, Arg, His, Pro α-ketogluterátra, a Met, Ile, Val, Thr
szukcinil-KoA-ra, az Asp, Asn, Phe, Tyr fumarátra vagy oxálacetátra (Asp, Asn)
bomlik. Ezekből a molekulákból pedig szükség esetén megfelelő enzimek glükózt
tudnak létrehozni. Ennek az éhezés állapotában van nagy jelentősége, mert ekkor
a fehérjékből származó aminosavak a vér által a sejtekhez szállított megfelelő
mennyiségű cukor forrásai.
A néhány aminosavból keletkező piruvát a
glükóz bontásából keletkező piruváttal egyezően be is juthat a citrát-körbe,
ahol az ismertetett módon energia szabadulhat fel belőlük.
▪ A zsírsavak energiájának kinyerésében. A zsírsavak
lebontásából acetil-KoA keletkezik, ez pedig szintén a citrát-körön keresztül járul
hozzá az ATP képződéséhez.
▪ Felépítő folyamatokban. Ezekben a citrát-körből
kilépő molekulák vesznek részt, pl. a zsírsavak felépítésében a citrát,
aminosavak keletkezésében az α-ketogluterát, a porfirinváz kialakításában a
szukcinil-KoA.
csavarodás helix 1. Síkban: egy pontból
kiinduló olyan folytonos görbe, amely a kiinduló pont körül halad, állandóan
távolodva. 2. Térben: a csigaház vonalára hasonlító térbeli görbe.
(→fehérjeszerkezet)
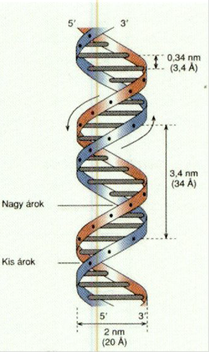 DNS kettős csavarodás* double helix A két csavarmenetű DNS-szál egymás
köré tekeredik ellentétes irányban (az egyik 5’→3’ a másik 3’→5’ helyzetű). Ezt
a szerkezetet nevezzük kettős csavarodásnak*; ez a kettős DNS-szál alakja. A
kettős szál átmérője 2 nm. A bázisok síkja a tengelyre merőleges, de a bázisok
egymáshoz viszonyítva 36o-kal elfordulnak, a köztük lévő távolság
0,34 nm. A csavarlat egy-egy 360º-os fordulata között tehát 10 nukleotid
található, a csavarulat távolsága pedig 3,4 nm. Az ettől eltérő tekeredés a
túltekeredés (supercoiling), amely lehet negatív és pozitív.
(→DNS-túltekeredés).
DNS kettős csavarodás* double helix A két csavarmenetű DNS-szál egymás
köré tekeredik ellentétes irányban (az egyik 5’→3’ a másik 3’→5’ helyzetű). Ezt
a szerkezetet nevezzük kettős csavarodásnak*; ez a kettős DNS-szál alakja. A
kettős szál átmérője 2 nm. A bázisok síkja a tengelyre merőleges, de a bázisok
egymáshoz viszonyítva 36o-kal elfordulnak, a köztük lévő távolság
0,34 nm. A csavarlat egy-egy 360º-os fordulata között tehát 10 nukleotid
található, a csavarulat távolsága pedig 3,4 nm. Az ettől eltérő tekeredés a
túltekeredés (supercoiling), amely lehet negatív és pozitív.
(→DNS-túltekeredés).
A két szálú DNS állékonyságában jelentős szerepe van a
víztaszító hatásnak: A bázisoknak viszonylag nincs töltésük (víztaszítók), a
foszfát pedig negatív töltésű (vízkedvelő), ezért kerül a foszfátot tartalmazó
gerinc a DNS felszínére, és zárja be a bázisokat. A foszfát miatt a DNS
felszíne negatív töltésű, és mert vizes közegben a töltéssel bíró (vízkedvelő)
molekulák fordulnak a víz felé, a foszfát akadályozza, hogy a víz hozzáférjen
az észterkötéshez, és felbontsa. A foszfátcsoport tehát védi a DNS-t a vízoldékonyságtól.
A DNS szerkezetének állandóságában lényeges még az is, hogy a bázisok
oxoformában vannak – ez teszi lehetővé, hogy a törzsfejlődésben
bekövetkezhessenek szerkezetváltozások. Az enolforma kivételesen fordul elő. A
kettős szál biztonságát még az is segíti, hogy a bázisok között jelentékeny
London-féle kölcsönhatások is kialakulnak.
A
DNS-szálak egymás köré tekeredése végbemehet jobbra és balra is, ezért
jobbmenetes (a-, b-, és cDNS) és balmenetes (zDNS)
csavarulat is keletkezhet. A bDNS-t (B-form DNA) tekintjük a DNS
élettani formájának, a szervezetben általában ez fordul elő. Az aDNS és
a cDNS környezeti hatásokra (alacsony nedvesség és sótartalom) a bDNS-ből
keletkezik. Az aDNS-ben a bázispárok nem merőlegesek a kettős szál
képzelt tengelyére – attól 19o-kal eltérnek –, aminek következtében
a kis árok szinte eltűnik, a DNS megrövidül. Egy-egy menetnek megfelelően nem
10, hanem 11 nukleotid helyezkedik el. A cDNS a bDNS-től abban tér el, hogy
benne egy-egy csavarulatot 9 nukleotid képez.
A zDNS nevét cikkcakkos (zig-zag) felcsavarodásáról kapta,
amely a nukleozidok térbeli elhelyezkedéséből keletkezik. Szemben az anti
helyzetű a- és bDNS-sel, a zDNS-ben a pirimidin- anti, a purinnukleozidok szün helyzetűek, ezért
bennük csak egyféle árok található. Egy-egy csavarmenetet 12 nukleotid képez. A
zDNS hosszabb és vékonyabb, mint a bDNS. Előfordul, hogy a
DNS-nek csupán egy-egy rövidebb szakaszán alakul ki.
A két szálú DNS jóval állékonyabb, mint az egyszálú,
mert a kettős csavarodás védi a bázisokat a károsító, másulást okozó vegyi és
enzimhatásoktól. Erre utal pl. az is, hogy a citidin deaminacioja, aminek
következtében a citidinből uracil keletkezik, csak az egyszálú DNS-en
következik be, a kétszálun nem. További előnye a kettős szerkezetnek, hogy
ugyanazt a genetikai üzenetet a sejt két szálon is tárolja; a szálak egymás
kiegészítői. Ha hiba keletkezik, a nukleotidsor a másik szálról teljesen
helyreállítható.
A kettős szerkezet rugalmas, a DNS-folyamatokban, pl.
génátíródás, DNS-másolódás vagy DNS-javítás, a két szál szétválik, a
folyamatokban résztvevő fehérjék csak így férhetnek a bázisokhoz. A szálak
szétválasztását a a DNS-helikázok végzik a hidrogénkötések felbontásával
ATP-energia segítségével.
ecetsavoldat méhnyaktükrözéshez rendszerint hígított (3–5%-os) ecetsavoldat használunk
ma is, noha nagyon sok hasonló savnak a különböző töménységű oldatát
tanulmányozták, hogy van-e a hígított ecetsavnál megfelelőbb, de egyik sem
terjedt el, jóllehet nem kizárt, hogy a jövőben lesz olyan, amellyel a háttér
szöveti elváltozás pontosabban körvonalazható.
ecetsavvizsgálat a
higított (3–5%-os) ecetsav méhnyakra kenése. Hinselman alkalmazta
először, mindenekelőtt a méhnyaknyák eltávolítására javasolta, a hígított
ecetsav nyákoldó, letisztítja a méhnyakat. Az ecetsavas ecsetelésnek több
formáját is alkalmazzák. Használhatunk gyárilag előállított permetet (spray-t)
vagy vattapamatot, amely talán a legegyszerűbb és a legmegfelelőbb is. Az
ecetsavas oldatnak a méhnyakra öntése – 3-5 ml a hüvelybe – nem megfelelő,
csípő, maró érzést okozhat, meg pocsékolás is.
Az ecetsavval átitatott vattapamattal a méhszájat 5-10
másodpercig ecseteljük, ügyelve, hogy az egész átmeneti sávot és a környékét is
bekenjük. Ha az elszíneződés csak sejlik, az ecsetelést kétszer-háromszor is
megismételhetjük, gyorsan egymás után.
A vizsgálatban a színelváltozás mellett azt is meg kell
figyelni, hogy a fehéresedés milyen gyorsan alakul ki, szükséges-e többszöri
ecsetelés, és hogy milyen hosszan marad meg: hamar elhalványul, vagy akár
percekig is jól látható.
Az ecetsavvizsgálat tárja fel a háromféle hámszövetet,
ezek határait, az átmeneti sávot, kötőszövetet stb., továbbá a
szövetmintázatokat; a nemzetközi irodalom pattern recognition-nek
nevezi, a mintázatokra pedig a colposcopic features/signs elnevezést
alkalmazzák. A kolposzkópiai mintázatokból, jelekből következtethetünk a
nyálkahártya (bőr) szerkezetére, elváltozásaira, azaz a mintázatokat, jeleket
kialakító szövetszerkezetekre.
Természetesen valamely szabad szemmel látható
elváltozás is vizsgálható tükrözéssel – a részletek, például a csak nagyítással
felismerhetők (kóros erek) tanulmányozására.
esszenciális aminosavak essential amino acids táplálékaminosavak (→aminosavak)
fehérje–fehérje kölcsönhatások protein–protein interactions, PPI két vagy több fehérje társulása; a sejtfolyanatok
mindegyikében bekövetkezik. Három alapformájuk ismert:
▪ felszíni
illeszkedés* surface–surface interaction a két fehérje felszini
domborzata illeszkedik egymásba, mint a kulcs a zárba. Rendkívül fajlagos,
viszonylag erős kapcsolódás.
▪ csavarmenetes illeszkedés*
helix–helix interaction a társuló fehérjék egy-egy csavarmenete
illeszkedik egymásba, fonadékot (coiled coil) képezve. Erős kapcsolódás;
jellemző a génműködést szabályozó fehérjék kötődésére. (→fehérjealakzatok)
▪ hurokágyazódás*
surface–string interaction az egyik fehérje kiálló hurka (aminosavlánca)
belefekszik a másik fehérje felszíni vájatába. Általában a foszforilezendő
gomolyok megnyúlt aminosavlánca kötődik így, pl. SH2 gomoly tirozonsora a
foszforilező fehérje vájatába.
helix csavarodás (→DNS, fehérje)
szállító RNS – aminosav kapcsolódás Az érett tRNS-nek a CCA-végződésén lévő adenozin 3’-hidroxilcsoportjához
kapcsolódik a hozzá tartozó aminosav karboxilcsoportja észterkötéssel, az
aminoacil-tRNS-szintetáz (aminoacyl tRNA
synthetase, aaRS) közreműködésével. Az
észterkötés hőigényes, ATP felhasználásával megy végbe. (→aminoacil-tRNS-szintetáz)
▪ Az aminoacil-tRNS-szintetáz először aminosavat és
ATP-t kapcsol: aminoacil-AMP keletkezik pirofoszfát felszabadulásával: aminosav
+ ATP → aminoacil-AMP + PPi. (→ATP)
▪ Az aminoacil-AMP-t tartalmazó enzim kapcsolja az
adott aminosavnak megfelelő tRNS-t, amelyet térszerkezet-fajlagosan ismer fel.
A kapcsolt tRNS 3’-végi ribózának kettes/hármas szénatomján lévő
hidroxilcsoportja kötődik észterkötéssel az aminoacil-AMP-hez; az AMP leválik,
az aminosavval kapcsolt tRNS pedig elválik az enzimtől: aminoacil-AMP + tRNS
→ aminoacil-tRNS + AMP.
A folyamattal az aminosav úgymond
tevősödik (aminoacid activation), mert az észterkötésben lévő energia elegendő
két aminosavat összekötő peptidkötéshez. (A peptidkötés kialakulása hőleadó
folyamat.)
Az
enzim és az aminosav kapcsolata fajlagos: minden aminosavfajtának csak egyféle
térszerkezetet azonosító enzime van, illetőleg az egyféle térszerkezetet
felismerő enzim csak egyféle aminosavval társul.
Egyféle aminosavat többféle ellenhármasú tRNS is
kapcsolhat. Például a fenilalaninnal az AAA és a GAA bázishármast tartalmazó
tRNS is társul. A térszerkezete azonban mindkét tRNS-nek azonos (az ellenhármas
nem befolyásolja a térszerkezetet), ezért mindkettőt ugyanaz az
aminoacil-tRNS-szintetáz ismeri fel, és kapcsolja mindegyikhez ugyanazt az
aminosavat, példánkban a fenilalanint. Ez a többféleség teszi rugalmassá az
illeszkedést.
Ha nem megfelelő az aminosav–tRNS társulás, az
aminoacil-tRNS-szintetáz vágógomolya lehasítja az aminosavak, a sarkallógomoly
pedig a megfelelőre cseréli pillanatok alatt (saját ellenőrzés). Ennek ellenére
keletkezhet hibásan társult aminoacil-tRNS (~ minden 40 000. hibás),
amelyből hibás fehérje keletkezik. Ezt a sejt lebontja, nincs komoly
következménye.
tápaminosavak essential
amino acids (esszenciális aminosavak) (→aminosavak)
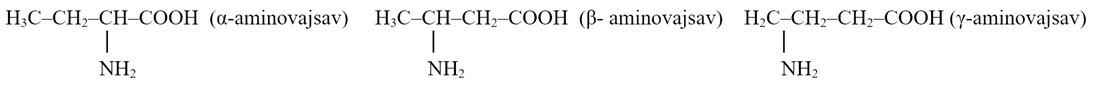
 A karboxilcsoport savas, az aminocsoport bázikus
tulajdonságú hatócsoport, ezért az aminosavak vizes közegben (ilyen a
sejtplazma) ikerion formájában is lehetnek. A COOH vizes közegben könnyen ad le
egy protont, amelyet a víz szállít, H2O+ formájában, és az NH2
is felveheti, és ikerion jön létre; egyazon aminosavnak pozitív és negatív
töltésű hatócsoportja is van. A karbonilcsoport negatív (COO-), a H3N-csoport
pozitív töltésű (H3N+). (Az ábrán R = oldallánc; C* =
α-szénatom) A töltés nélküli és az ikerionos forma a vizes közegben
egyensúlyban van, az ikerionok némi túlsúlyával.
A karboxilcsoport savas, az aminocsoport bázikus
tulajdonságú hatócsoport, ezért az aminosavak vizes közegben (ilyen a
sejtplazma) ikerion formájában is lehetnek. A COOH vizes közegben könnyen ad le
egy protont, amelyet a víz szállít, H2O+ formájában, és az NH2
is felveheti, és ikerion jön létre; egyazon aminosavnak pozitív és negatív
töltésű hatócsoportja is van. A karbonilcsoport negatív (COO-), a H3N-csoport
pozitív töltésű (H3N+). (Az ábrán R = oldallánc; C* =
α-szénatom) A töltés nélküli és az ikerionos forma a vizes közegben
egyensúlyban van, az ikerionok némi túlsúlyával.







