szállító RNS, tRNS transfer RNA, tRNA kis, 75–90 nukleotidból álló, jellegzetes – a fajokban többé-kevésbé azonos – szerkezetű ribonukleinsav; a keletkező polipeptidlánc és az átfordítódó mRNS közötti kapocs: az aminosavat szállítja a fehérjeképző rendszerhez, a ribotestecshez. Két működési egysége van: az ellenhármas (anticodon), amely 3 bázisból áll, és az mRNS kiegészítő bázishármasával társul, biztosítva, hogy a megfelelő aminosav kerül a fehérjébe; valamint az aminosavat kapcsoló rész.
Sok száz tRNS gén ismert; a DNS-ben szétszórva helyezkednek el, csak a 22-es és az Y-kromoszómán nincs. Nem mindegyik tRNS gén tevékeny. 22 tRNS gén a mitokondriumokban…… is található. Az átíródást a TF3B és TF3C indítja, és az RNS-polimeráz-3 végzi.
 elő-tRNS a génekről egyszálú elő-tRNS másolódik, amelyben hidrogénkötésekkel
bázispárok keletkeznek. A hidrogénhidak állandósítják a molekulát, és
párhuzamosan rendezett kettős szálú szakaszokat alakítanak ki. A kétszálú
szakaszok között négy egyszálú hurok formálódik. A hurkok a nem kiegészítő
bázisok szembekerülésével jönnek létre: ezekhez ugyanis nem kapcsolódnak
hidrogénkötések, ezért nem alakul ki a kettős szál. A nem kiegészítő (adenin,
guanin és citozin) bázisok között keletkező kölcsönhatások (London-féle erők
stb.) alakítják az egyenes vonalú nukleotidsort hurok alakúvá. Lóhere alakú
szerkezet keletkezik, amelyből kivágásokkal – hasonlóan, mint az elő-mRNS–mRNS
átalakulásnál – jön létre a másodlagos szerkezetű tRNS. Ez a folyamat az
átíródáskor és rögtön utána megy végbe.
elő-tRNS a génekről egyszálú elő-tRNS másolódik, amelyben hidrogénkötésekkel
bázispárok keletkeznek. A hidrogénhidak állandósítják a molekulát, és
párhuzamosan rendezett kettős szálú szakaszokat alakítanak ki. A kétszálú
szakaszok között négy egyszálú hurok formálódik. A hurkok a nem kiegészítő
bázisok szembekerülésével jönnek létre: ezekhez ugyanis nem kapcsolódnak
hidrogénkötések, ezért nem alakul ki a kettős szál. A nem kiegészítő (adenin,
guanin és citozin) bázisok között keletkező kölcsönhatások (London-féle erők
stb.) alakítják az egyenes vonalú nukleotidsort hurok alakúvá. Lóhere alakú
szerkezet keletkezik, amelyből kivágásokkal – hasonlóan, mint az elő-mRNS–mRNS
átalakulásnál – jön létre a másodlagos szerkezetű tRNS. Ez a folyamat az
átíródáskor és rögtön utána megy végbe.
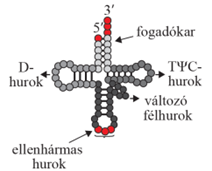
másodlagos szerkezetű tRNS lóhere alakú képlet, négy hurkot alakít ki, páros és páratlan karokkal összekapcsolva. Megkülönböztetünk D-hurkot (DHU-hurok; D-loop), TΨC-hurkot (TΨC loop), ellenhármas* hurkot (anticodon loop), és egy kisebb, változó alakú (fél) hurok (variable loop) is előfordul, amelyet változó többletkarnak/-huroknak is nevezünk – ez a páratlan kar; nincs mindegyik tRNS-ben. A hurkok elnevezése a bennük lévő módosított nukleotidok szerint (D-hurokban dihidro-uridin van, ezért DHU-huroknak is nevezik; a TΨC-hurkban pedig pszeudouridin [Ψ]). A páros karokat a hozzájuk tartozó hurkok szerint D-, TΨC- és ellenhármas karnak nevezzük. A 3’-végét a fogadókar (aminosav kar) alkotja a CCA-végződéssel (pirossal jelölve) és egy szabad hidroxil (OH) csoporttal, melyhez a szállítandó aminosav kapcsolódik, az 5’-végen pedig foszfátcsoport van. Az ellenhármas hurok alsó bázishármasa (pirossal jelölve) az mRNS valamelyik bázishármasainak a megfelelője, ellentétes bázishármasa (anti-codon), egyszerűen ellenhármas.
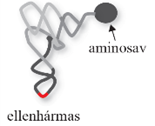 érett tRNS A másodlagos szerkezetű tRNS a sejtplazmában tömörödik (base-stacking) a
fogadókar és a TΨC-hurok között, illetőleg a D-hurok és az ellenhármas kar
között; L formájú lesz. Ez a tRNS harmadlagos szerkezete, amely
meglehetősen állékony. A harmadlagos szerkezet a nukleozidok módosulásával
(metil-guanozin [mG]; áluridin
[pseudouridine, ψ]),) jön létre; amit a
tRNS-módosító enzimek (tRNA-modifying enzymes,
tRNAmods) végeznek. A harmadlagos szerkezetű tRNS-t nevezzük érett tRNS-nek. Az
aminosav a tRNS3-véghez kapcsolódik, az ellenhármas pedig az mRNS illeszkedő
bázisaival társul.(Az ábrákat Balla Éva készítette.)
érett tRNS A másodlagos szerkezetű tRNS a sejtplazmában tömörödik (base-stacking) a
fogadókar és a TΨC-hurok között, illetőleg a D-hurok és az ellenhármas kar
között; L formájú lesz. Ez a tRNS harmadlagos szerkezete, amely
meglehetősen állékony. A harmadlagos szerkezet a nukleozidok módosulásával
(metil-guanozin [mG]; áluridin
[pseudouridine, ψ]),) jön létre; amit a
tRNS-módosító enzimek (tRNA-modifying enzymes,
tRNAmods) végeznek. A harmadlagos szerkezetű tRNS-t nevezzük érett tRNS-nek. Az
aminosav a tRNS3-véghez kapcsolódik, az ellenhármas pedig az mRNS illeszkedő
bázisaival társul.(Az ábrákat Balla Éva készítette.)
A nukleozidok átalakulása és a következményes harmadlagos szerkezet meghatározó, mert biztosítja a tRNS állékonyságát a sejtplazmában, továbbá, mert a tRNS csak így juthat a ribotestecsbe (ribosome), és kötődhet az aminoacil-tRNS-szintetázzal; az enzim ugyanis a térszerkezet egyes elemei alapján azonosítja a megfelelő tRNS-t. Ha a nukleozidok módosítása nem megfelelő, a tRNS rendre lebomlik. Megmaradása betegségeket (köztük rákot is) okozhat; kivált az ellenhármas zavara veszélyes.
Mivel a bázishármasok 64 változatban fordulhatnak elő, várható, hogy az mRNS-hez is 64 különböző tRNS társuljon. A valóságban azonban kevesebb, az emberi sejtekben 48-féle tRNS keletkezik. A hiányzó hármas párosodás a lötyögő párosodással oldódik meg. Ez azt jelenti, hogy egy-egy tRNS akkor is kapcsolódhat az ellenhármassal, ha csak az első két bázisuk kiegészítője egymásnak.