ribonukleinsav, RNS (→RNS)
RNS (ribonukleinsav) ribonucleic acid, RNA a DNS rövid egységének (gén, ismétlet stb.) átirata (primary transcript); a genetikai üzenet átvevője. A DNS-ben rejtett üzenetet közvetíti a sejtnek, közreműködik a genetikai üzenet végrehajtásában. Ez azért lényeges, mert ha a DNS hajtaná végre a genetikai üzenetet, például képezné a fehérjéket, óhatatlanul hibák sokasága keletkezne. Az RNS-ek tehát a DNS-hibák elkerülésére iktatódnak a DNS és a végrehajtó molekulák közé.
Az RNS-ek a keletkezésükkor azonnal fehérjékkel, az RNS-kötő fehérjékkel kapcsolódnak a magállományban lévő RNS-módosító központban* (processing centres, PCs). Ezek a fehérjék alakítják érett RNS-sé, és szállítják a sejtplazmába. Az RNS-kötő fehérjék bizonyára a magállomány sajátos helyein vannak, és amikor az átíródott RNS a módosító központba vándorol, kapcsolódnak hozzá. Az RNS-ek fehérjék nélkül azonnal lebomlanak. Kivétel a tRNS, amelynek a harmadlagos szerkezete biztosítja állékonyságát.
A RNS-ek az élet alapelemei; a sejtműködésnek jóformán minden formájában részt vesznek; szabályozzák a génkifejeződést is. Részt vesznek a vírusok elleni védekezésben. Egyes vírusokban helyettesítik a DNS-t (RNS-vírusok). Az RNS-ek hibái a betegségek sokaságát idézik elő: jelentősen összefüggnek például a rákkeletkezéssel.
Az emberi DNS sokféle ribonukleinsavat kódol, amelyeket két nagy csoportra osztunk:
• a fehérjék képzésében résztvevők (fehérjeképző RNS-ek),
• a fehérjék képzésében nem résztvevő, nem fehérjeképző RNS-ek.
Az első csoportba a hírvivő RNS-ek (mRNS) tartoznak, a másikba a többiek. A másik csoport tagjait többféle szempont szerint (nukleotidok hossza, a mintázatok és a működés alapján) csoportosítják, de sok az átfedés, ezért egyszerűbb ezeket csak két csoportra osztani: a szerkezeti és a szabályozó RNS-ek csoportjára. A hírvivő RNS az RNS-ek csupán ~2%-a, vagyis túlnyomó többségben nem fehérjeképző, hanem szerkezeti és szabályozó RNS keletkezik. Hozzávetőlegesen a DNS-állomány 90%-a íródik át RNS-re az élet folyamán.
Nagyon sokféle RNS-t ismerünk: →gyűrűs RNS, →lncRNS, →mRNS, →miRNS, →piRNS, →rRNS, →siRNS, →snRNS, →snoRNS, →TERC, →TERRA, →tRNS.
Találatok címszavakban (38 szócikk):
aminoacil-tRNS aminoacyl-tRNA aminosavval társult tRNS. (→szállító-RNS, szállító RNS – aminosav kapcsolódás)
DNS-vezető, RNS-vezető primer (5–20 bázisnyi) RNS/DNS mintafelület, amely kapcsolódik a kiegészítő bázisaihoz, köti és vezeti a polimerázt, például DNS-kettőződéskor. De alkalmazzuk laboratóriumi módszerekben (PCR, polymerase chain reaction), bázispásztázás is.
elő-mRNS (előhírvivő RNS) precursor mRNA, pre-mRNA – történelmi neve
a heterogeneous nuclearRNA-nak (hnRNA) – a gén átírásakor
keletkező éretlen mRNS (génátirat). A gént az RNS-polimeráz-2 teljes egészében
átírja, a közteseket és a képezőket is, az elő-mRNS tehát a képezőket és a közteseket
is tartalmazza. Az emberi génekben általában több köztes van, így az elő-mRNS-ben
is. Megtalálható benne az 5’- és a 3’-UTR (nem átfordítódó szakasz) is. Négyféle
szerkezeti elemből tevődik össze: 
• A 3’-végi és az 5’-végi rövid nem átfordító szakasz (3’-UTR, 5’-UTR). Azonos a gén, illetőleg az mRNS nem átfordító szakaszaival.
• A fehérjeképzők (a gén képezőiről másolódott kiegészítő bázissorok). Annyi van, ahány képező a génben, amelyről átíródott.
• Köztesek (a gén közteseiről másolódott kiegészítő bázissorok). Lévén, hogy a fehérjeképzők között vannak, ezeket is közteseknek nevezzük. Mindegyik guanin, uracil (GU) kettőssel kezdődik (5’-végi vágáspont* [5’ splice site – 5’SS]), és adenin, guanin (AG) kettőssel zárul (3’-végi vágáspont* [3’ splice site – 3’SS]). Ezek a kivágás helyeinek a meghatározói. Az RNS-szike vág ki. (→RNS-szike) A harmadik jellegzetes mintázat az A-elágazás (branchpoint, branch point sequence, BPS), amely ~20 bázissor törzsökös adenozinnal.
Az elő-mRNS-hez, létrejötte pillanatától, fehérjék sokasága kötődik; ezek az elő-RNS-kötő fehérjék (hnRNA-bindig proteins), együttes nevük hnRNP. (→elő-mRNS-kötő fehérjék, mRNS)
fehérjeköpenyes vírus DNS/RNS nucleocapszid a vírus DNS vagy RNS és fehérjeköpenyének együttes neve.
gyűrűs RNS circRNS circular RNAs, circRNA egyszálú, körkörös, 5’-, és 3’-vég nélküli RNS; az 5’.sapka és a 3’-farok nem alakul ki. Az elő-mRNS-ből keletkezik fordított vagylagos kivágódással (alternative back-splicing, ABS). A vágáshelyek fordítva (az alsó 5’-vágáshely a felső 3’-vágáshellyel) egyesülnek, elektronkötéssel gyűrűs szerkezet jön létre. Egyetlen génről nagyon sok gyűrűs RNS keletkezik. Az RNS-szike hozza létre a kivágási szabályozók irányításával.
A gyűrűs RNS-ek szerkezete változatos: képező a legtöbben van, de előfordul köztes, 3’- és 5’-UTR, sőt génközi rész is, különböző összetételben. Ennek megfelelően sokféle nemzetközi elnevezésük van: exoncircRNAs (EcircRNAs), intrinsic circRNAs vagy circular intronic RNAs (ciRNAs) és intron-exon circRNAs vagy exonic-intronic circRNAs (EIciRNAs). Az ecircRNS a leggyakoribb; sokszor kapcsolódik miRNS-sel és RNS-kötő fehérjével (RBP-vel).
A köztes gyűrűs RNS-ek kivételével a legtöbb a sejtplazmába szállítódik az UAP56 (DDX39B) és az URH49 (DDX39A) szállítófehérjék közreműködésével; függően a hosszuktól. Sok marad a sejtmagban is. A végek hiányában a gyűrűs RNS állékony, a sejtplazma enzimei kevéssé képesek megtámadni, ezért a plazmában szabadon vannak.
A gyűrűs RNS-ek hatásukat leginkább törlő miRNS-ként fejtik ki: versengve foglalják el az miRNS helyét az mRNS-en, megakadályozva, hogy az miRNS gátolja az mRNS-t, a fehérjeképződést. Így vesznek részt a sejtkör és a sejt–sejt kapcsolatok szabályozásában. A génátírást a magban lévő, főleg köztest tartalmazó circRNS-ek befolyásolják, serkenthetik az RNS-polimeráz-2-t.
A gyűrűs RNS átíródhat polipeptiddé. Az 5’-sapka-függő átfordítódás nem mehet végbe, de a circRNS tartalmazza az IRES-t (internal ribosome entry sites) és kapcsolódhat a olvasókerethez (ORF) is.
hírvivő RNS (mRNS) messenger RNA, mRNA az érett mRNS; ez szállítja a kódot a DNS-től a sejt fehérjeképző rendszeréhez, ezért nevezik hírvivőnek (messenger). Az elő-mRNS-ből alakul ki. (→elő-mRNS, RNS)
Ötféle szerkezeti elemét különböztetjük meg:
 • Az 5’-végét a
7-metil-guanozin-sapka*, egyszerűen 5’-sapka* (7-methylguanosine cap, methyl
7-GTP complex) alkotja, ez jószerivel jellemző mindegyik mRNS-re. Alapvetően az
5’-sapka akadályozza meg, hogy az exonukleáz lebontsa az mRNS-t. Szerepe van a
közteskivágásban, az mRNS szállításában és az átfordításban is.
• Az 5’-végét a
7-metil-guanozin-sapka*, egyszerűen 5’-sapka* (7-methylguanosine cap, methyl
7-GTP complex) alkotja, ez jószerivel jellemző mindegyik mRNS-re. Alapvetően az
5’-sapka akadályozza meg, hogy az exonukleáz lebontsa az mRNS-t. Szerepe van a
közteskivágásban, az mRNS szállításában és az átfordításban is.
• Az 5’-végi rövid nem átfordító szakasz (5’-UTR), amelyben csaknem mindig megtalálható a CCA/GCCAUGG-3′ bázissor – nevezik Kozak consensus sequence-nek is (Kozák-bázissor) –; a fehérjeképződés elindításában van szerepe. Az AUG bázishármas a fehérjeképződést befolyásoló hatásával az átfordítás szintjén szabályozza bizonyos gének kifejeződését.
• A fehérjeképző szakasz. Ez a végső olvasókeret (final reading frame), amely hármasokba rendezett nukleotidokból tevődik össze – egy-egy hármas kódol egy-egy aminosavat. A nukleotidok négyféle bázist tartalmaznak: adenin, guanin, citozin és uracil (timin helyett). Az olvasókeret az indítóhármassal (start codon), szokásosan AUG) kezdődik, és a záróhármassal (stop codon) végződik.
• A 3’-végi rövid nem átfordító szakasz (3’-UTR; untranslated region). Az átfordítást berekesztő hármas és az adenozinokból álló 3’-farok közt van; az mRNS létidejét (half-life) szabályozó szakasz. A nagyon rövid létidejű mRNS-eknek ez a szakasza 50–150 nukleotidból áll, AUUUA mintázatokkal. Változások a bázissorban hosszabbíthatják az mRNS-ek megmaradását.
• A 3’-véget a legtöbb mRNS-ben a sok adenozinból álló 3’-adenozinvég* (poly [A] tail, 3’-farok) alkotja.
köpenyes DNS/RNS nucleocapsid (nukleokapszid) a vírus DNS/RNS és köpenyének együttes neve.
(→vírusszerkezet)
köpenyes RNS* nucleocapsid (nukleokapszid) a vírus RNS-e a fehérjeköpenyével együtt. Önálló
egység, a vírusmag; önmagában egyik sem lehetséges.
lncRNS (long non-coding regulatory RNA, lncRNA) hosszú nem kódoló szabályozó RNS. Ezek olyan 200-nál több nukleotidot tartalmazó RNS-ek, amelyek nem fordítódnak fehérjére. Nevezik competing endogenous RNAs-nek (ceRNAs) is. Fontos a szerepük az átfordításban és szabályozásában, elsősorban az miRNS-ek,snoRNS-ek tevékenységét befolyásolják.
A kódoló génjük leginkább az indítóban van, de lehet a köztesekben és a fokozókban is. Gyakran keletkeznek génközi bázissorokról. Előfordul közöttük gyűrűs szerkezetű is.
Nagyon sokféle van, élettani folyamatok sokaságában (sejtelkülönülés, szervfejlődés stb.) vesznek részt. Hibáikból cukorbetegség, reumatoid ízületi gyulladás, szív-, érbetegségek, különböző rákok alakulhatnak ki. Osztályozásuk is sokféle: megkülönböztethetők a keletkezésük helye, a tevékenységük és a szerkezetük szerint is.
miRNS (mikro-RNS) micro RNA, miRNA (miRNA duplex) 20–25 nukleotidból álló, kétszálú törzsökös RNS; az egyik szál az irányítószál (guide stand, antisense stand) a másik a kísérőszál (passanger stand, sense stand). ~2000 féle miRNS ismert. Az miRNS gének kódolják, amelyek a genom 1–5%-át teszik ki. Előfordulnak a DNS egészén, még a fehérjét kódoló gének közteseiben, a nem átfordítódó szakaszaiban és jóval ritkábban a képezőkben is. Pl. az MCM7 fehérjét kódoló gén köztesében vagy a nem átfordítódó részében 3 miRNS gén csoportosul. Az miRNS-t kódoló géneket a polimeráz-II írja át.
Az miRNS két előalakból az elsődleges és az elő-miRNS*-ből formálódik:
• Elsődleges miRNS* (primary miRNA, pri-miRNA) nagy (legalább 1000 nukleotid hosszú). Ezt kódolja a gén.
Egy vagy több szárhurok van benne. Ezt ismeri fel a droshaegyütteshez* (Drosha Microprocessor complex), amely a drosha (RNáz-3) és a DGCR8 fehérje által kialakított ~600 kDa nagyságú együttes. A droshaegyüttes az elsődleges miRNS-t rögtön kapcsolja, és kivágja a szárhurkokat (~25 nukleotid) átlagosan 10 nukleotid hosszú véggel. Így keletkezik az elő-miRNS*.
A köztesekből származó elsődleges miRNS együtt fejeződik ki a gazda génnel, ezeket a droshaegyüttes még az elő-mRNS kivágása előtt átalakítja elő-miRNS-sé.
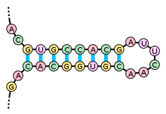 • Elő-miRNS (pre-miRNA, precursor miRNA)
kétszálú RNS jellegzetes szárhurokkal (stem-loop) és sok-A-as farkrésszel. Az
elő-miRNS-t a magból a kivivő fehérjepár* (nuclear
export machinery; exportin-5, RAN small DTPáz) a sejtplazmába szálltja,
ahol a DICER (RNáz-3, vég-RNáz), együttműködve a TRBP-vel, magához köti,
lehasítja a végi hurkot, kialakítva az érett miRNS-t, egyszerűen miRNS-t; ez az
AGO fehérjével kapcsolódik. Ebből jön létre a RISC, amelyben a miRNS
kísérőszála kilökődik, csak az irányítószál marad meg a kiegészítő mRNS
felismerésére. Az miRNS szabályozó hatása a RISC tagjaként érvényesül. (→RISC)
• Elő-miRNS (pre-miRNA, precursor miRNA)
kétszálú RNS jellegzetes szárhurokkal (stem-loop) és sok-A-as farkrésszel. Az
elő-miRNS-t a magból a kivivő fehérjepár* (nuclear
export machinery; exportin-5, RAN small DTPáz) a sejtplazmába szálltja,
ahol a DICER (RNáz-3, vég-RNáz), együttműködve a TRBP-vel, magához köti,
lehasítja a végi hurkot, kialakítva az érett miRNS-t, egyszerűen miRNS-t; ez az
AGO fehérjével kapcsolódik. Ebből jön létre a RISC, amelyben a miRNS
kísérőszála kilökődik, csak az irányítószál marad meg a kiegészítő mRNS
felismerésére. Az miRNS szabályozó hatása a RISC tagjaként érvényesül. (→RISC)
Az miRNS a génkifejeződés általános szabályozója; közbeavatkozó kis RNS. (→RNS-közbeavatkozás) A sejtmagban lévő miRNS csendesítheti vagy akár fokozhatja az átíródást azáltal, hogy kötődik az indítóhoz vagy a fokozóhoz, befolyásolja a DNS illetve a kromatin metilezését.
Sok miRISC van az energiatermecsben is. Nem tudjuk, hogy ezek az energiatermecs mRNS-eit is vagy csak a sejtmagból származó mRNS-eket támadják.
Az miRNS-nek testvérmásai (microRNA isoforms) is ismertek; ezek hosszukban, bázissorukban vagy mindkettőben és leginkább az 5’- vagy 3’-végen térnek el egymástól. Ennek alapján ötféle miRNS-eket különböztetünk meg:
▪ törzs miRNS-ek canonical microRNAs;
▪ 5’-végi testvérmás miRNS-ek 5′ isomiRs;
▪ 3’-végi testvérmás miRNS-ek 3′ isomiRs;
▪ sokalakú testvérmás miRNS-ek polymorphic isomiRs;
▪ vegyes testvérmás RNS-ek mixed type isomiRs.
mRNS →hírvivő RNS
ncRNA (ncRNS) →nem kódoló RNS
nem kódoló RNS ncRNA, noncoding RNA olyan RNS-ek csoportja, amelyek nem kódolnak fehérjét. Az RNS-ek messze nagy többsége ilyen; csak egy töredékük fehérjeképző. A sejttörténések, mint a kromatin szerveződése, átrendeződés, az átírás, az átfordítódás és jelzések befolyásolása, felbecsülhetetlen összehangolója.
A nem kódoló RNS-ek többsége kicsi (→siRNS, miRNS). Néhányuk 200 nukleotidnál hosszabb, ezeket hosszú nem kódoló RNS-eknek (lncRNA, long noncoding RNA, lncRNS) nevezzük. Szintén szerepük van sejtműködésekben, mint átírásszabályozás, sejtelkülönülés stb. Károsodásuk betegségekkel függ össze.
piRNS (Piwi fehérje-RNS) piwi-interacting RNA, piRNA egyszálú, 23–30 nukleotid hosszú RNS; a kis közbeavatkozó RNS-ek közül a legnagyobb; a piRNS géncsoportosulások (piRNA clusters) terméke. Ezeket a géneket az RNS-polimeráz-II írja át; hosszú folytonos egyszálú RNS (ssRNA; single strand) keletkezik. Ez kerül a sejtplazmába, ahol RNáz hasítja piRNS-sé, vagy a már meglévő piRNS-t tartalmazó RISC (piRISC) köti bázispárosodással, és hasítja annak megfelelően.
Mindkét folyamatban 5’-monofoszfát közbenső piRNS (5’ monophosphate piRNA intermediate) képződik, amelyik hosszabb az érett piRNS-nél, és kapcsolódik PIWI fehérjével; ez alakítja érett piRNS-sé (→RISC).
Három alcsaládja ismert: a rasiRNS, a crasiRNS és a tel-sRNS – tevékenységük csak részben ismert.
rasiRNS (repeat-associated small interfering RNAs, rasiRNA) a férfi ivarsejtekben szabályozza az ugrálatok (transposons) és a visszugrálatok (retrotransposons) sokaságát.
crasiRNS (centromere repeat associated small interfering RNA) középrész-RNS* a kromoszómák középrészének ismétleteiről íródnak át, tevékenységük alig ismert.
telsRNS (telomere-specific small RNA, tel-sRNA) végrész-RNS* a kromoszómák végeinek, a végrészismétleteknek az átíródásából keletkező kis RNS (végrészátíratok, telomeric transcripts). A tel-sRNS-eket az ébrényi (embryonal) őssejtekben fedezték fel. Szerepük kevéssé ismert, bizonyára a végrészek kromatinjának szervezésében vesznek részt.
Az emberben a piRNS csak piRISC formájában van jelen. A piRNS-ek működésének megismerése további vizsgálatokat igényel. Jellegzetes, hogy a heterokromatikus területeken vannak jelen, feltehetően a heterokromatkus részek alapvető szabályozói. (→RISC)
RNS-állomány transcriptome (transzkriptom) a sejt RNS-einek összessége; a DNS bármely részéről
átíródott RNS. Nemcsak a különböző sejtek RNS-állománya eltérő, de egyetlen
sejté is folyamatosan változik.
RNS-fehérjék (ribonukleoproteinek) ribonucleoproteins az RNS-t tartalmazó fehérjék (RNA-binding protein, RBP) összefoglaló neve. Közéjük tartoznak az RNS-enzimek is.
RNS–fehérje képződmények ribonucleoprotein particles, RNPs az RNS-fehérjékhez kapcsolódó más fehérjékkel keletkező együttesei. Az RNS–fehérje képződményeket rendszerint a bennük lévő fehérjékről nevezik el.
RNS-felismerő mintázat* RNA Recognition Motif, RRM (→RNS-kötő gomolyok)
RNS-kötő fehérjék RNA-binding proteins, RBPs az egyszálú (single strand RNA, ssRNA) és a kétszálú RNS-hez (double strand RNA, dsRNA) kapcsolódó fehérjék nagycsaládja; több fehérjecsaládból áll. ~500 gén képezi őket; a génállomány ~10%-a kódolja. Az RNS-kötő fehérjék többsége a sejtmagban található, de a plazmában is szép számmal vannak, rendre az RNS-ekhez kötődve.
Az RNS-kötő fehérjék többségében RNS-kötő gomoly (RNA binding domain, RBD) van; egy-egyben több is; ez teszi lehetővé a cél RNS pontos azonosítását, ami a mintázatok és a térszerkezeti jellemzők alapján valósul meg. Sokban van olyan gomoly is, amelyik ugyan nem kötődik az RNS-hez, de szerepe van a kötődésben – ezek az RNS-kötő álgomolyok (pseudo-RBD). Szép számmal ismert azonban olyan RNS-kötő fehérje is, amelyben nincs RNS-kötő gomoly, mégis képes kapcsolódni az RNS-sel. Pl. az α-ösztrogénjelfogó (ERα) az mRNS-ek sokaságával kapcsolódhat. Az RNS-kötő gomoly nélküli RNS-sel társuló fehérjéket noncanonical RNA-binding proteineknek nevezik. Az RNS-kötő fehérjéket az RNS-kötő gomolyok szerint is osztályozzák. (→argonaute fehérjecsalád, DEAD doboz fehérjecsalád, DGCR8, DICER1, droshaegyüttes, drosha enzim, ribonukleáz-3, hnRNP, SR fehérjék, TRBP2)
Az RNS-kötő fehérjék:
▪ A kódoló és nem kódoló RNS-ekhez kapcsolódva szabályozzák a génkifejeződést, annak minden szintjén: átírás, kivágás, módosítás, szállítás, elhelyezkedés, rögzítés, lebontás; átfordítás. Az RNS-eket szabályozó tevékenységük sokrétű: ennek alapján osztályozzák is őket, megkülönböztetve az RNS képzésében, módosításában, szállításában, lebontásában stb. résztvevőket.
▪ Élénk kölcsönhatásban vannak más fehérjékkel és fehérjeössztesekkel is. Számos, az RNS-ekhez kötött sejtfolyamatban vesznek részt. A törzsfejlődés során változó formák jöttek létre a gének összetettebbé válásával (a köztesek számának növekedésével) párhuzamosan, lehetővé téve új fehérjék keletkezését.
Az RNS-kötő fehérjék hibái, rendellenes működésük sokféle betegség, köztük a rákok kialakulását okozhatja.
mintázati RNS-kötő fehérjék* RNA binding motif proteins, RBM olyan külön névvel illetett RNS-kötő fehérjék, amelyekben RNS-felismerő mintázat, RNS-kötő gomoly és ribonuklein-fehérjékre jellemző mintázatok vannak. Az RNS kialakítási és szabályozási folyamataiban vesznek részt. Sokféle ismert, ezeket számozással: RBM1, RBM2 stb. jelölik. Hibáik gyakoriak a különböző rákokban.
RNS-kötő gomolyok* RNA binding domains, RBD az RNS-t célzottan azonosító, általában valamilyen, RNS-t felismerő mintázatot tartalmazó gomolyok. Ezek kötődnek célzottan az RNS-sel. Egyesek az RNS néhány bázisnyi részét, mások szerkezeti elemeket ismernek fel. A néhány bázisnyit azonosítók általában nem fajlagosak, ezért belőlük több van a fehérjében, együttesen biztosítják a fajlagosságot.
Az RNS-kötő/felismerő gomoly, illetve RNS-felismerő/kötő mintázat elnevezések használata messze nem egységes a nemzetközi irodalomban, sőt előfordul, hogy ugyanazt gomolynak és mintázatnak is nevezik; a kettőt felcserélve használják. Ezért a gomoly és a mintázat megkülönböztetése ebben az összefüggésben nem lehetséges.
Hozzávetőlegesen 50-féle RNS-kötő gomoly ismert; a leggyakrabban előfordulók:
▪ RNS-felismerő mintázat (RNA-recognition motif, RRM). (Egyéb elnevezési: ribonucleoprotein [RNP] motif, RNP-type RNA-binding domain [RBD], RNP domain) ~80 aminosav-maradékból áll; két ellentétes négyszálas β-lemez és az ezeket összekötő két α-csavarodás alkotja, β-α-β-β-α-β szerkezetű. A két középső β-szálban két törzsökös bázismintázat, az RNP1 (nyolcbázisos) és az RNP2 (hatbázisos) található. Az RNS-kötő fehérjék többségében fellelhető; egyszálú RNS-sel kapcsolódik.
▪ Kétszálú RNS-t kötő gomoly (double strand RNA binding domain, dsRBD) rövid bázismintázat, ~70 aminosav-maradékból áll. Egy ellentétes háromszálú β-lemez és egy-egy C-, ill. N-végi α-csavarodás alkotja. Sokféle eltérő tevékenységű fehérjében fordul elő, jóformán csak a kétszálú RNS-hez kötődik – az egyszálúhoz nem, és a DNS-hez sem.
▪ KH gomoly (K homology sequence domain) a hnRNPk fehérjében azonosították. Két rövid bázismintázat, mindegyik ~70 aminosav-maradékból áll és egy ellentétes háromszálú β-lemezből, valamint három α-csavarodásból tevődik össze β-α-α-β-β-α szerkezetben. Több mint százféle fehérjében fordul elő.
RNS-kötő álgomolyok pseudo-RBD olyan gomolyok, amelyek nem kötődnek az RNS-hez, de van szerepük a fehérje–RNS kapcsolódásban.
RNS-kötő/azonosító mintázatok (→RNS-kötő gomolyok)
RNS-közbeavatkozás, RNSi* RNA interference, RNAi (egyéb elnevezések: co-suppression, post-transcriptional gene silencing [PTGS], quelling) a génkifejeződés (génátírás vagy az mRNS-ek átfordítódásának) gátlása fajlagos bázispárosodással kapcsolódó kis közbeavatkozó RNS-ek által. A génfékezés és az mRNS-gátlás folyamatát foglalja magában; a kettő közös elnevezése. A közbeavatkozás vonatkozhat egyetlen génre, géncsoportokra, önző genetikai elemekre* (selfish genetic elements/material).
Az RNSi, vagyis az RNS-közbeavatkozás a génműködés életfontosságú szabályozója: az alapvető sejtfolyamatok – sejtburjánzás, sejtelkülönülés, szervezeti egyensúlyállapot (homeostasis) – génjeinek a működése is ekként szabályozódik. Elengedhetetlen az idegen RNS-ek (vírusok) elleni védekezésben; az idegen mRNS-ek lebontásával jár. A célzott kezelések ígéretes formája, pl. a daganatsejtek mRNS-ei fajlagosan támadhatók a bázispárosodással való kötődés miatt.
génfékezés* a génátírás közvetlen szabályozási módja: megakadályozza a génátíródást (transcriptional gene silencing, TGS), rendre átmenetileg. Veleje: a kis közbeavatkozó RNS – az emberi sejtekben meghatározóan az siRNS – bázispárosodással (base-pairing) kötődik a DNS-nek valamely gén átíródását gátló bázissorához. Ez a bázissor általában a génben van, leginkább az indító területén, de lehet a köztesben, sőt a képezőben is; avagy a DNS más részén. A fékezés többféleképpen jöhet létre, pl. a kapcsolódott RNS gátolja a polimeráz továbbjutását, szabályozhatja a DNS és a kromatin metilezését, a kromatin módosulás.
mRNS-gátlás a génkifejeződés lényeges szabályozási folyamata a sejtplazmában. Főleg az miRNS/siRNS a RISC részeként bázispárosodással kötődik az mRNS-hez, és azt hasítja, vagy csupán az átfordítását gátolja. Az mRNS gátlása visszahat: a génátíródást követően csillapítja a gént (post transcriptional gene silencing, PTGS), szokásosan tartósan. (→RISC)
RNS-polimeráz RNA polymerase, RNAP (POL) az RNS-t képző enzim. Két alapformája a DNS-függő és az RNS-függő RNS-polimeráz. Az előbbi a DNS-t, az utóbbi az RNS-t használja mintafelületnek.
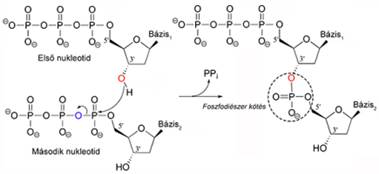 DNS-függő RNS-polimeráz DNA dependent/directed RNA polymerase, DdRP DNS-ről RNS-t képző enzim; egyszálú DNS-t másol, az
átírt nukleotidokat köti össze foszfodiészter-kötéssel. Képes összekapcsolni az
első nukleotidot a másodikkal, miként a továbbiakat is; tevékenységéhez tehát
nem szükséges indítószál (primer).
DNS-függő RNS-polimeráz DNA dependent/directed RNA polymerase, DdRP DNS-ről RNS-t képző enzim; egyszálú DNS-t másol, az
átírt nukleotidokat köti össze foszfodiészter-kötéssel. Képes összekapcsolni az
első nukleotidot a másodikkal, miként a továbbiakat is; tevékenységéhez tehát
nem szükséges indítószál (primer).
A másolódott nukleotid 5’-végén trifoszfát, 3’-végén OH-csoport van. A polimeráz ezeket kapcsolja össze. Az ábra az elsőként és másodikként másolódott nukleotidot mutatja. A második trifoszfátjából két foszfor (pirofoszfát) hasad le; így jön létre a kötés. Az elsőn megmarad a trifoszfát.
A DNS-hez az átírásfehérjék toborozzák a polimerázt; önmagában nem képes a bázissorok megkülönböztetésére. Nincs nukleáz működése, ezért az RNS-képződés esetleges hibáit nem javítja ki. Ennek azonban nincs nagy jelentősége, mert általában egyszerre nagyon sok szabályos RNS is képződik, és így egy-két hibás RNS hatása gyakorlatilag nem jut kifejezésre. Ám, ha sok a hibás RNS, sejtműködési zavar keletkezik.
A DNS-függő RNS-polimerázoknak többegységes és egyegységes formája is van; szokványosan az előbbieket nevezzük egyszerűen RNS-polimerázoknak. Az emberi sejtekben az egyegységes forma az energiatestecsekben, a többegységes a sejtmagban fordul elő. Az utóbbinak három formája ismert, az RNS-polimeráz-I, -II, -III. Ezek laboratóriumi megkülönböztetésére a gyilkos galóca mérgét (α-amanitin) használják: a méreg az RNS-polimeráz-II-t megbénítja, az RNS-polimeráz-III-at csak részben gátolja, az RNS-polimeráz-I-et pedig egyáltalán nem. Az mRNS-t csak az RNS-polimeráz-II írja át.
Egyegységes RNS-polimeráz single-subunit RNA polymerase (Egyéb nevek: ssDdRP, POLRMT, T7 RNS-polimeráz) a baktériumokat támadó bizonyos vírusok (phage 7) jellegzetes polimeráza, az emberi sejtekben az energiatestecsekben van jelen. Az energiatestecsi DNS-t írja át járulékos átírásfehérjék (TFAM, TFB2M) segítségével. Főleg az energiaigényes szövetekben (szív, agy, vese) van jelentősége: ezekben az RNS-ek 10–30%-át ezek adják. Átírási hiba zavart kelthet az energiatestecsek működésében.
Többegységes RNS-polimerázok multiple-subunit RNA polymerases
▪ RNS-polimeráz-I (RNA polímerase I, RNAP I) a sejtmagvacskában található, a 47S elő-rRNS-t képezi, amely 18S, 5,8S és a 28S rRNS-ekké alakul. Ezek és a polimeráz-III által másolt 5S RNS alkotja a ribotestecs RNS összetevőjét. A polimeáz-I kizárólag az rRNS-gének (multicopy rRNA genes) átírására képes enzim, és az átírások ~70%-át végzi. Szabálytalan működése rák és rRNS-ártalmak kialakulásához vezet. A rákelleni kezelés egyik célfehérjéje is lehet.
▪ RNS-polimeráz-II (RNA polimeráz II, RNAP II) az elő-mRNS-t átíró enzim, de másol kis magi RNS-eket is (pl. piRNS). Az emberi polimeráz-II 12 törzsökös alegységből (RPB1–12) álló, 550 kDa tömegű fehérje. A sarkalló törzsegysége mellett a legnagyobb alegysége a CTD gomolyt (carboxi terminal domain) tartalmazó RBP1, amely a C-végen lévő enzim. A POLR2A gén kódolja. Ez kapcsolja össze az RNS átíródásának és érésének folyamatát, fontos szerepe van az átírás indításában is. Jellegzetes a hetes (Tyr1, Ser2, Pro3, Thr4, Ser5, Pro6, Ser7) ismétletekből álló mintázata; ez érzékeli a jelzéseket, és elősegíti a fehérjék kötődését a hisztonok módosítására. Csak az átírásfehérjét kötött indítóhoz kétes kapcsolódni. (→indító)
▪ RNS-polimeráz-III a szállító RNS (tRNS) és a kis sejtmagi RNS-ek (snRNS) többségét képezi, elemi tartozéka az RNS-szikének.
RNS-függő RNS-polimeráz RNA dependent/directed RNA polymerase, RdRP, RNA-replicase RNS-t RNS-ről, nem DNS-ről átíró enzim. RNS-mintafelületről készíti annak kiegészítő másolatát. Így sokszorozódnak az RNS-vírusok, de előfordul magsejtűekben is (cellular RdRP, cRdRP).
RNS-szerkezet A ribonukleinsav egyszálú láncvegyület; ribózból (öt szénatomos szénhidrát), négyféle nitrogéntartalmú bázisból (adenin, citozin, guanin, uracil) és foszfátcsoportokból álló nukleotidtöbbes.
■ Az elsődleges szerkezet lényegében azonos a DNS szerkezetével, két különbséggel:
• Az RNS-szál gerincét 3’-, 5’-foszfodiészter-kötésesel kapcsolt D-ribózok képezik (a D-dezoxiribózok helyett), hozzájuk kötődnek a bázisok β-N-glikozidos-kötéssel.
• A másik eltérés az, hogy a timin helyett uracil van; az RNS purinbázisai tehát azonosak, a pirimidinbázisok azonban részben mások. Ritka bázisok – például dihidrouracil (DHU), pszeudouridin (Ψ), metilezett bázisok, és kivételesen timin – 10-15%-ban vesznek részt az RNS felépítésében. Ezek rendszerint az átíródást követő módosításokkal kerülnek bele. Az RNS-ben a purin- és pirimidinbázisok aránya tetszőleges, mert a molekula elsődlegesen egyszálú, nincsenek bázispárok.
Az 5’-végen rendszerint foszforilált guanin található.
■ Másodlagos szerkezet. A hosszabb RNS-ek gyakran elfordulnak, elhajlanak, és a bázisok között hidrogénkötések keletkeznek (önkiegészítő bázispárosodás), hosszabb-rövidebb szakaszain kétszálú szerkezet jön létre. Ez a másodlagos szerkezet. Az ilyen RNS-eket nevezzük kétszálú RNS-eknek. Ez alapvetően különbözik a DNS-től. A DNS-ben ugyanis két DNS-szál kapcsolódik össze, az RNS-ben pedig mindig csak egy szálnak egyes részei. Az így kialakult szerkezet RNS-enként nagyon eltérő, általában egy-egy RNS-fajtára jellemző.
RNS-szike* (közteskivágó*) spliceosome (történelmi neve: heterogeneous nuclear RNA, hnRNA) RNS–fehérje képződmény az elő-mRNS-en. Öt kis RNS-fehérjéből ( small nuclear ribo nucleo proteins, snRNPs) és több egyéb fehérjéből áll. Az snRNP-k uracilban gazdag kis RNS-t tartalmaznak – a nevük innen ered: U1, U2, U4, U5 és U6 snRNP. Az RNS-szike összetevői tétlenül különállnak, az egyes közteseken kapcsolódnak össze, és válnak tevékennyé; miközben számos más fehérje is kapcsolódik hozzájuk. Jellegzetes, hogy az RNS-szike változtatja összetevőit és szerkezetét a kivágás folyamatában. Több mint 200 fehérjével kapcsolódik. A legjelentősebbek az SR fehérjék (SRSF-ek) (elő-mRNS–mRNS átalakítás).
rRNS (ribotestecs-ribonukleinsav) ribosomal RNA, rRNA nem kódoló RNS, a ribotestecs alkotója. Ribozim, azaz enzimhatású, pl. észterkötéssel kapcsol össze aminosavakat. A ribotestecset alkotva tevékenykedik (→ribotestecs).
Az elsődleges szerkezetében szárhurkok keletkeznek bázispárosodással, hasonlóan a miRNSekhez; ezek teszik lehetővé a térszerkezet kialakulását, a fehérjék szoros kapcsolódását.
Az rRNS gének kódolják, amelyek fej–láb kapcsolódásban vannak a magvacskában, és a velük társuló fehérjékkel, valamint az általuk kódolt rRNS-ekkel együtt alkotják a magvacskát. A különféle sejtekben nem mindegyik rRNS gén tevékeny. A gént az RNS-polimeráz-1 írja át elsődleges rRNS-re (47S rRNS-átirat – az S az ülepítés Swedberg-egysége). Az átalakuló 47S rRNS-átiratból RNS-kivágással 28S, 18S és 5,8S rRNS keletkezik, amelyeket a kis ribonukleoptoteinek (small nucleolar ribonucleoproteins, snoRNPs) és egyéb alakítófehérjék (protein processing factor) formálnak 60S (~3000 nukleotid) és a 40S (~1800 nukleotid) nagyságúvá, a ribotestecs két alegységének megfelelően. A magvacskában a 60S és a 40S rRNS-ekhez szállítófehérjék kötődnek; így jutnak a sejtplazmába a ribotestecs kialakítására. Az rRNS a sejt RNS-einek 80%-át adja, mintegy 10 millió van egy sejtben.
scRNS ( small cytoplasmic RNA) kis sejtplazma-RNS a tevékenysége nem ismert; jellemzője, hogy a 3’-végen néhány uridin van, amelyet a polimeráz-III kapcsol.
siRNS (small interfering RNA, siRNA) kis közbeavatkozó RNS* (egyéb nevei: short interfering RNA, silencing RNA) 19–25 nukleotidból álló, kétszálú RNS. Az miRNS-re jellemző szárhurok nincs benne. Két egyszálú RNS párosodik; a szálak a 3’-végen túlnyúlnak két bázissal. Az egyik szál az irányítószál (guide strand, antisense strand) a másik a kísérőszál (passenger strand, sense strand). (→miRNS)
A sejtplazmába került hosszú kétszálú (egyenes vagy szárhurkot tartalmazó) RNS-ből a DICER hozza létre az érett siRNS-t, lehasítva a hosszú kétszálú RNS 3’-végét. Hasonlóan az miRNS-hez, kapcsolódik AGO-fehérjével, kialakítva a RISC-et. A társulás következtében szétválik a siRNS két szála; a kísérőszál lebomlik. Az irányító szál vezeti a RISC-et a kiegészítő bázispárok szerint azonosított mRNS-ekhez. Azokkal tökéletesen párosodik, ezért az siRISC mindig hasítja az mRNS-t.
A sejtplazmába kerülő hosszú kétszálú RNS-ek keletkezhetnek a sejtben (belső siRNS, endo-siRNA), de bekerülhetnek a sejtbe a sejt környezetében lévő hosszú kétszálú RNS-ek is (külső siRNS, exo-siRNA); pl. a vírus mRNS-ből létrejövő kétszálú RNS alakul siRNS-sé.
Hozzávetőleg 200-féle siRNS-t ismerünk. Az siRNS is a RISC tagjaként szabályoz. Az siRNS-t kiterjedten alkalmazzák a ráksejtek elpusztítása: egyszerűem beadható (kivált a belégzési kezelés ígéretes; az érbe adva az enzimek gyorsan bontják), a ráksejtek burjánzását előidéző géneket célzottan gátolja, nincs mellékhatása.
snoRNS ( small nucle olar RNA) (snoRNA) kis magvacska-RNS, a magvacskában lévő, 60–200 nukleotidból álló RNS, ~700-félét azonosítottak. Az rRNS-t, a siRNS-t, a tRNS-t, az snRNS-t és az mRNS-t is módosítják. Az siRNS-ben például bázisváltoztatást hoznak létre: az snoRNS kapcsolódik az siRNS megfelelő bázissorához, melyet a hozzákapcsolódó enzim módosít – más szóval irányítja az enzimet, ezért guide RNA-nek (gRNA) is nevezik.
Három csoportjuk van:
▪ a C/D dobozt tartalmazók metileznek a ribóz 2’-OH-csoportján,
▪ a H/ACA dobozt tartalmazók az uridint alakítják áluridinné (pseudo uridylation),
▪ Cajal-test-fajlagos RNS (scaRNS), amely a ribóz 2’-OH-csoportján metilezi az snRNS-t, és áluridinezi a Cajal-testet a magban.
Főleg a fehérjét és a nem fehérjét kódoló közteseiből származnak – ezeket a géneket kis snoRNS-t tartalmazó géneknek (SNHGs) nevezik.
Érett snoRNS-ek felbomlanak töredékekre, ezeket snoRNS-ből származó RNS-eknek (sdRNS, snoRNA-derived RNA) nevezik. Ezek tevékenyen részt vesznek a sejtanyagcserében. Egy részük nagyon hasonló az miRNS-ekhez. Vannak árva snoRNS-ek, sem rRNS-ekkel, sem tRNS-ekkel nem társulnak,
A hagyományos tevékenységükön kívül szabályozzák az átírást, valamint az átírás és az átfordítódás utáni módosulásokat. Végeredményben a sejtműködést sokoldalúan befolyásoló szabályozó molekulák.
Nem kevésbé jelentős a befolyásuk a rákképződésben; ebben ugyancsak sokoldalúan vesznek rész: keletkezés, burjánzás, szövetbetörés, sejtvégzet, áttétképződés, és még érzéketlenség kialakulásában is. Rendkívül sokrétű összefüggés a rákkal, célzott kezelések sokaságok támadáspontja lehet.
snRNS ( small nuclear RNA) (snRNA) kis sejtmagi RNS* a sejtmagban, sok a Cajal-testben található. ~150 nukleozid nagyságú RNS. Az snRNS-ek részt vesznek az elő-mRNS kialakításában (heterogenous nuclear RNA, hnRNA), szabályozzák az átírásfehérjéket (például 7SK RNS) vagy az RNS-polimeráz-II-t (B2-RNS), és rögzítik a kromoszómák végrészeit. Mindig sajátos fehérjékkel kötődnek, összteseket képezve: snRNPs (small nuclear ribonucleoproteins). Ezekben egy snRNS összetevő és több kis snRNS-fajlagos fehérje van. Ilyen például a magban lévő sm fehérje. Az RNS-polimeráz-II és -III írja át őket
Lényegében az U1, U2, U3, U4, U5 és U6 RNS-szike (spliceosome) tartozik közéjük.
A két kis magi RNS, az snRNS és az snoRNS tevékenysége nagyon sokban hasonló, alapvetően az átírás és a keletező RNS szabályozása körül forog. A lényegi különbség a kettő között, hogy az snRNS részt vesz a közteskivágásban. Az snoRNS főleg az rRNS, tRNS, mRNS válzatainak némításában lényeges. A kettő más, nem is tartoznak egy csoportba. (→snoRNS)
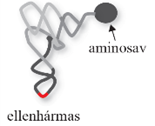
szállító RNS, tRNS transfer RNA, tRNA kis, 75–90 nukleotidból álló, jellegzetes – a fajokban többé-kevésbé azonos – szerkezetű ribonukleinsav; a keletkező polipeptidlánc és az átfordítódó mRNS közötti kapocs: az aminosavat szállítja a fehérjeképző rendszerhez, a ribotestecshez. Két működési egysége van: az ellenhármas (anticodon), amely 3 bázisból áll, és az mRNS kiegészítő bázishármasával társul, biztosítva, hogy a megfelelő aminosav kerül a fehérjébe; valamint az aminosavat kapcsoló rész.
Sok száz tRNS gén ismert; a DNS-ben szétszórva helyezkednek el, csak a 22-es és az Y-kromoszómán nincs. Nem mindegyik tRNS gén tevékeny. 22 tRNS gén a mitokondriumokban…… is található. Az átíródást a TF3B és TF3C indítja, és az RNS-polimeráz-3 végzi.
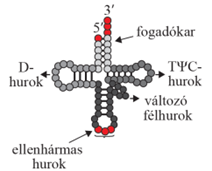 elő-tRNS a génekről egyszálú elő-tRNS másolódik, amelyben hidrogénkötésekkel
bázispárok keletkeznek. A hidrogénhidak állandósítják a molekulát, és
párhuzamosan rendezett kettős szálú szakaszokat alakítanak ki. A kétszálú
szakaszok között négy egyszálú hurok formálódik. A hurkok a nem kiegészítő
bázisok szembekerülésével jönnek létre: ezekhez ugyanis nem kapcsolódnak
hidrogénkötések, ezért nem alakul ki a kettős szál. A nem kiegészítő (adenin,
guanin és citozin) bázisok között keletkező kölcsönhatások (London-féle erők
stb.) alakítják az egyenes vonalú nukleotidsort hurok alakúvá. Lóhere alakú
szerkezet keletkezik, amelyből kivágásokkal – hasonlóan, mint az elő-mRNS–mRNS
átalakulásnál – jön létre a másodlagos szerkezetű tRNS. Ez a folyamat az
átíródáskor és rögtön utána megy végbe.
elő-tRNS a génekről egyszálú elő-tRNS másolódik, amelyben hidrogénkötésekkel
bázispárok keletkeznek. A hidrogénhidak állandósítják a molekulát, és
párhuzamosan rendezett kettős szálú szakaszokat alakítanak ki. A kétszálú
szakaszok között négy egyszálú hurok formálódik. A hurkok a nem kiegészítő
bázisok szembekerülésével jönnek létre: ezekhez ugyanis nem kapcsolódnak
hidrogénkötések, ezért nem alakul ki a kettős szál. A nem kiegészítő (adenin,
guanin és citozin) bázisok között keletkező kölcsönhatások (London-féle erők
stb.) alakítják az egyenes vonalú nukleotidsort hurok alakúvá. Lóhere alakú
szerkezet keletkezik, amelyből kivágásokkal – hasonlóan, mint az elő-mRNS–mRNS
átalakulásnál – jön létre a másodlagos szerkezetű tRNS. Ez a folyamat az
átíródáskor és rögtön utána megy végbe.
másodlagos szerkezetű tRNS lóhere alakú képlet, négy hurkot alakít ki, páros és páratlan karokkal összekapcsolva. Megkülönböztetünk D-hurkot (DHU-hurok; D-loop), TΨC-hurkot (TΨC loop), ellenhármas* hurkot (anticodon loop), és egy kisebb, változó alakú (fél) hurok (variable loop) is előfordul, amelyet változó többletkarnak/-huroknak is nevezünk – ez a páratlan kar; nincs mindegyik tRNS-ben. A hurkok elnevezése a bennük lévő módosított nukleotidok szerint (D-hurokban dihidro-uridin van, ezért DHU-huroknak is nevezik; a TΨC-hurkban pedig pszeudouridin [Ψ]). A páros karokat a hozzájuk tartozó hurkok szerint D-, TΨC- és ellenhármas karnak nevezzük. A 3’-végét a fogadókar (aminosav kar) alkotja a CCA-végződéssel (pirossal jelölve) és egy szabad hidroxil (OH) csoporttal, melyhez a szállítandó aminosav kapcsolódik, az 5’-végen pedig foszfátcsoport van. Az ellenhármas hurok alsó bázishármasa (pirossal jelölve) az mRNS valamelyik bázishármasainak a megfelelője, ellentétes bázishármasa (anti-codon), egyszerűen ellenhármas.
 érett tRNS A másodlagos szerkezetű tRNS a sejtplazmában tömörödik (base-stacking) a
fogadókar és a TΨC-hurok között, illetőleg a D-hurok és az ellenhármas kar
között; L formájú lesz. Ez a tRNS harmadlagos szerkezete, amely
meglehetősen állékony. A harmadlagos szerkezet a nukleozidok módosulásával
(metil-guanozin [mG]; áluridin
[pseudouridine, ψ]),) jön létre; amit a
tRNS-módosító enzimek (tRNA-modifying enzymes,
tRNAmods) végeznek. A harmadlagos szerkezetű tRNS-t nevezzük érett tRNS-nek. Az
aminosav a tRNS3-véghez kapcsolódik, az ellenhármas pedig az mRNS illeszkedő
bázisaival társul.(Az ábrákat Balla Éva készítette.)
érett tRNS A másodlagos szerkezetű tRNS a sejtplazmában tömörödik (base-stacking) a
fogadókar és a TΨC-hurok között, illetőleg a D-hurok és az ellenhármas kar
között; L formájú lesz. Ez a tRNS harmadlagos szerkezete, amely
meglehetősen állékony. A harmadlagos szerkezet a nukleozidok módosulásával
(metil-guanozin [mG]; áluridin
[pseudouridine, ψ]),) jön létre; amit a
tRNS-módosító enzimek (tRNA-modifying enzymes,
tRNAmods) végeznek. A harmadlagos szerkezetű tRNS-t nevezzük érett tRNS-nek. Az
aminosav a tRNS3-véghez kapcsolódik, az ellenhármas pedig az mRNS illeszkedő
bázisaival társul.(Az ábrákat Balla Éva készítette.)
A nukleozidok átalakulása és a következményes harmadlagos szerkezet meghatározó, mert biztosítja a tRNS állékonyságát a sejtplazmában, továbbá, mert a tRNS csak így juthat a ribotestecsbe (ribosome), és kötődhet az aminoacil-tRNS-szintetázzal; az enzim ugyanis a térszerkezet egyes elemei alapján azonosítja a megfelelő tRNS-t. Ha a nukleozidok módosítása nem megfelelő, a tRNS rendre lebomlik. Megmaradása betegségeket (köztük rákot is) okozhat; kivált az ellenhármas zavara veszélyes.
Mivel a bázishármasok 64 változatban fordulhatnak elő, várható, hogy az mRNS-hez is 64 különböző tRNS társuljon. A valóságban azonban kevesebb, az emberi sejtekben 48-féle tRNS keletkezik. A hiányzó hármas párosodás a lötyögő párosodással oldódik meg. Ez azt jelenti, hogy egy-egy tRNS akkor is kapcsolódhat az ellenhármassal, ha csak az első két bázisuk kiegészítője egymásnak.
telomeráz-RNS, TERC telomerase RNA component (egyéb nevek: lncRNA, TR, TER) hosszú – 451 nukleotidból álló – nem fehérjeképző RNS; a telomeráz összetevője. A TERC gén kódolja, amely a 3-as kromoszóma hosszú karján (3q26.2) van. Hosszabb RNS-ből 4 ribonukleoprotein (diszkerin, GAR1, NHP2 és NOP109 közreműködésével válik éretté. Hossza a különböző fajokban jelentősen más, de a szerkezetük egyforma. Négy alapeleme van: az UCCCAAUC mintázat (template, pseudo knot domain); aCR4–CR5 (CR4/CR5) szakasz; aH/ACA doboz és a CR7 szakasz. A telomeráz fonák átíróenzime (reverse transcriptase), a TERT, a mintázathoz és a CR4–CR5 szakaszhoz kapcsolódik. A H/ACA doboz kapcsolja a 4 ribonukleoproteint. A TCAB1 dajkafehérje köti össze a diszkerint a CR7 szakasszal, kialakítva a telomerázt a Cajal-testben, és helyezi a telomerázt a végrészhez.
A TERC részben a telomeráz összetevőjeként tevékenykedik: a másoláshoz szolgál mintázatként. Másrészt a telomeráztól függetlenül – csupán a 4 ribonukleinnel kapcsolódva – is vigyázza a végrészt: elégtelensége, pl. a TERC gén hibájából adódóan, súlyos örökletes betegségeket okoz: dyskeratosis congenita (DC), aplastic anemia, idiopathic pulmonary fibrosis (IPF). Továbbá, serkenti a DNS-hibák ATR-függő javítását, védi a CD4+-T-sejteket a sejtvégzettől.
Fokozott a TERC-szint a telomerázpozitív ráksejtekben, de előfordul, hogy a telomeráznegatívokban is, utalva arra, hogy ezekben a rákokban a TERC az ATR-függő hibajavítás serkentésével védi a végrészt, biztosítja az osztódó ráksejtek megmaradását.
Kórjóslati jelentősége van a TERC gének másolatszámának a rákokban, pl. azok a hámbeli rákelőző állapotok, amelyekben kettőnél több másolat van, szokásosan rákká alakulnak, a többi rendszerint visszafejlődik. (→telomeráz)
TERRA (végrészismétleteket tartalmazó RNS*, telomeric repeat-containing RNA) törzsökös RNS, meghatározó szerepe van a végrész hosszának és kromatinjának szabályozásában, valamint a végrész kettőződésében. A végrész kódolja. Változóan, 100 bázistól 9 kb-ig terjedő hosszúságú és UUAGGG ismétletek tartalmazó RNS. Tehát guaninban gazdag RNS, amely – hasonlóan a végrész túlnyúlásához – gyakran képez önmagában is G-négyeseket, de elősegítik az R-hurkok keletkezését is.
A TERRA:
▪ Sajátosan kötődik a végrészhez: a túlnyúlás G-négyesei és a TERRA G-négyesei alakítanak ki molekulaközi kapcsolódást, DNS–RNS felemás G-négyes* képződmények (DNA RNA hybrid GQ, HGQ) jönnek létre, kivált a túlnyúlás 3’-végén. Ezek a felemás G-négyesek a 3’-végen akadályozzák a túlnyúláshoz való hozzáférést, a telomerázok és más fehérjék kötődését.
A túlnyúláshoz kötődve R-hurkok keletkezhetnek, amelyek háromszálas felemás DNS–RNS szerkezetek.
▪ Képződése összefügg a sejtkörrel (keletkezik a G1- és G2-szakaszban, az S-szakaszban viszont nem) és a kromoszómák állapotával. Ha a végrész rövidül, vagy nem működik megfelelően, a TERRA tevékenysége fokozódik. A végrész túlrövidülésekor vagy a DNS károsodásakor jelzéseket is küld, toboroz kromatinmódosítókat (LSD1 [lizin-demetiláz-1], SUV39H1 [hiszton-3-lizin-9-metiláz]).
▪ Tevékenyen részt vesz a végrészek védelmében, működésében. Szabályozza a végrész hosszát a telomerázok, az exonukleáz-1 féken tartásával, az ALT (alternative lengthening of telomeres) sejtekben pedig az átrendeződés elősegítésével. Óvja a védletet is; kötődnek a POT1–TPP1 kettőshöz.
Az ez idáig nem kódolónak tartott végrész-RNS-ről kiderült, hogy átíródik, a polimeráz-II írja át, valin–arginin vagy glicin–leucin ismétleteket tartalmazó fehérjék keletkeznek RAN átfordítódással. (→RAN átfordítódás) Az olvasókerete kezdő bázishármas (ATG) nélkül fordítódik át. Ezek a fehérjék hatással vannak a sejtek működésére, valószínűleg károsak, de a részletek tisztázatlanok.
törlő miRNS microRNA (miRNA) sponge egymást követő miRNS-válaszelemeket tartalmazó RNS molekula, amely képes az miRNS-t elválasztani az mRNS-től, megakadályozva az miRNS szabályozó hatását.
tRNS (szállító RNS) transfer RNA (→RNS, szállító RNS)
TXIST RNS (→XIST RNS)
végrész-RNS*, TERRA telomeric repeat-containing RNA, TERRA változóan, 100 bázistól 9 kb-ig terjedő hosszúságú és UUAGGG ismétletek tartalmazó RNS. Tehát guaninban gazdag RNS, amely – hasonlóan a végrész túlnyúlásához – gyakran képez G-négyeseket, de elősegítik az R-hurkok képződését is.
A végrész-RNS-ek:
▪ Sajátosan kötődnek a végrészhez: a túlnyúlás G-négyesei és a végrész-RNS G-négyesei alakítanak ki molekulaközi kapcsolódást, DNS–RNS felemás G-négyes* képződmények (DNA RNA hybrid GQ, HGQ) keletkeznek, kivált a túlnyúlás 3’-végén. Ezek a felemás G-négyesek a 3’-végen akadályozzák a túlnyúláshoz való hozzáférést, a telomerázok és más fehérjék kötődését.
A túlnyúláshoz kötődve R-hurkok keletkezhetnek, amelyek háromszálas felemás DNS–RNS szerkezetek.
▪ Képződése összefügg a sejtkörrel (kifejeződnek a G1- és G2-szakaszban, az S-szakaszban viszont nem keletkeznek) és a kromoszómák állapotával. Ha a végrész rövidül, vagy nem működik megfelelően, tevékenységük fokozódik. A végrész túlrövidülésekor vagy a DNS károsodásakor jelzéseket is küldenek, felgyülemlenek, toboroznak kromatinmódosítókat (LSD1 [lizin-demetiláz-1], SUV39H1 [hiszton-3-lizin-9-metiláz]).
▪ Tevékenyen részt vesznek a végrészek védelmében, működésében. Szabályozzák a végrész hosszát a telomerázok, az exonukleáz-1 féken tartásával, az ALT (alternative lengthening of telomeres) sejtekben pedig az átrendeződés elősegítésével. Óvják a védletet is; kötődnek a POT1–TPP1 kettőshöz.
Az ez idáig nem kódolónak tartott végrész-RNS-ről kiderült, hogy átíródik, az RNS polimeráz-II írja át, valin–arginin vagy glicin–leucin ismétleteket tartalmazó fehérjék keletkeznek RAN átfordítódással. (→RAN átfordítódás) Az olvasókerete kezdő bázishármas (ATG) nélkül fordítódik át. Ezek a fehérjék hatással vannak a sejtek működésére, valószínűleg károsak, de a részletek tisztázatlanok.
XIST (X-inactive specific transcript) 19 kb hosszú nem kódoló RNS (lncRNS), az XIST gén képezi. A XIST RNS kizárólag a sejtmagban van, csak az elnémuló X-kromoszóma kódolja, és csak ahhoz kötődik, a másik X-kromoszómához nem kapcsolódik. A néma X-kromoszómát mintegy burkolja; állványként szolgál, nagyon sokféle kromatinmódosító fehérjét toboroz. Több ismétletet tartalmaz, amelyeket A–F betűkkel jelölünk; ezek kapcsolják a toborzott fehérjéket. Pl. az 5’-végen lévő A-ismétlet a SPEN géngátló fehérjét, a SPON gomoly a NCOR-HDAC3 társgéngátlót, a hnRNPk-t pedig a B- és C-ismétlet.
A XIST gén az X-kromoszóma némítási központjában (X inactivation center, XIC) helyezkedik el, az FTX, JPX és RLIM gén serkenti, a TSIX gén gátolja. A serkentő, gátló hatás génközelség* következménye, nem pedig a gének által kódolt lncRNS-ek hatása. A közelséghatás* csak akkor érvényesül, amikor a serkentő, gátló gén átíródik; azaz XIST átíródásához az FTX vagy a JPX és/vagy a RLIM gén átíródása szükséges, illetve az, hogy TSIX gén tevőtlen legyen. Amikor a TSIX gén íródik át, a XIST gén néma; ez az X-kromoszóma némításának az alapvető szabályozása.
A TSIX RNS bázissora egyezik a XSIT mintaszálának bázissorával (antisense); és ezt a betűk sorrendje is kifejezi: a TSIX a XIST hátulról olvasva. A TSIX RNS szintén hosszú (40 kb) nem kódoló RNS, és szintén csak arra a kromoszómára hat, amelyben képződik; vagyis a némuló X-kromoszómában. Ugyanaz a gén kódolja, csak fordított átírással. A kétféle RNS kódolása fordított viszonyban van: ha TSIX képződése csökken, fokozódik a XIST RNS kódolása, és ez vezet a kromoszóma némításához. A TSIX fokozott kifejeződése viszont gátolja a XIST képződését.
Ismert, hogy sok betegség kialakulásában van nemi különbség. Az autoimmun betegségek 80%-a például nőkben fordul elő. Egyre több a bizonyíték, hogy ebben XIST alapvetően vesz részt.
Találatok alcímszavakban (2 szócikk):
DNS-polimeráz (POL) DNA polymerase DNS-t képező enzim. Megkülönböztetünk DNS-függő és RNS-függő DNS-polimerázt. Az előbbi a DNS-t, az utóbbi az RNS-t használja mintafelületként.
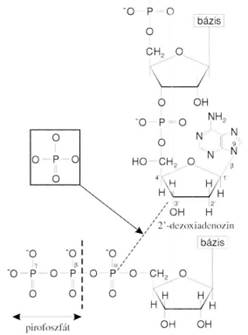 DNS-függő DNS-polimeráz DNA dependent DNA polymerase kettős
hatású: a nukleozid 5’-trifoszfát α-helyzetű foszfátját köti a nukleotidlánc
végét képező 3’-OH csoporthoz diészterkötéssel, másrészt 3’→ 5’ exonukleáz
hatású. Minden új nukleotid beépítése előtt ellenőrzi a legutolsót, és ha nem
megfelelő, kivágja, majd beépíti helyette a megfelelőt. A polimeráz csak a
3’-OH-csoporthoz képes kapcsolódni, egyébként nem tevékeny. A kapcsolódás tehát
5’→ 3’ irányú, fordítva (3’→ 5’ irányban) nem jön létre. Eközben a nukleozid
5-trifoszfát α és β jelzésű foszfátja közötti kötés vízelvonás mellett
felszakad, a β és γ jelzésű foszfátot tartalmazó pirofoszfát szabaddá válik. Az
emberi DNS-polimerázok mindig csak a már meglévő nukleotidlánchoz kapcsolnak
újabb nukleotidot, két szabad nukleotidot nem képesek összekötni. A báziskivágó
javításban a POLβ, POLδ/ε és a POLλ, a párhibajavításban a POLβ, POLε vesz
részt
DNS-függő DNS-polimeráz DNA dependent DNA polymerase kettős
hatású: a nukleozid 5’-trifoszfát α-helyzetű foszfátját köti a nukleotidlánc
végét képező 3’-OH csoporthoz diészterkötéssel, másrészt 3’→ 5’ exonukleáz
hatású. Minden új nukleotid beépítése előtt ellenőrzi a legutolsót, és ha nem
megfelelő, kivágja, majd beépíti helyette a megfelelőt. A polimeráz csak a
3’-OH-csoporthoz képes kapcsolódni, egyébként nem tevékeny. A kapcsolódás tehát
5’→ 3’ irányú, fordítva (3’→ 5’ irányban) nem jön létre. Eközben a nukleozid
5-trifoszfát α és β jelzésű foszfátja közötti kötés vízelvonás mellett
felszakad, a β és γ jelzésű foszfátot tartalmazó pirofoszfát szabaddá válik. Az
emberi DNS-polimerázok mindig csak a már meglévő nukleotidlánchoz kapcsolnak
újabb nukleotidot, két szabad nukleotidot nem képesek összekötni. A báziskivágó
javításban a POLβ, POLδ/ε és a POLλ, a párhibajavításban a POLβ, POLε vesz
részt
DNS-polimeráz-α (POLα) DNA polymerase alfa (DNA Pol α) a primáz enzimmel együttesen a késlekedő DNS-szál darabjait építi.
DNS-polimeráz-β (POLβ) DNA polymerase beta (DNA Pol β) a legkisebb polimeráz (39 kDa, 335 aminosav). Két gomolya van: a DNS-t képző polimeráz gomoly és a dezoxiribóz-foszfátot hasító liáz gomoly. Nincs benne a 3’→ 5’ keretolvasó exonukleáz. A polimeráz-X családba tartozik. Részt vesz a DNS-hiba báziskivágó javításában. (→DNS-hibák)
DNS-polimeráz-γ (POLγ) DNA polymerase gamma (DNA Pol γ) az energiatestecs (mitochondrion) DNS-ének képzésében vesz részt.
DNS-polimeráz-δ (POLδ) DNA polymerase delta (DNA Pol δ) negytagú enzimössztes: a DNS kettőződésében a vezetőszálat és a késlekedőszálat képezi. A négy alegysége a POL1, POL2, POL3 és a POL4, amelyeket a POL1, POL2, POL3, illetve a POL4 kódol.
DNS-polimeráz-ε (POLε) DNA polymerase epsilon (DNA Pol ε) törzsökös, négyegységes enzim, képezi a vezetőszálat, részt vesz a DNS-hiba báziskivágó javításában. (→DNS-hibák)
DNS-polimeráz-λ (POLλ) DNA polymerase lambda (DNA Pol λ) a DNS-hiba báziskivágó javításában vesz részt. (→DNS-hibák)
RNS-függő DNS-polimeráz RNA dependent DNA polímerase az RNS-ről képez DNS-t. Szokványos néven fordított transzkriptáz.
hasonmásság analogy a biológiában nem közös elődtől/őstől származó két vagy több hasonló szerv (pl. a madár és a darázs szárnya: mindkettő azonos feladatra szerveződött, de nem közös eredetű), molekula vagy azok részének viszonya. Az orvostudományban a hasonmásság fogalmát leginkább a nem közös eredetű, de többé-kevésbé hasonló feladatú és/vagy szerkezetű molekulákra vonatkoztatjuk. Általában környezeti hatásra, a környezethez való hatékonyabb alkalmazkodás érdekében, de egymástól függetlenül jöttek létre (convergent evolution).
hasonmás* (biológiai) analog olyan nem közös eredetű szerv, molekula stb., amely szerkezetében és/vagy tevékenységében igen hasonló. Közös feladatra szerveződött.
hasonmás fehérjék* analogous proteins (protein analogs) szerkezetében és vagy működésében hasonló, de más-más eredetű fehérjék. Ezeket nem közös eredetű gének kódolják. (→fehérje)
hasonmás gének* analogous genes (gene analogs) hasonló feladatú fehérjét kódoló, de nem közös őstől származó (nem azonos géncsaládba tartozó) gének. (→gén)
hasonmás RNS* analogous RNA kizárólag RNS örökítőanyagú vírusokban fordul elő. Nem közös őstől származó, hasonló tevékenységű RNS-ek.
hasonmás szervek* analogous/analog organs ugyanarra a feladatra szerveződött, de nem közös eredetű szervek, pl. a madarak és a méhek szárnya.
hasonmás vegyület* analog, analogous compound olyan vegyület, amely szerkezetében hasonlít egy másikhoz, de összetevőiben egy-két ponton különbözik: egy vagy több atom/hatócsoport más. Pl. hasonmás gyógyszerek (analog drugs): szerkezetükben hasonló, de vegyi és biológiai tulajdonságukban eltérnek. Ismerünk nukleotid hasonmásokat, ezek kicsit mások, mint a szokványos bázissorú nukleotidok, de képesek beépülni a DNS megfelelő részébe, viszont más kölcsönhatásokat létesítenek.
Részleges egyezések (14 szócikk):
aminoacil-tRNS-szintetáz aminoacyl-tRNA synthetase, aaRS vagy ARS (egyéb név: tRNS-ligáz) a tRNS-hez kapcsolja a hozzá tartozó aminosavat; a folyamatot tRNS-töltésnek (charging the RNA) vagy aminosavtevősítésnek (activating the amono acid) nevezik. Minden aminosavfajtának külön enzime van; így húszféle aminoacil-tRNS-szintetáz ismert; ezeket a kapcsolódó aminosavak szerint nevezünk, pl. metionin-tRNS-szintetáz, fenilalanin-tRNS-szintetáz. Mindegyik enzimben legalább két gomoly van: az N-végen a sarkallógomolya helyezkedik el; ez végzi a kapcsolódást: a tRNS C-végéhez köti az aminosavat. (→szállító RNS – aminosav kapcsolódás) A C-cégen található az ellenhármast kötő gomoly (anticodon binding domain). Néhány enzimnek hibajavító gomolya (vágógomolya) is van; ez ismeri fel a tévesen kötött aminosavat, és hasítja az észterkötését. Ahhoz, hogy megfelelő polipeptid képződjék, elengedhetetlen, hogy a tRNS a megfelelő aminosavat hordozza; a hiba előfordulása <1%. A sorkallógomoly jellegzetes mintázatú (Rossmann-hajték; Rossmann fold): öt párhuzamos, α-csavarral kapcsolt, β-lemezből áll.
A 20-féle aminoacil-tRNS-szintetázt két csoportba sorolják a Rossmann-hajték mintázatai és a tRNS-töltés módja szerint. 10–10 tartozik egy csoportba; ezek működésükben sem egyformák. Az enzimek a tRNS különböző elemeit ismerik fel, nem egyformán. Pl. a treonil-tRNS-szintetáz az aminosavat kötő kart (fogadókart) és az ellenhármas hurkot azonosítja; a glutaminil-tRNS-szintetáz egy harmadik elemet, a tRNS szerkezetében egymással párt képző G10–C25 bázispárt is egybeveti. Az ellenhármas hurok nem feltétlen szükséges a fajlagos kapcsolódáshoz, pl. analin-tRNS-szintetáz csupán egyetlen elem, az aminosavat kötő karon található G3–U70 bázispár alapján azonosít.
aminosav–tRNS kapcsolódás (→szállító RNS)
elő-mRNS–mRNS átalakítás az éretlen mRNS érett mRNS-sé változtatása. Háromféle módosulással megy végbe a sejtmagban:
• közteskivágással, vagyis az elő-mRNS egyes részeinek kivágásával;
• az 5’-végi sapka hozzátételével;
• 3’-végen az adenozinok kapcsolása, a 3’-farok (poly [A] tail) kialakításával.
■ Közteskivágás. A kivágásnak és az egyesítésnek több lehetősége van, aminek következtében különböző mRNS-ek képződnek, más-más fehérjét kódolva.
Az elő-mRNS kivágásának és egyesítésének lehetőségei:
• a köztesek teljes kivágása a képezők hiánytalan egyesülésével (ez a leggyakoribb)

• képző kivágása/átugrása a köztesekkel együtt (cassette exon, skipping exon)

• 3’-végi képezőbeli vágáshely (pirossal jelölve) (3’ splice site).

• 5’-végi képezőbeli vágáshely (pirossal jelölve) (5’ splice site).

• egymást kizáró kivágás (mutually exclusive exons). Két egymás melletti fehérjeképző közül vagy az egyik, vagy a másik vágódik ki; valamelyik mindig.

• váltakozó indítók (alternate promoters).

• köztesmegtartás (intron retention); az így keletkezett mRNS általában lebomlik.

A kivágódó képezők általában rövidek, és az 5’-kivágáshelyük gyengébb. Az SP fehérjék ezt felismerve segítik elő, hogy az RNS-szike ide kapcsolódjék. Ezzel ellentétben az a köztes, amelyhez SR fehérje kapcsolódik, nem vágódik ki. Az SR fehérjék tehát alapvető szabályozók: serkentő vagy gátló hatásuk az elő-mRNS-hez való kapcsolódásuk helyétől függ.
 ■ Az mRNS 5’-végének kialakítása. Az elő-mRNS 5’-végén
trifoszfát kapcsolódik az utolsó bázishoz. Enzimek ebből alakítják ki a metil-guanozin-trifoszfátot
tartalmazó 5’-sapkát.
■ Az mRNS 5’-végének kialakítása. Az elő-mRNS 5’-végén
trifoszfát kapcsolódik az utolsó bázishoz. Enzimek ebből alakítják ki a metil-guanozin-trifoszfátot
tartalmazó 5’-sapkát.
Az 5’-sapka kialakítása azzal kezdődik, hogy az elő-mRNS trifoszfátjából a trifoszfatáz egyet lehasít. Helyére a guanilil-transzferáz guanozin-monofoszfátot köt, amely rendszerint a 7. szénatomján metileződik, kialakítva a metil-guanozin-trifoszfátból álló 5’-sapkát. Ez teszi lehetővé, hogy az mRNS a magból a sejtplazmába kerüljön. (p foszfát; N nukleotid; G guanozin; m metil)
■ Az mRNS 3’-végének kialakítása. Az mRNS 3’-vége az elő-mRNS 3’-végén lévő AAUAAA-3’ bázissor hasításával és több száz adenozin (polyA) hozzáadásával jön létre. Az adenozin-monofoszfátok (AMP, 5’-adenylic acid) hozzáadása az mRNS 3’-végéhez az elő-mRNS átíródásának végeztével kezdődik: az elő-mRNS 3’-végének levágását követően sajátos fehérjék kapcsolják az AMP-ket a kialakuló mRNS 3’-végéhez. A hasítás helyét az 5′-AAUAAA-3 bázissor jelzi, amelyik 15–20 nukleotidnyira van felfelé a 3’-farok helyétől. (→hírvivő RNS)
A folyamat elnevezése a nemzetközi irodalomban: polyadenylation, a hazaiban adenozinodás*; és része a génkifejeződésnek. Vannak gének, amelyeknél az adenozinodás nemcsak a 3’-végen következik be; elnevezése alternative polyadenylation (termination); magyarul vagylagos adenozinodás*; ennek következtében egy génről így is többféle fehérje keletkezhet. A 3’-adenozinvég jelentős az mRNS sejtplazmába szállításában, az átfordításában és az mRNS állékonyságában: folyamatosan rövidül, és ha már túl rövid, az mRNS lebomlik.
Egyes mRNS-eknek, például a hiszton-mRNS-eknek nincs farokrészük, hanem hurokszerkezetet (stem-loop structure) képeznek, amelyet az U7 fehérjét tartalmazó snRNP alakit ki.
A sejtmagban kialakult mRNS-t a hozzá kapcsolódó szállítófehérjék (export factors) viszik a sejtplazmába. A kialakult mRNS-hez a sejtmagban azonnal REF/ALY, majd NXF1/TAP fehérje kötődik, kialakítva TREX össztest. Az SRSF1 (SR fehérje) viszi át az mRNS-t úgy, hogy kapcsolódik a NXF1/TAP-hoz: a TAP kötőgomolya köti. Miközben a REF/ALY leválik.
homo- ■ homogeneous egynemű ■ homologous (homolog) rokonmás ■ homologous chromosome kromoszómapártag
(→kromoszóma) ■ homologous protein rokonmás
fehérje (→fehérje) ■ homologous gene rokonmás
gén (→gén) ■ homologous recombination →szülőmás átrendeződés* ■ homologous recombination repair
(HRR) →rokonmás átrendezés* ■ homologous
RNA rokonmás RNS (→RNS) ■ homologous
sequence rokonmás bázissor (→bázissor) ■ homology →rokonmásság
közteskivágás folyamata vegyfolyamatok sorozata, az →RNS-szike* (spliceosome) végzi, szabályozók közreműködésével. Rendkívüli pontosságot igényel: egyetlen bázistévesztés súlyos következményekkel járhat; ezért szükséges a bonyolult összetételű RNS-szike, különben a kivágást egyetlen enzim is elvégezhetné. A kivágás öt lépésben megy végbe:
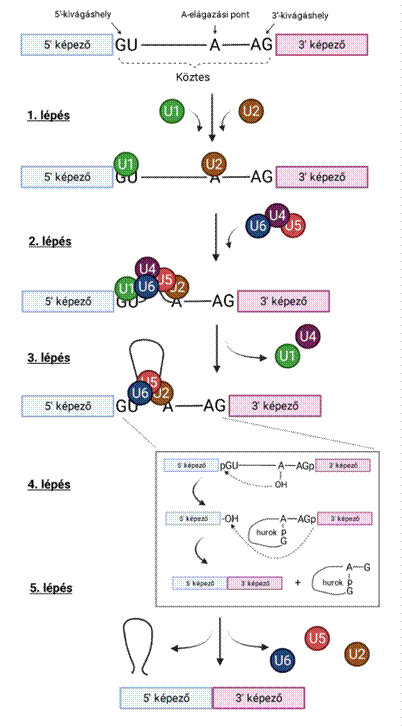 Első és második lépés: Először az U2 (U2snRNP) kapcsolódik az A-elágazáshoz. Az RNS-szike
ennek alapján azonosítja a kivágandó részt, ezzel indul a folyamat. Az U2
törzsökös GTAGTA hatosa bázispárosodással társul az A-elágazással, amelynek
törzsökös adenozinja ennek következtében előemelkedik. Az U2 társulásának
hatására az U1 (U1snRNP) az 5’-kivágáspont GU bázisaival kötődik, majd (második
lépés) az U4-, U5- és U6 kapcsolódik az U2- és U1-hez, áthidalva a köztük lévő
távolságot. Az UsnRNP kapcsolódására az 5’-kivágáshely és az A-elágazás, főleg
annak törzsökös adenozinja, közel kerül egymáshoz.
Első és második lépés: Először az U2 (U2snRNP) kapcsolódik az A-elágazáshoz. Az RNS-szike
ennek alapján azonosítja a kivágandó részt, ezzel indul a folyamat. Az U2
törzsökös GTAGTA hatosa bázispárosodással társul az A-elágazással, amelynek
törzsökös adenozinja ennek következtében előemelkedik. Az U2 társulásának
hatására az U1 (U1snRNP) az 5’-kivágáspont GU bázisaival kötődik, majd (második
lépés) az U4-, U5- és U6 kapcsolódik az U2- és U1-hez, áthidalva a köztük lévő
távolságot. Az UsnRNP kapcsolódására az 5’-kivágáshely és az A-elágazás, főleg
annak törzsökös adenozinja, közel kerül egymáshoz.
Harmadik lépés: Az 5’-kivágáshely és az A-elágazás közelkerülésével az U1 helyét az U6 foglalja el, az U1- és az U4 kilökődik. A széleket az U5 tartja össze, miközben az 5’-kivágáshelyhez bázispárosodással kapcsolt U6 szintén bázispárosodással fűződik az A-elágazó adenozinjával társult U2.
Negyedik lépés: Az 5’-kivágáshely elválasztása foszfodiészter-kötéssel jön létre: Az A-kivágáshely törzsökös adenozinjának 2. OH-csoportja kötődik 5’-kivágáshely guanin (G) foszfátjához 5’–2’ foszfodiészter kötéssel, aminek következtében felszakad a köztes és a képező közötti kötés; a kettő elválik egymástól – ezt a nemzetközi irodalomban first nucleophilic attack elnevezéssel illetik. Az 5’-vég visszahajolva elektronpárral kötődik az A-elágazóhoz, lasszó alakú képződményt létrehozva. Az 5’-képező 3’-végi OH-csoportja szabadon marad.
Ötödik lépés. Az 5’-képező 3’-végi szabad OH-csoportja kötődik a 3’-képező guanin foszfátjához (second nucleophilic attack); felszakad a köztes és a képező közötti kötés, a hurokalakú köztes elválik, és az enzimek lebontják. A fehérjeképezők egyesülnek 5’–3’ foszfodiészter kötéssel.
Összegezve a kivágás két észterkötéssel (transesterificacion) jön létre: az egyik a köztes 5’-vége és adenozinja közt, a másik a két fehérjeképező végei között.
közteskivágó* →RNS-szike*
mRNS-gátlás a génkifejeződés lényeges szabályozási folyamata a sejtplazmában, az RNS-közbeavatkozás egyik formája. Főleg a miRNS/siRNS a RISC részeként bázispárosodással kötődik az mRNS-hez, és azt hasítja, vagy csupán az átfordítását gátolja. Az mRNS gátlása visszahat: a génátíródást követően csillapítja a gént (post transcriptional gene scilensing, PTGS), általában tartósan. (→RISC, RNS-közbeavatkozás)
noncoding RNA →nem kódoló RNS
nucleocapsid (nukleokapszid) →köpenyes DNS/RNS
oxidation →elektronleadás. Az
oxidation (oxidáció) kifejezésnek csak nevében van köze az oxigénhez, eredetileg
ugyanis azonosították az oxigénfelvétellel. Később a hidrogénnel hozták összefüggésbe:
oxidation = hidrogénleadás, amely voltaképpen protonátadás, miközben egy
elektron felszabadul. (→hidrogén) A folyamat lényege az elektronleadás; ez
bármely vegyi folyamatban végbemehet. Az oxidation elnevezés azonban megmaradt.
Egyszerűen és egyértelműen elektronleadásnak nevezzük. (→elektronvesztés)
oxidation number, oxidation state (oxidációs szám) →elektornságiszám
oxidation-reduction (redox reaction, oxidoreduction, oxidoredukció, redoxifolyamat,
redoxireakció) →elektronátmenet
oxidation reduction potential, ORP →elektronátmenetség
RNA binding domain RNS-kötő gomoly az RNS-ekhez kapcsolódó gomoly. (→fehérjegomoly)
szállító RNS – aminosav kapcsolódás Az érett tRNS-nek a CCA-végződésén lévő adenozin 3’-hidroxilcsoportjához kapcsolódik a hozzá tartozó aminosav karboxilcsoportja észterkötéssel, az aminoacil-tRNS-szintetáz (aminoacyl tRNA synthetase, aaRS) közreműködésével. Az észterkötés hőigényes, ATP felhasználásával megy végbe. (→aminoacil-tRNS-szintetáz)
▪ Az aminoacil-tRNS-szintetáz először aminosavat és ATP-t kapcsol: aminoacil-AMP keletkezik pirofoszfát felszabadulásával: aminosav + ATP → aminoacil-AMP + PPi. (→ATP)
▪ Az aminoacil-AMP-t tartalmazó enzim kapcsolja az adott aminosavnak megfelelő tRNS-t, amelyet térszerkezet-fajlagosan ismer fel. A kapcsolt tRNS 3’-végi ribózának kettes/hármas szénatomján lévő hidroxilcsoportja kötődik észterkötéssel az aminoacil-AMP-hez; az AMP leválik, az aminosavval kapcsolt tRNS pedig elválik az enzimtől: aminoacil-AMP + tRNS → aminoacil-tRNS + AMP.
A folyamattal az aminosav úgymond tevősödik (aminoacid activation), mert az észterkötésben lévő energia elegendő két aminosavat összekötő peptidkötéshez. (A peptidkötés kialakulása hőleadó folyamat.)
Az enzim és az aminosav kapcsolata fajlagos: minden aminosavfajtának csak egyféle térszerkezetet azonosító enzime van, illetőleg az egyféle térszerkezetet felismerő enzim csak egyféle aminosavval társul.
Egyféle aminosavat többféle ellenhármasú tRNS is kapcsolhat. Például a fenilalaninnal az AAA és a GAA bázishármast tartalmazó tRNS is társul. A térszerkezete azonban mindkét tRNS-nek azonos (az ellenhármas nem befolyásolja a térszerkezetet), ezért mindkettőt ugyanaz az aminoacil-tRNS-szintetáz ismeri fel, és kapcsolja mindegyikhez ugyanazt az aminosavat, példánkban a fenilalanint. Ez a többféleség teszi rugalmassá az illeszkedést.
Ha nem megfelelő az aminosav–tRNS társulás, az aminoacil-tRNS-szintetáz vágógomolya lehasítja az aminosavak, a sarkallógomoly pedig a megfelelőre cseréli pillanatok alatt (saját ellenőrzés). Ennek ellenére keletkezhet hibásan társult aminoacil-tRNS (~ minden 40 000. hibás), amelyből hibás fehérje keletkezik. Ezt a sejt lebontja, nincs komoly következménye.
TERC (telomerase RNA component) →telomeráz-RNS
testvérmás* isoform közös génről vagy azonos géncsaládból származó két vagy több nagyon hasonló összetételű és tevékenységű fehérje, miRNS. A közös származás miatt mondjuk „testvéreknek”; testvérmásoknak. A testvérmások összegképlete – ellentétben az azonmásokkal – némileg eltérő.
testvérmás fehérjék protein isoforms származhatnak egyetlen génről módosulással, pl. közteskivágással alakulnak többé-kevésbé eltérő szerkezetűvé, avagy az átfordítást követően. Az is előfordul, hogy egyetlen géncsalád szoros viszonyban lévő génjei kódolnak testvérmásokat. Tehát háromféleképpen keletkezhetnek: összetartozó gének (géncsalád) kódolásából, az elő-mRNS, illetve a polipeptid módosításával. A testvérmások keletkezése lehet törzsfejlődési folyamat eredménye is: lehetővé teszi a fehérjék sokféleségének keletkezését.
A testvérmások aminosavmaradék-sora rendkívül hasonló, de nem azonos. Pl. a β-aktin és a γ-aktin mindössze 4 aminosavban tér el (az utóbbiban néggyel több aminosav-maradék van), ennek ellenére tevékenységük lényegileg más. A β-aktin elengedhetetlen az élethez, a γ-aktin nem.
Szokásosan az aminosavak leírásával adjuk meg a testvérmásokat, és ezek különbségével magyarázzuk a működésük eltéréseit. Kiderült azonban, hogy pl. a β-aktin és a γ-aktin gén bázissora (nukleotidsora) még fontosabb a tevékenység meghatározásában.
A két gén szerkezete csaknem egyezik, kivált a kódoló szakasz, és hasonló a két elő-mRNS is; ugyanakkor a β-aktin 3’UTR szakasza sajátos. A β-aktin kódoló szakaszának módosításával (hozzáadták a hiányzó 4 aminosavat kódoló bázishármast), a β-aktin gén is γ-aktint kódolt. Az állat mégsem pusztult el, ellenkezőleg semmiben nem tért el a szabvány β-aktin gén által kódolttól, utalva arra, hogy a β-aktin gén nem kódoló bázissora is alapvető az általa kódolt fehérje képzésében. Megállapították, hogy a β-aktin gén által képzett mRNS-hez az eltérő 3’UTR szakasz miatt sokkal több ribotestecs tapad, és rövid idő alatt sokkal több fehérje fordítódik át, mint a γ-aktin gén által képződő mRNS-ről, és hogy a β-aktin és a γ-aktin fehérje szerepének lényegi különbsége alapvetően ebből adódik, nem pedig a négy aminosav-különbözettől.
testvérmás miRNS-ek microRNA isoforms ezek hosszukban, bázissorukban vagy mindkettőben és leginkább az 5’- vagy 3’-végen térnek el egymástól. Ennek alapján ötféle miRNS-eket különböztetünk meg:
▪ törzs miRNS-ek canonical microRNAs;
▪ 5’-végi testvérmás miRNS-ek 5′ isomiRs;
▪ 3’-végi testvérmás miRNS-ek 3′ isomiRs;
▪ sokalakú testvérmás miRNS-ek polymorphic isomiRs;
▪ vegyes testvérmás RNS-ek mixed type isomiRs.