ellenanyag–jelfogó/komplement kapcsolódás. Az
ellenanyag Y szárának alsó kétharmada, az Fc-töredék (Fc) vesz részt
ezekben a kapcsolódásokban. Kötődik az Fc-jelfogót (FcR) kifejező sejtekhez
(FcγR [IgG-Fc], FcRn [neonatal]) a CH3 gomollyal; az FcR-szerű
jelfogókkal (Fc-receptor-like receptors, FcRL4/5), a C1 (komplement-1) fehérjével
(CH2 gomoly társul) és a TRIM21 fehérjével (tripartite
motif-containing protein 21). Az Fc-töredék ezekkel kötődve indít
immunfolyamatokat, mint complement-dependent cytotoxicity (CDC),
antibody-dependent cellular cytotoxicity (ADCC), sejtfalás, avagy a gátló
Fc-jelfogókhoz fűződve akadályoz gyulladásos válaszokat. Végeredményben
összeköti a veleszületett és a szerzett immunrendszer folyamatait.
enyészetjelfogók scavenger
receptors, SRs mintázatfelismerő sejtfali jelfogók. Különböző szerkezetű és
tevékenységű jelfogok sokaságának nagycsaládja. Nemcsak a károsságmintázatokat
(DAMP, demage-associated molecular pattern), hanem kórokozótársult mintázatokat
(PAMP, pathogen-associated molecular pattern) mintázatokat is felismerik. A
szervezet számára káros saját és idegen molekulákat távolítják el a sejtbekerülés,
a sejtfalás, tapadások és jelzések segítségével; ez a közös bennük. Lényeges a
szerepük van a szabadgyökök rendszerében, a sejtvégzetben és az érképződésben. Sokféle
enyészetjelfogó van; ezeket osztályokba sorolják. Az egyes osztályokat
nagybetűvel jelöljük (A–L: SR-A, SR-B… SR-L [SR a scavenger receptor nemzetközi
betűszója]). Az osztályon belüli fajtát arab szám jelzi (SR-D1), ennek
változátát pontot követő szám adja meg (SR-A1.2 – az enyésztésjelfogó A
osztálya első fajtájának második változta).
Class A (SR-A) 2-es formájú
(~400–500 aminosavas) sejtfali jelfogó rövid sejtbeli (N-vég), kifejezett
sejten kívüli résszel. Jellegzetessége a kollagénszerű gomoly; kollagéneket
kötnek. Jelentősek: SR-A1, SR-A3, SR-A4, SR-A5 és SR-A6 (részletezésük
túlterjed a nevezettár keretein; egyet-egyet külön címszóként ismertetek).
Class B (SR-B) Patkó alakú
(~400–450 aminosavas) sejtfali jelfogó két hártyai résszel. Az N- és a C-vége
is a sejtplazmában van. Jelentősek: SR-B1, SR-B2 és SR-B3; a
jelzésközvetítésben és sejtbeli szállításban vesznek részt.
Class C (SR-C) emberi sejtben nincs.
Class D (SR-D) Csak az SR-D1 jelentős, amely
1-es sejtfali (354 aminosavas) jelfogó; az immun- és a csontvelősejteken
fejeződik ki. Rövid (12 aminosavas) sejtbeli és kétgomolyos sejten kivüli része
van: az N-vég közeli nyákszerű (N-proximal mucin-like domain) és a LAMP
(lysosome-associated membrane protein) gomoly; ezeket proléngazdag kapcsolórész
köt össze. Az SR-D1 (CD68) gén kódolja, amely a 17-es kromoszómán van.
Class E (SR-E) Csak az SR-E1 (más néven lectin-like
oxidized low-density lipoprotein receptor, LOX-1/OLR1/SR-E1) jelentős, amely 2-es
sejtfali (273 aminosavas) jelfogó rövid sejtbeli véggel. A sejtkívüli
C-lecitinszerű gomoly (C-type lectin-like domain) fonadék (coiled-coil) nyélen
ül. A természetes immunfolyamatokban vesz részt. A 12-es kromoszómán lévő SR-E1
gén kódolja.
Class F (SR-F) Az SR-F1 (SREC1) és SR-F2
(SREC2) jelentős. Mindkettő 1-es sejtfali (850–900 aminosavas) jelfogó,
sejtkivűli ~450 aminosavas gomolyukban EGF-szerű ismétletek vannak, a sejtbeli
gomolyuk viszonylag nagy (~400 aminosavas). Az SR-F1 gén a 17-es, az SR-F2
gén a 22-es kromoszómán található. Az SR-F1 LDL- (cLGL, acLDL [acetylated
low-density lipoprotein], oxLDL [oxidized low-density lipoprotein])
részecskéket köt, az idegsejteken és béléssejteken fejeződik ki. Az SR-F2 kettőst
képez az SR-F1-gyel, és gátolja annak működését.
Class G (SR-G) Az Sr-G fehérje (SR-PSOX) 1-es
sejtfali (254 aminosavas) jelfogó; más néven kemokin-16 (CXCL16). Sejkívüli
gomolya irányítja a foszfatidilszerin (oxLDL) sejtesedését és a
beltestecs–emésztőtestecs rendszerbe szállítását. Jelentős szerepe van
természetes immunitásban, baktériumokat köt. Az SR-G gén a 17-es
kromoszómán van.
Class H (SR-H) Az SR-H1 és SR-H2 ismert,
mindegyik 1-es sejtfali jelfogó; szénhidrátfehérje sokféle sejtkívüli
gomollyal: fascilin, EGF-szerű, laminin-formájú EGF-szerű és kapcsoló (FEEL)
gomoly. Többek között immunfolyamatokban vesznek részt. Az SR-H1 gént a
3-as, az SR-H2 gént a 12-es koromoszóma tatrtalmazza,
Class I (SR-I) Az SR-I1 (CD163) ismert, ez 1-es sejtfali jelfogó; szénhidrátfehérje, rövid
sejtbeli, hosszú sejtkívüli résszel, benne SRCR (type B scavenger receptor
cysteine-rich) gomollyal. Elsődlegesen a vérsejtek rendszerében van szerepe.
Főleg az egymagúakon (monocytes) és nagyfalósejteken fejeződiok ki. Az SR-I1/CD163
(M130) gén a 12-es kromoszómán van.
Class J (SR-J) Egyedüli tagja az SR-J1,
amely 32 kDa nagyágú, mintazátfelismerő sejtfali jelfogó; génje az
immunglobolinok nagycsaládjához tartozik. Sejtkívüli változó formájú gomolya
(extracellular V [variable]-type domain) sokféle mintázati elemmel kötődhet:
β-amiloid, kalgranulin (S100/calgranulin), foszfatidil-szerin, HMGB1
(high-mobility group protein 1) stb. A sejtbeli gomolya két C-forma gomoly
(C-type domains). A gyulladásmolekulák tevékenységében van szerepe.
falósejtjelfogók phagocyte receptors a
falósejteknek a lebontandó részecskéket felismerő felszíni jelfogói. Nagyon
sokféle van, mivel igen sokféle részecskét (a mikrobák és a sejtek
sokféleségét) kell felismerni. Ezeket két nagy csoportra osztjuk: az
antigénfedést felismerő (opsonic receptors) és a mintázatfelismerő jelfogók
(non-opsonic receptors, pattern-recognition receptors [PRR]) csoportjára.
▪ A mintázatfelismerő jelfogók közvetlenül ismernek fel
korokozótársult mintázatokat (pathogen-associated molecular pattern [PAMP]), és
kapcsolódnak hozzájuk – ezek a jelfogók tehát nem keringő jelvivőket kötnek.
A kórokozótársult mintázatok olyan ősi mintázatok,
amelyek a magasabb rendűek sejtjein már nincsenek jelen, a mikrobákon azonban
igen, és, lévén ősiek, nem is nagyon módosulnak. Ilyenek például a β-glukánok
és a mannózok a gombákon, a lipopoliszacharidok a baktériumokon stb. Ez azért
lényeges, mert a mikrobák hajlamosak gyakori alakváltoztatásra, a sejtfalásra
szakosodott, veleszületetten kódolt jelfogók száma ugyanakkor korlátozott: az
új alakzatok száma meghaladja a jelfogók felismerési képességét.
▪ Jellegzetes nem lefedő jelfogók a dektinek (dectin-1 és dectin-2), a DC-SIGN, a mincle, a mannózjelfogó,
a MACRO, az MCL és néhány enyészetjelfogó (SR-B [CD36], SR-A). Idesoroljuk a
sejtvégzeti jelfogókat is (αVβ3, αVβ5, BAI1 [
brain-specific
angiogenesis
inhibitor 1],
CD14, TIM1 [T cell immunoglobulin mucin],
TIM4, stabilin-2).
Fc-jelfogók (FcR) Fc receptors, FcR az immunglobulinok
Fc-töredékét kötő jelfogók; legtöbbjük az immunglobulin-nagycsaládba tartozik.
Sejtfali jelfogók, jellegzetességük, hogy a sejtplazmába nyúló szakaszukban
vagy a hozzá kapcsolódó fehérjékben ITAM mintázat van; ezen keresztül indul a
jelközvetítés. Az Fc-jelfogót kifejező sejt fajtájától és az Fc-jelfogó
szerkezetétől függően, különböző végrehajtó folyamatokat (sejtfalás,
sejtközvetített immunválasz, allergiás folyamatok stb.) közvetítenek, miközben
gyulladásos folyamatokat gerjesztő citokinek szabadulnak fel. Az Fc-jelfogó a
citokinek hatására megjelenhet az immunsejtek szinte mindegyikén.
Osztályozásuk megegyezik az immunglobulinok
felosztásával; mindegyik fajta immunglobulinnak van fajlagos Fc-jelfogója: IgA
(FcαR), IgD (FcδR), IgE (FcεR), IgG (FcγR), IgM (FcμR). Egyes osztályokat további
alcsoportokra is osztanak, például: FcγR1, FcγR2, FcγR1a stb. Előfordul gátló
hatású FcR is (FcγR2b), ebben ITIM mintázat van.
fehérjekapcsolódások protein bindings a fehérjék kapcsolódása ionokkal, kis molekulákkal
vagy nagymolekutákkal. Két változata a fehérjék kötődése és a fehérjék
társulása.
▪ fehérjekötődés vegykötésekkel létrejövő fehérjekapcsolódás; a
kapcsolódást a vegykötés hozza létre. Lehet elektronkötéssel vagy gyenge
kötésekkel létrjövő, pl. →jelvivő–jelfogó kötődés. (→gomoly)
▪ fehérjetársulás szerkezeti
illeszkedésből keletkező kapcsolódás, nem vegykötés alakítja ki. Vegykötés
másodlagosan, a kapcsolódást követően jön létre; pl.→fehérje–fehérje társulás. Sajátos formája a kiváltott illeszkedés (induced fit),
amikor a fehérjetársulás következtében létrejövő térszerkezeti változás
alakítja ki a teljes illeszkedéshez szükséges térszerkezetet. (→jelvivő–jelfogó kötődés)
A
fehérjék szokásosan sajátos szerkezeti egységeikkel, a gomolyokkal kapcsolódnak
egymáshoz. (→gomolyok)
G-fehérje-kapcsolt jelfogó kináz G-protein-coupled receptor kinase, GRK szerin-treonin-kináz. Hét fajtája ismert; ezeket három
alcsaládba sorolják hasonlóság alapján (GRK1 [rodopszin-kináz] és GRK7; GRK2 és
GRK3; valamint GRK4–6). Három gomolyuk van: középen a sarkalló (foszforilező),
mely a PKA és PKC-hez (fehérjekináz-A, -C) hasonló szerkezetű; a szabályozó
gomoly az N-végen és a változó gomoly a C-végen. A GRK-k a G-fehérje-kapcsolt
jelfogók sajátos foszforilezése mellett sok más fehérjét is foszforileznek
(→epidermal growth factor [EGF], platelet-derived growth factor [PDGF] jelfogó, tubulin, R-SMAD stb.). A GRK-k által kapcsolt foszfátcsoport gátló hatású a
G-fehérje-kapcsolt jelfogóra; szerepük elsősorban a jelzésberekesztésben van.
jelvivő–jelfogó kapcsolódás a jelvivőnek a
jelfogó jelvivő kötéshelyéhez* (ligand binding site, orthosteric site)
való kötődése térszerkezeti illeszkedéssel – vagyis csakis a hozzá illeszkedő
jelfogó társulhat; ez biztosítja a kapcsolódás fajlagosságát. Nemegyszer a
társulással a kötődés bekövetkezte még nem elegendő, teljessé a jelfogónak a
társulás következtében bekövetkező alakváltozásával válik. Ezt – miként az
enzimekben – kiváltott illeszkedésnek* (induced fit) nevezzük. A
kapcsolódás nem elektronkötésű; egyetlen kivétel a retina fényjelfogójához
(rodopszin) kapcsolódó retinál, amely elektronpárral társul. Általában gyenge
kötések (ionos kötés, hidrogénkötés, töltéskötés, víztaszító kölcsönhatás, van
der Waals-kölcsönhatás) hozzák létre. A nagymolekulák több ponton is
kapcsolódhatnak felszíni vonzással.
A jelviteli kapcsolódás rendszerint átmeneti (a jelvivő
bizonyos idő után elválik, lebontódik), de lehet tartós is. A kapcsolódási erőt
az elválási állandóval* (equilibrium dissociation constant, KD)
fejezzük ki. A jelátvitelt közvetítő jelfogó legtöbbször bekerül a sejtbe (internalisation),
és egy rövid ideig még a sejtben is átadja a jelet. A jelfogóhoz erősen
kapcsolt jelvivő a jelfogóval együtt kerül a beltestecsbe, ahol elválik a
jelfogótól és lebomlik – nem jut a sejtplazmába. A sejtbe került jelfogó
általában lebomlik, de az sem ritka, hogy újra visszakerül és működésbe lép a
sejthártyán.
A jelvivő–jelfogó kötődését befolyásolja a:
▪ Jelvivő kötődési hajlama (ligand affinity) és a jelvivők töménysége. A
jelvivő kötődési hajlama lehet gyenge (low-affinity) és erős (high-affinity).
Gyenge hajlamú az a jelvivő, amely létezésének nagyobb részét szabadon, nem a
jelfogóhoz fűződve tölti, az erős hajlamú pedig a fordítottja. Az előbbi
esetben a jelfogó csak úgy tudja átadni a jelet, ha az egyik jelvivőt azonnal
másik és megint másik követi; tehát sok jelvivő szükséges (mikromól
töménységben). Ha korlátozott a jelvitel tere, mint az illesztékekben
(synapsis), a gyenge jelvivő is nagy töménységben lehet jelen. Az erős kötődési
hajlamú jelvivőkben már csekély mennyiség is képes a jelátvitel kiváltására,
azaz ezek kis töménységben (nanomól) is hatásosak. A gyenge vonzódású jelvivő
előnye a leállítás egyszerű volta, számuk csökkenésével azonnal megszűnik a jelátvitel,
vagyis gyors a ki-be kapcsolás, amely például az izom-összehúzódásokban
lényeges.
▪ Jelfogók száma. Egy-egy sejten egy-egy fajta jelfogóból 10 000 is
jelen lehet. A jelfogók száma lényeges: csak ha sok van, akkor képesek elegendő
számban megkötni a jelvivőt: a kapcsolt jelfogók száma ugyanis, adott jelvivő
és töménység mellett, arányos a sejthártyában eleve megtalálható jelfogók
számával. Másként: ha sok a jelfogó, kevesebb jelvivő is elegendő azonos
jelátvitel létrehozásához. A sejt képes szabályozni a kifejeződő jelfogók
számát, például, ha nagyon sok a jelvivő a környezetében, csökkenti
(visszajelzés, feedback) – ezt nevezi a nemzetközi irodalom úgy, hogy receptor
down-regulation (jelfogócsökkentés*). A jelfogók kifejeződésének mérséklése
fontos védekezés a túlterheltséggel szemben. A túlterheltség elleni védekezés
másik módja a jelfogó jeltovábbítással szembeni ellenállásának növelése,
amelyet a sejt sokszor a jelfogó sejtplazmai részének foszforilezésével ér
el.
• Jelfogók kötőképessége (receptor
affinity) azt fejezi ki, hogy a jelfogó milyen erősen képes kapcsolni a
jelvivőt.
A jelvivő–jelfogó kapcsolódás következtében megváltozik
a jelfogó térhelyzete (conformational changes): módosulnak a nem elektronkötések.
A jelfogó fehérje elsődleges szerkezete (elektronkötések) érintetlen marad. A
jelfogó térhelyzeti változásának háromféle közvetlen következménye lehet:
• szabaddá válnak a jelfogó sejten belüli
kötőhelyei,
•
az enzimműködésű jelfogók enzimegységei gerjesztődhetnek (foszforileződhetnek),
•
az ioncsatorna működésű jelfogóknál megnyílnak az ioncsatornák.
A jelfogók kötőhelyéhez azonban csatolódhatnak
molekulák térszerkezeti változtatás nélkül is; ilyenek pl. azok a gátlók, amelyek
csupán lefedik a jelfogót, avagy a gázok stb.
magjelfogók nucleal receptors a sejtben lévő jelfogók; jelvivőt kötő átírásfehérjék a
sejtelkülönülés, az ébrényi fejlődés, a szervkialakulás irányítói. A hatásukat
a DNS-ben fejtik ki, ahhoz fűződnek – ezért nevezzük ezeket magjelfogóknak
–, jóllehet jó néhánynak van sejtfelszíni hatása is. Nagycsaládot alkotnak,
amelynek 48 tagja van; 48 különböző gén kódolja őket.
A jelvivőik két nagy csoportba sorolhatók: a
koleszterinalapú és a zsírsav/foszfolipid alapú jelvivőkre.
■ A koleszterinalapú jelvivők a szteroid hormonok; ezek
kis molekulák, könnyen átjutnak a sejthártyán, és nagy fogékonysággal kötődnek
a jelfogókkal, amelyeket hormonjelfogóknak (endocrine receptors) nevezünk.
Közéjük tartoznak a mineralo-/glükokortikoid, ösztrogén-, androgén-,
progeszteronjelfogók stb.
A sejtplazmában lévő jelfogók
dajkafehérjével (pl. HSP90, ritkán HSP70) kapcsolódva vannak, tevőtlen
állapotban. A jelvivővel kötődve elválnak a dajkafehérjétől, azonnal kettőst
képeznek, pl. két jelvivős ösztrogénjelfogó társul; ez szükséges a tevősödéshez.
Kettősként áthatolnak a maghártyán, és kötődnek a célgénhez, a fajlagos
hormonkötő válaszelemhez (HRE; hormone response element), amely rendszerint az
indítóban vagy a fokozóban van. (→hormonkötő válaszelemek)
A génnel kapcsolt jelfogó–jelvivő
kettőshöz társserkentők (transcriptional coactivators, CoA) csatolódnak;
többféle kapcsolódik, rendre nem egyszerre, hanem amikor az egyik elvégezte a
feladatát, kötődik a másik; avagy az egyik kapcsolja a másikat, pl. az SRC1–3
elsőként járul a jelfogóhoz, és toborozza a többit. Ezek módosítják a kromatint,
lehetővé téve az átírásfehérjék kapcsolódását. A társserkentőkben
hiszton-acetil-transzferáz van, amely a hisztonok acetilezésével megnyitja a
kromatint.
A szteroid hormonok általi génátírás
legtöbbször két lépésben zajlik: először a korai géneket serkentik, amelyekről
szabályozó fehérjék képződnek. A szabályozó fehérjék egyik csoportja gátolja a
korai gének további átírását, másik csoportjuk serkenti a késői géneket,
amelyek a hormonhatást végrehajtó fehérjéket kódolják. Ez a kétlépéses átíródás
magyarázza az elhúzódó hormonhatást.
■
A zsírsav/foszfolipid alapú jelvivők a sejtmagban lévő jelfogókkal társulnak,
szerkezeti változást hoznak létre, a jelfogók így tevősödnek. A sejtmagban lévő
jelfogók (pl. pajzsmirigyhormon-, retinolsavjelfogó), társgátlóval (CoR,
corepressor) kapcsolódva kötődnek a fajlagos hormonkötő válaszelemhez,
tevőtlenek. A jelvivővel csatlakozva elválnak a társgátlótól, egyesülnek az
RXR-rel (retinoid X receptor), azaz vegyes kettőst képeznek; így kötődnek a
célgénhez. A társgátlók (pl. NCoR, SMRT) hiszton-dezacetilázt (HDAC) kötnek,
amely tömöríti a kromatint.
Sok
ilyen jelfogó jelvivője nem tisztázott (árva jelfogók, orphan receptors), vagy
csak később vált ismertté (árvátlanodott jelfogók (adopted orphan receptors),
ezért nevükben előfordulhat az orphan jelző.
Ebbe
a csoportba tartozó jelfogók pl. az SF1 (steroidogenic factor-1), a RORα
(RARrelated orphan receptor α), a RORγ (retinoic acid receptor-related orphan
receptor γ), a D-vitamin-jelfogó stb. Előfordul, hogy az árva jelfogó kettőst
képez valamelyik szokványos magjelfogóval; ilyen pl. az RXR (retinoid X
receptor).
Néhány sejtmagi jelfogó a sejtplazmában
keletkezett jelvivővel társul, lehetővé téve a sejt önszabályozását. Pl. az LXR
az oxiszterollal kapcsolódik.
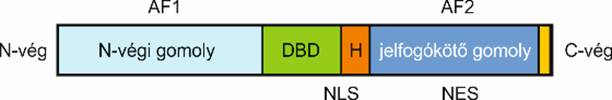
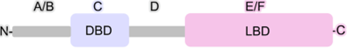 A magjelfogók elsődleges szerkezete meglehetősen hasonló: mindegyiknek
van egy jelvivőkötő (ligand binding domain, LBD; C’-végi E/F gomoly) és egy
DNS-kötő (DNA binding domain, DBD) gomolya; legtöbbjükben van még egy A/B és
egy D gomoly is.
A magjelfogók elsődleges szerkezete meglehetősen hasonló: mindegyiknek
van egy jelvivőkötő (ligand binding domain, LBD; C’-végi E/F gomoly) és egy
DNS-kötő (DNA binding domain, DBD) gomolya; legtöbbjükben van még egy A/B és
egy D gomoly is.
▪ Az N’-végi gomoly (A–B gomoly) nagyon változékony;
hosszúságában és bázissorában is lényegesen eltér a különböző magjelfogókban.
Ebben van egy DNS-kötő bázissor, amelyet AF1 (activation function-1) gomolynak
nevezünk. Az AF1 a jelvivőtől függetlenül is szabályozza a génátírást, de a
jelvivőt kötő gomoly is ellenőrzi. Ez a rész foszforileződhet, és a 3’-végi
gomollyal kölcsönhatásban alakítja a fehérje térszerkezetét.
▪ A középső törzsökös DNS-kötő gomoly (C gomoly)
meglehetősen egyforma mindegyik magjelfogóban. Két cinkujj mintázatot
tartalmaz; az ujjakban 4 ciszteint köt össze a cinkion. Az egyikben (CI)
P-doboz van; ez kötődik a fajlagos hormonkötő válaszelemhez, a másikban (CII)
D-doboz van; ez a jelfogókettőst hozza létre.
▪ A jelvivőt kötő és a C gomolyt összekapcsoló kicsi
kapocsrész a D gomoly.
▪ A C’-végi jelvivőkötő gomoly (E–F gomoly, LBD); ehhez
kapcsolódik a társmagjelfogó is. 12 α-csavarodásból áll, térszerkezete
nagyjából egyforma a magjelfogókban, egymástól a jelvivőkötő helyben térnek el.
F felszíne az AF2 (activation function-2), amely az átírás fő irányítója. A
G-fehérje jelfogókhoz hasonlóan működik: a jelvivővel kapcsolódva az AF2
kötődik a társszabályozókkal, ennek következtében válik hatékonnyá a jelfogó.
A
szteroid jelvivők szokásosan a jelvivőkötő gomolyhoz kapcsolódnak, a
zsírsav/foszfolipid alapú jelvivőknél inkább térszerkezeti szabályozás történik
(pl. RORγ). Egyes magjelfogóknak van foszforilezési mintázata is, de a
foszforilezési tevősítésük még nem tisztázott.
mintázatfelismerő jelfogók
pattern recognition receptors,
PRR a kórokozók törzsökös mintázatait (pathogen-associated molecular
patterns, PAMPs) és a pusztuló, károsodott sejteken megjelenő mintázatokat, a sérülésmintázatokat*
(demage-associated molecular patterns, DAMPs) érzékelik. Leginkább a falósejtek,
kevésbé a hámsejtek, májsejtek stb. felszínén fordulnak elő, de vannak keringő
(pl. mannózkötő lektin, MBL) és sejten belüliek is.
orphan receptor árva jelfogó (→jelfogó)
PRR (
pattern
recognition
receptors) →mintázatfelismerő jelfogók
scavenger
receptors →enyésztésjelfogók*
sejtbeli jelfogók →magjelfogók
sejtmagi jelfogók nuclear receptors átírásfehérjék nagycsaládja (superfamily),
számtalan biológiai folyamatban vesznek részt, mint az anyagcsere, a szaporodás
és a gyulladás. A nagycsaládot 7 családra osztják. Az emberben ~50
féle ismert (ösztrogén-, progeszteron, androgén-, retinoid-, D-vitamin-jelfogó
stb.) Legtöbbjük jelvivője zsírkedvelő kis molekula (szteroid, retinoid,
foszfolipid); de vannak árvák is; ezeknek nem ismerjük a jelvivőjüket.
Szerkezetük
rendkívül változatos, nagyságban, formában és töltésükben is mások, de egy
hasonló gomolyrendszer jóformán mindegyikben megvan.
A sejtmagban
vannak, a jelvivőt kötve változik a térszerkezetük (conformational changes),
aminek következtében sajátos bázissorokat kötnek a DNS-en. Ha fűződnek a
DNS-hez, társszabályozó fehérjék, kromatinmódosítók, általános átírásfehérjék
toborzódnak a célgén átírásának serkentésére, avagy akadályozására. Mivel a
sejtmagi jelfogók a gének ezreit szabályozzák, működésük szigorúan ellenőrzött.
Hibájukból igen sokféle betegség származhat.
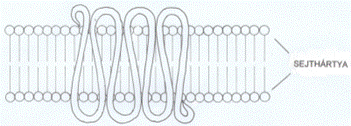 A 7TM-fehérjék a külső és belső felszínen hurkokkal
összekapcsolt hét sejthártyán áthaladó α-csavarulattal rögzülnek a
sejthártyában; ezen kívül a polipeptid lánc mindkét vége is hurkot formál - az
N-vég a sejten kívül, míg a C-vég a sejten belül található. A sejthártyán
kívüli rész köti a jelvivőt, a sejtbe nyúló hurkok közül kettő pedig a
háromalegységes G-fehérje α-alegységét; ez utóbbi esemény általában akkor
következik be, amikor a jelfogó gerjesztődik a jelvivő hatására, de az is
előfordul, hogy a G-fehérje a jelfogó tevőtlen állapotában is hozzá kapcsolt..
(Az ábrát Teleki Katalin készítette.)
A 7TM-fehérjék a külső és belső felszínen hurkokkal
összekapcsolt hét sejthártyán áthaladó α-csavarulattal rögzülnek a
sejthártyában; ezen kívül a polipeptid lánc mindkét vége is hurkot formál - az
N-vég a sejten kívül, míg a C-vég a sejten belül található. A sejthártyán
kívüli rész köti a jelvivőt, a sejtbe nyúló hurkok közül kettő pedig a
háromalegységes G-fehérje α-alegységét; ez utóbbi esemény általában akkor
következik be, amikor a jelfogó gerjesztődik a jelvivő hatására, de az is
előfordul, hogy a G-fehérje a jelfogó tevőtlen állapotában is hozzá kapcsolt..
(Az ábrát Teleki Katalin készítette.) A magjelfogók elsődleges szerkezete meglehetősen hasonló: mindegyiknek
van egy jelvivőkötő (ligand binding domain, LBD; C’-végi E/F gomoly) és egy
DNS-kötő (DNA binding domain, DBD) gomolya; legtöbbjükben van még egy A/B és
egy D gomoly is.
A magjelfogók elsődleges szerkezete meglehetősen hasonló: mindegyiknek
van egy jelvivőkötő (ligand binding domain, LBD; C’-végi E/F gomoly) és egy
DNS-kötő (DNA binding domain, DBD) gomolya; legtöbbjükben van még egy A/B és
egy D gomoly is.