hPB1 ( poly bromo-1) fehérje (egyéb nevei: BAF180, polybromo-1D, RSC1/2/4) a pBAF össztes sajátos, jelzésérzékelő fehérjéje; a sejtburjánzás negatív szabályozója (daganatgátló fehérje). A PBRM1 (egyéb nevei: BAF180, PB1, SMARCh1, RCC) gén (3p21.1) kódolja. A gén hibája következtében vesesejtes rák (renal cell carcinoma, RCC) alakulhat ki.
Találatok címszavakban (5 szócikk):
PNKP (polynucleotide kinase 3’-phosphatase) polinukleotid-kináz-3’-foszfatáz; nevezik PNK-nak is. ATP-kötő, valamint az N-végen a kettőződési villához kötődő (forkhead association, FHA domain) és a 3’-végi sarkalló gomolya van. Az utóbbi foszfatáz és kináz egységekből tevődik össze. Az enzim tehát kettős: foszfatáz és kináz hatású. A DNS-hibák javításának alapvető enzime, részt vesz a végegyesítésben és a báziskívágásokban is. Biztosítja, hogy a DNS-végek alkalmasak a hosszabbításra és egyesítésre – a ribóz 3’-foszfátját távolítja el, avagy az 5’-OH csoportját foszforilezi. A PNKP gén kódolja, amely a 19-es kromoszómán (q13.33) van. (→báziskivágás, végegyesítés)
poly- előtag, jelentése ’sok összetevős’ ■ poly(ADP-ribose) polymerase (→PARP) ■ polyadenylation (→adenozinodás) ■ polygenetic inheritance, quantitative inheritance (→többgénes öröklődés) ■ polymer, polymerization (→összlet) ■ polymorphism (→sokalakúság) ■ polyprotein (→fehérje)
polybromo-1 fehérje (protein polybromo 1) →hPB1
polygenetic inheritance, quantitative inheritance → többgénes öröklődés
Találatok alcímszavakban (1 szócikk):
Részleges egyezések (17 szócikk):
DNS-polimeráz (POL) DNA polymerase DNS-t képező enzim. Megkülönböztetünk DNS-függő és RNS-függő DNS-polimerázt. Az előbbi a DNS-t, az utóbbi az RNS-t használja mintafelületként.
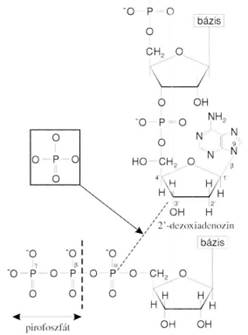 DNS-függő DNS-polimeráz DNA dependent DNA polymerase kettős
hatású: a nukleozid 5’-trifoszfát α-helyzetű foszfátját köti a nukleotidlánc
végét képező 3’-OH csoporthoz diészterkötéssel, másrészt 3’→ 5’ exonukleáz
hatású. Minden új nukleotid beépítése előtt ellenőrzi a legutolsót, és ha nem
megfelelő, kivágja, majd beépíti helyette a megfelelőt. A polimeráz csak a
3’-OH-csoporthoz képes kapcsolódni, egyébként nem tevékeny. A kapcsolódás tehát
5’→ 3’ irányú, fordítva (3’→ 5’ irányban) nem jön létre. Eközben a nukleozid
5-trifoszfát α és β jelzésű foszfátja közötti kötés vízelvonás mellett
felszakad, a β és γ jelzésű foszfátot tartalmazó pirofoszfát szabaddá válik. Az
emberi DNS-polimerázok mindig csak a már meglévő nukleotidlánchoz kapcsolnak
újabb nukleotidot, két szabad nukleotidot nem képesek összekötni. A báziskivágó
javításban a POLβ, POLδ/ε és a POLλ, a párhibajavításban a POLβ, POLε vesz
részt
DNS-függő DNS-polimeráz DNA dependent DNA polymerase kettős
hatású: a nukleozid 5’-trifoszfát α-helyzetű foszfátját köti a nukleotidlánc
végét képező 3’-OH csoporthoz diészterkötéssel, másrészt 3’→ 5’ exonukleáz
hatású. Minden új nukleotid beépítése előtt ellenőrzi a legutolsót, és ha nem
megfelelő, kivágja, majd beépíti helyette a megfelelőt. A polimeráz csak a
3’-OH-csoporthoz képes kapcsolódni, egyébként nem tevékeny. A kapcsolódás tehát
5’→ 3’ irányú, fordítva (3’→ 5’ irányban) nem jön létre. Eközben a nukleozid
5-trifoszfát α és β jelzésű foszfátja közötti kötés vízelvonás mellett
felszakad, a β és γ jelzésű foszfátot tartalmazó pirofoszfát szabaddá válik. Az
emberi DNS-polimerázok mindig csak a már meglévő nukleotidlánchoz kapcsolnak
újabb nukleotidot, két szabad nukleotidot nem képesek összekötni. A báziskivágó
javításban a POLβ, POLδ/ε és a POLλ, a párhibajavításban a POLβ, POLε vesz
részt
DNS-polimeráz-α (POLα) DNA polymerase alfa (DNA Pol α) a primáz enzimmel együttesen a késlekedő DNS-szál darabjait építi.
DNS-polimeráz-β (POLβ) DNA polymerase beta (DNA Pol β) a legkisebb polimeráz (39 kDa, 335 aminosav). Két gomolya van: a DNS-t képző polimeráz gomoly és a dezoxiribóz-foszfátot hasító liáz gomoly. Nincs benne a 3’→ 5’ keretolvasó exonukleáz. A polimeráz-X családba tartozik. Részt vesz a DNS-hiba báziskivágó javításában. (→DNS-hibák)
DNS-polimeráz-γ (POLγ) DNA polymerase gamma (DNA Pol γ) az energiatestecs (mitochondrion) DNS-ének képzésében vesz részt.
DNS-polimeráz-δ (POLδ) DNA polymerase delta (DNA Pol δ) negytagú enzimössztes: a DNS kettőződésében a vezetőszálat és a késlekedőszálat képezi. A négy alegysége a POL1, POL2, POL3 és a POL4, amelyeket a POL1, POL2, POL3, illetve a POL4 kódol.
DNS-polimeráz-ε (POLε) DNA polymerase epsilon (DNA Pol ε) törzsökös, négyegységes enzim, képezi a vezetőszálat, részt vesz a DNS-hiba báziskivágó javításában. (→DNS-hibák)
DNS-polimeráz-λ (POLλ) DNA polymerase lambda (DNA Pol λ) a DNS-hiba báziskivágó javításában vesz részt. (→DNS-hibák)
RNS-függő DNS-polimeráz RNA dependent DNA polímerase az RNS-ről képez DNS-t. Szokványos néven fordított transzkriptáz.
DNS-sokalakúság* DNA polymorphism valamely népesség legalább 1%-ában előforduló DNS-változat. (→sokalakúság)
egynukleotidos sokalakúság single nucleotide polymorphism, SNP egyetlen nukleotidot érintő változat a DNS egy adott pontján, amely valamely népességben gyakoribb 1%-nál. Az egynukleotidos sokalakúság, vagyis gyakori egynukleotidos változat, SNV. Másként: minden SNP tehát SNV is.
genetikai sokalakúság genetic polymorphism az a jelenség, amikor a DNS válzatainak (alleles) – vagyis valamely kromoszómahelyén lévő bázisnak/bázisoknak – különböző változatai valamely népességben – megegyezés szerint – az egyedek legalább 1%-ban előfordulnak.
Az 1%-os határ jogosultságát többen vitatják, mert a változat lehet ritkább is, és nem egyértelmű a genetikai sokalakúság és a genetikai hiba megkülönböztetésében.
Egy-egy egyedben nagyon sok DNS-változat fordul elő: két nem rokon egyed közötti genetikai változatok számát ~3 millióra becsülik.
A bázisváltozat lehet egyetlen bázis, báziskettősök vagy hosszabb bázissorok változata. Lehetnek a génben – annak különböző részeiben –, avagy a génen kívül. Ennek alapján megkülönböztetünk egybázisú, kétbázisú, több-bázisú sokalakúságot.
A genetikai sokalakúság messze nagy többsége láthatatlan, az egyedségben azok mutatkoznak, amelyek befolyásolják a fehérjeképződést; ilyenek lehetnek pl. a génekben, a szabályozó elemekben lévő bázisváltozatok, illetve azok, amelyek közvetve (pl. a fehérjék módosulásaiban) befolyásolják a fehérjéket.
egybázisú (egynukleotidos) sokalakúság single nucleotide polymorphism, SNP (angol kiejtése: snip). Egyetlen bázis cserélődéséből keletkező DNS-változat. Ez azt jelenti, hogy a két válzat (pl. génválzat) bázissorának egyi bázispárja különbözik.

A báziscsere lehet azonos (synonymous) és nem azonos (non-synonymous). Az előzőben két purin, illetőleg két pirimidin cserélődik egymással, az utóbbiban purin–pirimidin csere megy vég be. A génekben lévő purin–pirimidin csere rendszerint megváltoztatja a keletkező fehérje aminosav-összetételét, az azonos formájú változatok cseréje általában nem. Azokat az agynukleotidos sokalakúságokatt, amelyek megváltoztatják az aminosavsort, aminosavcserélő egybázisú sokalakúságnak* (non-synonymous single nucleotide polymorphisms, nsSNPs) nevezzük.
Az egynukleotidos sokalakúság a DNS bármely részén előfordulhat: a gének kódoló (~1%) és a nem kódoló részeiben, valamint a gének között.
▪ A génekben lévő SNP-k zöme nem változtatja meg az aminosavak összetételét. Még a képezőben lévő egynukleotidos csere sem jár törvényszerűen aminosav-változással, Ennek az a magyarázata, hogy az emberi DNS-ben 64 bázishármas kódol 20 aminosavat, azaz egy-egy aminosavat több bázishármas is képezhet (bázishármastöbblet). (→bázishármas)
▪ A kódoló és az átírást befolyásoló bázisokban lévők megváltoztathatják a gén kifejeződését, a fehérjék aminosavainak összetételét, a fehérjék közötti kölcsönhatásokat, előidézhetnek fehérjeátalakulásokat, hatással lehetnek a sejtműködésre, megnyilvánulhatnak az egyedségben*; például betegséget okozhatnak.
▪ A DNS más részeiben előfordulók rendszerint közömbös változatok, ám ezek között is lehetnek az egyedségre hatók, például betegségre hajlamosítók, vagy éppen a betegség kialakulását gátlók. A nem kódoló bázisok egynukleotidos sokalakúságának azt a formáját, amely befolyásolja a fehérjéket, kifejeződő egynukleotidos sokalakuságnak (expression SNP) nevezzük.
A DNS-ben ~10 millió egybázisú változat van; 100-300 bázisonként fordul elő. A genetikai sokalakúság ~90%-át ezek teszik ki, legtöbbször (háromból két esetben) a citozin cserélődik timinre.
Egy-egy génnek sokféle, akár 8–10 egynukleotidos változata is ismert; előfordulásuk eltérő a különböző népességekben; jellemzője lehet valamely népcsoportnak.
Az SNP-k meglehetősen állandók, megmaradnak nemzedékről nemzedékre, ezért népességi tanulmányokban jól követhetők, nagyon alkalmasak genetikai összefüggések tisztázására, pl. a genom betegségekkel összefüggő térképezésére, betegségre hajlamosító báziseltérésekre, genetikai jelleg meghatározására stb.
több-bázisú (többnukleotidos) sokalakúság nagyon sékféle lehet; jellegzetes pl. az ismétlet-sokalakúdág, a TATA-doboz sokalakúsága stb.
ismétlet-sokalakúság* repeat polymorphism valamely népességben gyakran (>1 százalékban) előforduló fej–láb ismétlet változata. Jelentős szerepe van a gének kifejlődésében. Alkalmazható a géntérképezésben és genetikai kapcsolódások elemzésében.
Lynch-kór hereditary non-polyposis colorectal cancer, HNPCC a párhibajavítás vagy a párhiba javítását szabályozó gének veleszületett rendellenességéből keletkező rákhajlam; az általános népességben 1/300−400 arányban fordul elő. Leggyakrabban vastagbélrák keletkezik, általában a jobb vastagbélben, és nem polipos eredetű. Innen kapta eredeti elnevezését: nem polipos örökletes végbél-vastagbélrák. A végbél-vastagbélrák az érintett férfiak több mint 90, a nők több mint 80%-ában alakul ki 75 éves korra. Nőkben a méhtestrák a második legtöbbször előforduló daganat; zömében mirigysejtes méhtestrák. A nem mirigysejtes méhtestrák ritka, és szinte mindig az MSH2 gén hibájából ered. A petefészekrák a betegek ~10%-ában alakul ki; leggyakoribb a méhhámszerű, a méhhámszerű részeket is tartalmazó kevert és a világos sejtes petefészekrák; általában 50 éves kor előtt keletkezik (átlagéletkor 45 év; az örökletes HR-hiányos petefészekrákoknál 5–10 évvel korábban is). Ezek leginkább helyben növekednek, ezért a legtöbbet korai állapotban ismerjük fel, és kórjóslatuk is kedvező: az általános túlélés 80%. Gyakori még a bőrrák, de előfordul gyomor-, vékonybél-, máj-, hasnyálmirigy-, emlő-, mellékvesekéreg-, hólyag- és húgyvezetékrák, továbbá agydaganat (glioblastoma) is. A daganatok kétféle társulását külön elnevezéssel illetik:
• Muir–Torre-tünetcsoport. Jellemzője a szemdaganatok (keratoakantoma, faggyúmirigyrák) előfordulása a fenti daganatokon kívül.
• Turcot-tünetcsoport; az agy- (meduloblastoma, strocytoma), továbbá a vastag- és végbéldaganatok együttes előfordulása jellemzi. Lehet HNPCC vagy APC (adenomatosus polyposis coli; familial adenomatous polyposis).
A párhibajavítási gének közül 70–90%-ban az MSH2 és az MLH1 gén hibája fordul elő, 10–30%-ban a PMS2 és az MSH6 gén másulása az oka. Az utóbbiaknál jóval enyhébb formában nyilvánul meg, és későbbi életkorban alakul ki. Oka az, hogy az MSH2- és az MLH1-génhiba következtében a párhibajavítás jóformán teljesen elmarad, mivel az MSH2 és MLH1 fehérje szerepét más fehérjék nem képesek ellátni. A PMS2 és az MSH6 fehérje feladatát az MLH3 valamelyest ellátja, ezért a helyreállítási folyamat némileg megmarad, olyannyira, hogy a PMS2 és MSH6 gén hibájából ritkábban keletkezik rák. Ritkán (3%-ban) a párhibajavításban nem résztvevő EPCAM gén csírasejtes hibájának a következménye: ugyanis az EPCAM gén 3’-végi örökletes hiánya következtében az MSH2 fokozottan metileződik, elnémul, és párhibajavítási hiány alakul ki.
Öröklődése testi kromoszómás és megnyilvánuló (hereditary autosomal dominant): a betegek egy ép és egy kóros válzatot örökölnek, és ha az ép válzat meghibásodik, elvész vagy gátlódik, például metileződés következtében, a DNS-hibák sokszorozódva keletkeznek, előszeretettel a mikroismétletek területén. A párhibajavító fehérje kiesése következtében nem javítódnak a mikroismétletek hibái, ezért a sejtek genetikailag ingataggá válnak (mikroismétlet-ingatagság*, microsatellite instability, MSI). A párhibajavítás-hiányos sejtekben halmozottan fordulnak elő az ismétleteknek az egy- vagy kétnukleotidos kereteltolódási (frameshift) hibái. A rák abból a sejtből keletkezik, amelyben az ismétlethiba a daganatképződésben résztvevő génnek a kódoló szakaszában van. (→ismétlet, válzat)
Kórismézés. A Lynch-kór megállapítását először a klinikai megnyilvánuláshoz kötötték, kidolgoztak háromféle feltételt, az Amsterdam-, Amsterdam-II- és a Bethesda-feltételt.
■ Amsterdam-irányelv: a vastag- és végbélrák családi halmozódására és az életkori megjelenésére szorítkozik. Legalább három vastag-végbélrák legyen a családban a következő feltételek szerint:
• A betegek közül legalább egy legyen elsőfokú rokonságban valamelyik másikkal.
• A betegség legalább két nemzedékben forduljon elő.
• Legalább egy beteg legyen 50 évnél fiatalabb a rák keletkezésekor.
• A FAP legyen kizárható.
• A rákot szövettanilag kell igazolni.
■ Amsterdam-II-ismérvek (nevezik módosított Amsterdam-ismérveknek is): figyelembe veszi az egyéb daganatokat és a szövettani jelleget is. Az Amsterdam-feltételtől csupán abban különbözik, hogy legalább három Lynch-tünetcsoporthoz köthető daganat forduljon elő a családban, tehát lehet másféle is, mint vastagbél-végbélrák.
■ Bethesda-ismérvek. Előírják a daganatsejtek vizsgálatát a mikroismétletekre (MSI; microsatellite instability) a következő esetekben:
• A vastag-végbélrák 50 évnél fiatalabb korban fordul elő.
• 50 évnél fiatalabb, elsőfokú rokonságban lévő daganatos betegeknél
• Kettő vagy több, első-, másodfokú rokonságban lévő érintetteknél
• Egyidejű és másidejű daganatoknál
A mikroismétletek kimutatása kórjelző. Az MSH6-hibás esetekben a mikroismétletek eltérései jóval ritkábbak, főleg a kétnukleotidosoké.
A Lynch-kóros személyek felismerésére a klinikai és családi ismérvekre alapozott módszer nem megfelelő, az érintettek 30–70%-át nem ismeri fel, ezért különböző szűrőmódszereket javasoltak. A legelterjedtebb a párhibajavítási fehérjék szöveti immunvizsgálata és a mikroismétletek PCR-vizsgálata.
▪ Az MLH1, MSH2, MSH6 és PMS2 fehérjék szöveti immunvizsgálata gyors és egyszerű módszer, és megbízható is. Ha valamelyik fehérjére teljesen negatív, szükséges a kódoló génjének vizsgálata.
▪ A mikroismétletek PCR-vizsgálata (polymerase chain reaction, PCR). Minden esetben szükséges a beteg daganatából és más szövetéből vett mintából is. Sokféle ismétletjelző (microsatellite marker) áll rendelkezésre, a vizsgálatokat mindig ötfélével végezzük. Az ismétlődő nukleotidok törlődése vagy beékelődése a DNS-szakasz hosszát csökkenti vagy növeli, jelezvén a bizonytalanságot. A PCR után a DNS-szakaszok méretét gélelektroforézissel határozzuk meg. A daganat különböző méretű PCR-termékeit összehasonlítjuk a szöveti mintákból vettekkel.
Azokat a daganatokat, melyekben két- vagy többféle ismétlet mérete eltér, nagyfokú mikroismétlet-ingatag daganatnak nevezzük (high frequency microsatellite instability, MSI-H). Amennyiben csak egy mikroismétletben van különbség, enyhefokú mikroismétlet-ingatag daganatról beszélünk (low frequency microsatellite instability, MSI-L). Ha nincs eltérés, mikroismétlet-biztosnak (microsatellite stable, MSS) mondjuk a daganatot.
Mivel a mikroismétletek PCR-vizsgálata a párhibajavítási gének működéséről tájékoztat, képes olyan ismétletingatag eseteket kimutatni, melyeknél a géneket érintő hibák nem változtatják meg a fehérje magi elhelyezkedését, így immunfestéssel nem mutathatók ki.
Az Amsterdam-II- és a Bethesda-irányelvek, a szöveti immunvizsgálat és a mikroismétletek vizsgálata valószínűsíti a Lynch-kórt; a végső kórisméhez nélkülözhetetlen a csírasejtes génhiba kimutatása bázispásztázással.
összlet* polymer soktagú egység, sok ismétlődő tagból álló nagymolekula, ekként hatásos; avagy azonos feladatott ellátó fehérjéket kódoló gének csoportja.
összletesedés* polymerization sokassá válás: egytagú molekulák ismétlődő egyesülése gyenge vagy erős kötésekkel.
PARP (poli(ADP-ribóz)-polimeráz) poly(ADP-ribose) polymerase, ADP-ribosyltransferase, poly ADP-ribosylated proteins a sejtmag egyik fehérjéje. 18 féle ismert (PARP1, PARP2 stb.); ezek fehérjecsaládot alkotnak. Hatféle PARP-ról tudjuk, hogy ADP-ribózt kapcsol a NAD+-ról a célfehérjéhez, egyet vagy akár több százat, kialakítva hosszú poli(ADP-ribóz)-láncot (PAR-lánc; poly(ADP-ribose) polymers); innen a poli előtag az enzim nevében. Ezt a folyamatot nevezzük PARilációnak (poly[ADP-ribosyl]ation; PARylation).
A család három tagja, PARP1, PARP2 és PARP3, vesz részt a DNS-javításban. A PARP DNS-javító enzim: az egyszálú DNS-töréshez kötődik.
▪ A PARP1 nagy mennyiségben van jelen a sejtmagban (106/sejtmag); az alaphisztonok PARilációjával fellazítja a kromatint, lehetővé téve a DNS kettőződését, a DNS-javítását vagy a génátíródást. Alapvetően vesz részt a DNS-hiba báziskivágó* javításában, és szabályozza a kétszálú DNS-törés hasonmás átrendeződéses*, valamint a nem hasonmás végegyesítéses* javítási folyamatait. Meghatározó szerepe van a génátíródásban: részben átíródási társtényező (transcriptional cofactor), másrészt gátolja sajátos bázisszakaszok metilezését; szabályozza a sejt genetikai egyensúlyát, energia folyamatait, és közreműködik a sejthalál parathanatosnak… nevezett sajátos formájában. Hat gomolya van: az N-végen három cinkujj gomoly (Zn1, Zn2, Zn3 [Zn = zinc fingers]), ezt követi az önPARiláló (AD) gomoly, majd a nyított kromatinnal kölcsönhatásba lépő (WGR) gomoly, a C-végen pedig a sarkallógomoly van. A cinkujj gomolyok közül kettővel kötődik a DNS-hez a DNS törési szögénél, tehát nem a nyítottá vált nukleotidhoz.
▪ A PARP2 tevékenysége hasonló, de csekélyebb: a PARP-működések 5–10%-át teszi ki.
▪ A PARP3 a sejtkörben szabályoz.
A PARP fehérjék háromféle gomolyt tartalmaznak:
• DNS-kötő gomoly (DNA binding domain, DBD). Az N-végen, három cinkujjmintázatból áll; kettő ismeri fel az egy- és kétszálú DNS-törés, és kapcsolja a PARP-ot, a harmadik szabályoz.
• Szerkezetalakító gomoly (automodification domain), amely sajátos glutamát és lizin aminosavakat tartalmaz, valamint kis BRCT gomolyt a DNS-t javító fehérjékkel való kölcsönhatáshoz.
• sarkallógomoly – a C-végen van,
Ha DNS-törés keletkezik, a PARP1 azonnal PARilálja önmagát, tevékennyé válik, és kapcsolódik a törés helyéhez az N-végén lévő mintázata segítségével. A kötődéssel (szerkezetváltozás) ötszázszorosára tevősödik a C-végén lévő sarkallógomoly, PARilálja a kromatin hiszton és nem hiszton fehérjéket és topoizomerázokat, szerkezetükben elektronkötési változást hoz létre. A PARilált fehérjéknek nemcsak működésük változik, de képessé válnak más fehérjék megkötésére is. A PARP1 autoPARilációjával a saját szerkezetét alakítja át, aminek következtében elválik a DNS-törés helyéről, lehetővé téve a helyreállító fehérjék kapcsolódását a töréshez, és a törés helyreállítást.
A PARP túlműködése felhasználja a sejt energiakészletét, sejthalálhoz vezet.
PcG fehérjék polycomb group (PcG) proteins géncsendesítő fehérjecsalád, a sejtfejlődés egyik szabályozója. A sejtelkülönülés, sejtérés folyamán szükségtelenné váló géneket némítják a H3 (hiszton) lizinjének (H3K27) metilezésével. Szerepük van a magzati fejlődésben, az X-kromoszóma némításában. A PcG fehérjék meghatározók a rákképződésben is; ennek irodalma tetemes, de számos részlet tisztázatlan. (→BMI1, CBX, EED, EZ1/2, PHC, RbBP, Ring, SUZ, ubiquitin)
PRC-össztes* polycomb repressive complex, PRC a PcG fehérjék kromatinhoz kapcsolódó együttese, amelyhez rendszerint más fehérjék is társulnak. A PcG fehérjék szokásosan ekként tevékenykednek. A PcG-összteseket hatásuk szerint három csoportba (cPRC1, ncPRC1, PRC2) sorolják.
▪ PRC1 polycomb repressive complex 1. Alapösszetevői: Ring1A/B és a PGGF1–6 (PcG ring-finger domain proteins) valamelyike. Két alcsoportjuk van: a cPRC1 (canonical PRC1, alapformájú) és az ncPRC1 (non canonical PRC1, nem alapformájú). A cPRC1 tartalmaz még kétféle fehérjét, a CBX2/4/6/7/8 (Pc homologs-Chromobox protein) és a PCH1–3 (polyhomeotic homologous protein) valamelyikét. A PRC1 Ring1A/B enzime ubiquitinezi a H2AK119-et; a H3K27me3 mintázatot ismeri fel. Az ncPRC1 tartalmazza még az RYBP (YY1-binding protein) vagy a YAF2 (YY1-associated factor 2) fehérjét, egy ubiquitint köt a H2AK119-hez (H2AK119ub1).
▪ PRC2 polycomb repressive complex 2 a H3 hiszton 27-es lizinjét metilezi (H3K27me). Összetevői: EZH1/2 (enhancer of zeste), SUZ12 (suppressor of zeste), EED (embryonic ectoderm development) és RbBP4/7 (retinoblastoma binding protein; nevezik RbAP46/48-nak is). Az EZH2 a fő metilező enzim (hiszton-metil-transzferáz); elsősorban a burjánzó sejtekben képződik – az EZH1 főleg a nem osztódókban. Az EED ismeri fel a metilezési helyet, a SUZ12 serkent és biztosítja az össztes állandóságát, a RbBP pedig kapcsolódik a magtestecshez. Számos más fehérjével (EPOP, PALI1, JARID2, AEBP2, PCL1–3) vannak kölcsönhatásban.
A PRC2 kapcsolódik a kromatinhoz, és az EZH2 enzimével három metilcsoportot kapcsol H3K27-hez (H3K27me3). Ezt ismeri fel a PRC1-ben lévő CBX, így kapcsolódik hozzá. A PRC1 E3-ligáza (Ring1/2) ubiquitinezi a H2A-t a K119-en, aminek következtében a kromatin tömörödik és szünetel az RNAPII tevékenysége. Az EZH2 nemcsak a kromatin metilezésével fékezi az átíródást, közvetlenül a DNS-t is metilezi.
polimeráz polymerase nukleinsavat (RNS-t vagy DNS-t) képező enzim, nukleotidokat kapcsol össze foszfodiészter-kötéssel. A polimerázok több alegységből álló fehérjék; alegységeik fajtánként némileg eltérnek. Általános értelemben a polimeráz soktagú molekulát (polymer) képező enzim. Sokféle polimeráz ismert; két nagy csoportjuk a mintafelülettől függő (DNS-, RNS-polimeráz) és független polimeráz (pl. Poli-A-polimeráz). A DNS-polimeráz DNS-t másol a DNS-ről, az RNS-polimerázok pedig különböző RNS-t készítenek a DNS-szálról, vagy RNS-t másolnak. (→DNS-polimeráz, RNS-polimeráz)
polimeráz-láncfolyamat (PCR) polymerase chain reaction, PCR laboratóriumi módszer valamely DNS-szakasz sokszorosítására. Veleje: a kétszálú DNS-szakasz szétválasztása, a cél DNS-szakasz kijelölése rövid indítószálakkal (primerek), és DNS-képzés az egyszálú kijelölt DNS-szakasz polimerázzal való másolásával. A folyamat nagyon gyors, és sokszorosan ismétlődik, másolatok sokasága keletkezik.
PRC-össztes* polycomb repressive complex, PRC (→PcG fehérjék)
RNS-polimeráz RNA polymerase, RNAP (POL) az RNS-t képző enzim. Két alapformája a DNS-függő és az RNS-függő RNS-polimeráz. Az előbbi a DNS-t, az utóbbi az RNS-t használja mintafelületnek.
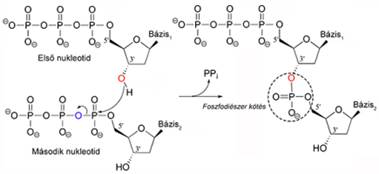 DNS-függő RNS-polimeráz DNA dependent/directed RNA polymerase, DdRP DNS-ről RNS-t képző enzim; egyszálú DNS-t másol, az
átírt nukleotidokat köti össze foszfodiészter-kötéssel. Képes összekapcsolni az
első nukleotidot a másodikkal, miként a továbbiakat is; tevékenységéhez tehát
nem szükséges indítószál (primer).
DNS-függő RNS-polimeráz DNA dependent/directed RNA polymerase, DdRP DNS-ről RNS-t képző enzim; egyszálú DNS-t másol, az
átírt nukleotidokat köti össze foszfodiészter-kötéssel. Képes összekapcsolni az
első nukleotidot a másodikkal, miként a továbbiakat is; tevékenységéhez tehát
nem szükséges indítószál (primer).
A másolódott nukleotid 5’-végén trifoszfát, 3’-végén OH-csoport van. A polimeráz ezeket kapcsolja össze. Az ábra az elsőként és másodikként másolódott nukleotidot mutatja. A második trifoszfátjából két foszfor (pirofoszfát) hasad le; így jön létre a kötés. Az elsőn megmarad a trifoszfát.
A DNS-hez az átírásfehérjék toborozzák a polimerázt; önmagában nem képes a bázissorok megkülönböztetésére. Nincs nukleáz működése, ezért az RNS-képződés esetleges hibáit nem javítja ki. Ennek azonban nincs nagy jelentősége, mert általában egyszerre nagyon sok szabályos RNS is képződik, és így egy-két hibás RNS hatása gyakorlatilag nem jut kifejezésre. Ám, ha sok a hibás RNS, sejtműködési zavar keletkezik.
A DNS-függő RNS-polimerázoknak többegységes és egyegységes formája is van; szokványosan az előbbieket nevezzük egyszerűen RNS-polimerázoknak. Az emberi sejtekben az egyegységes forma az energiatestecsekben, a többegységes a sejtmagban fordul elő. Az utóbbinak három formája ismert, az RNS-polimeráz-I, -II, -III. Ezek laboratóriumi megkülönböztetésére a gyilkos galóca mérgét (α-amanitin) használják: a méreg az RNS-polimeráz-II-t megbénítja, az RNS-polimeráz-III-at csak részben gátolja, az RNS-polimeráz-I-et pedig egyáltalán nem. Az mRNS-t csak az RNS-polimeráz-II írja át.
Egyegységes RNS-polimeráz single-subunit RNA polymerase (Egyéb nevek: ssDdRP, POLRMT, T7 RNS-polimeráz) a baktériumokat támadó bizonyos vírusok (phage 7) jellegzetes polimeráza, az emberi sejtekben az energiatestecsekben van jelen. Az energiatestecsi DNS-t írja át járulékos átírásfehérjék (TFAM, TFB2M) segítségével. Főleg az energiaigényes szövetekben (szív, agy, vese) van jelentősége: ezekben az RNS-ek 10–30%-át ezek adják. Átírási hiba zavart kelthet az energiatestecsek működésében.
Többegységes RNS-polimerázok multiple-subunit RNA polymerases
▪ RNS-polimeráz-I (RNA polímerase I, RNAP I) a sejtmagvacskában található, a 47S elő-rRNS-t képezi, amely 18S, 5,8S és a 28S rRNS-ekké alakul. Ezek és a polimeráz-III által másolt 5S RNS alkotja a ribotestecs RNS összetevőjét. A polimeáz-I kizárólag az rRNS-gének (multicopy rRNA genes) átírására képes enzim, és az átírások ~70%-át végzi. Szabálytalan működése rák és rRNS-ártalmak kialakulásához vezet. A rákelleni kezelés egyik célfehérjéje is lehet.
▪ RNS-polimeráz-II (RNA polimeráz II, RNAP II) az elő-mRNS-t átíró enzim, de másol kis magi RNS-eket is (pl. piRNS). Az emberi polimeráz-II 12 törzsökös alegységből (RPB1–12) álló, 550 kDa tömegű fehérje. A sarkalló törzsegysége mellett a legnagyobb alegysége a CTD gomolyt (carboxi terminal domain) tartalmazó RBP1, amely a C-végen lévő enzim. A POLR2A gén kódolja. Ez kapcsolja össze az RNS átíródásának és érésének folyamatát, fontos szerepe van az átírás indításában is. Jellegzetes a hetes (Tyr1, Ser2, Pro3, Thr4, Ser5, Pro6, Ser7) ismétletekből álló mintázata; ez érzékeli a jelzéseket, és elősegíti a fehérjék kötődését a hisztonok módosítására. Csak az átírásfehérjét kötött indítóhoz kétes kapcsolódni. (→indító)
▪ RNS-polimeráz-III a szállító RNS (tRNS) és a kis sejtmagi RNS-ek (snRNS) többségét képezi, elemi tartozéka az RNS-szikének.
RNS-függő RNS-polimeráz RNA dependent/directed RNA polymerase, RdRP, RNA-replicase RNS-t RNS-ről, nem DNS-ről átíró enzim. RNS-mintafelületről készíti annak kiegészítő másolatát. Így sokszorozódnak az RNS-vírusok, de előfordul magsejtűekben is (cellular RdRP, cRdRP).
single nucleotide polymorphism (SNP) →egynukleotidos sokalakúság
SNP ( single nucleotide polymorphism) →egynukleotidos sokalakúság
sokalakúság polymorphism (polimorfizmus)
a biológiában a DNS bázisainak (nukleotidjainak) valamely népcsoport (faj)
egyedeiben fellelhető olyan változatai, amelyek a népesség legalább 1%-ában
fordulnak elő. Általában genetikai sokalakúságnak nevezzük. (→genetikai sokalakúság)
szálelcsúszás* replication slippage, polymerase slippage a másolódó DNS-szál szemernyi részének eltávolodása a polimeráztól. Előfordul ugyanis, hogy a másolódó szál és a polimeráz a másolás közben eltávolodik egymástól, de csak egy villanásnyira, mert a polimeráz azonnal újra kapcsolódik a DNS-szállal az eltávolodást követően, avagy visszafelé az eltávolodás kezdete előtt. Ha az újratársulás az eltávolodást követi, kimarad néhány bázis, legtöbbször egy vagy több ismétlet másolódása, a másolt szálon kevesebb bázis (ismétlet) lesz (bázisvesztés). Ha visszafelé társul ismét, egynéhány bázist (általában ismétletet) kétszer másol, a másolt szálon több bázis (ismétlet) lesz (bázistöbblet). Ekként INDEL keletkezhet, de nagyobb DNS-szakaszok is kettőződhetnek, törlődhetnek.
A DNS-polimeráz meglehetősen pontosan másol; a hibaarány másolódásonként egy bázisra vonatkoztatva 10−5. A hibát a polimerázzal társult exonukleázok (polymerase-associated 3 → 5·proofreading exonucleases) azonnal javítják, ekként az arány 10−6–10−7-re csökken. A még megmaradt hiba a párhibajavítással állítódik helyre; végül is a hibaarány 10−9, vagyis a hiba rendkívül ritka, de mégis előfordul, hogy belőle INDEL keletkezik – leginkább az ismétletekben létrejövő szálelcsúszásból eredően. (→DNS-kettőződés)
többgénes öröklődés polygenetic inheritance, quantitative inheritance olyan jelleg öröklődése, amelyet két vagy több gén határoz meg. Mindegyik kifejeződik, az általuk kódolt fehérjék együtt hozzák létre az egyedségi jelleget, például a testmagasságot, vérnyomást, értelmi képességet; ezekben számos gén által kódolt fehérje vesz részt, a hatásuk összeadódik. A keletkezett jellegnek számos változata lehetséges; a változatok folyamatosak, és számszerűsíthetők, például a magasságot cm-ben fejezzük ki.