biopsy mintavétel ■ core biopsy hengeres/vastagtű mintavétel ■ fine needle biopsy vékonytű mintavétel ■ random biopsy véletlen mintavétel ■ Tru-Cut biopsy hengeres/vastagtű mintavétel (→mintavétel)
Találatok alcímszavakban (1 szócikk):
Részleges egyezések (76 szócikk):
alkalmi vércukorvizsgálat random, causal plasma glucose test / blood sugar, RBS (→vércukorvizsgálat)
ASCL1 (achaete-scute family bHLH transcription factor 1) csavarodás-hurok-csavarodás mintázatú (basic helix-loop-helix, bHLH) átírásfehérje; amely az E-dobozhoz kötődve serkenti az átíródást. Képződik az agyban, gyomorban és a légutakban is. Az ASCL1 gén kódolja. A gén a 12-es kromoszómán van; másulása közrejátszik a congenital central hypoventilation syndrome (CCHS) kialakulásában.
átcserélés* transversion a genetikában purinbázis helyettesítése pirimidinbázissal és fordítva.
átfordítás translation (transzláció)
az mRNS polipeptiddé alakítása.
átfordítási olvasáskeret translational reading frame (→olvasáskeret)
átfordításkövető módosítás post-translational modification az mRNS átfordításából keletkezett eredetfehérje módosítása. (→fehérjemódosítás)
átírás transcription (→génátírás)
átírásfehérje* transcription factor (TF) a DNS-hez vagy RNS-hez kötődő, azok működését szabályozó fehérje.
■ A DNS-hez kapcsolódó átírásfehérje a gének átíródását irányítja (ki-bekapcsolás, fokozás, gátlás): kapcsolja a polimerázt a DNS-hez, és kölcsönhatásban áll a szabályozó fehérjékkel. Leginkább az indítóhoz és egy szabályozó DNS-szakaszhoz, pl. az fokozóhoz fűződik. Egyféle átírásfehérje több, rendre azonos feladatot ellátó génhez is kapcsolódhat.
Jellegzetessége, hogy legalább egy sarkalló- (DNA activation domain) és egy DNS-kötő gomolya (DNA-binding domain, DBD) van. Az utóbbi fajlagosan fűződik a DNS (a szabályozandó gén) 8–20 bázisnyi törzsökös mintázatához (sequence-specific DNA-binding factor), amely az indítómagban van. A sarkallógomolyok szerkezete viszont egyszerű, ezért ezeket az aminosavak elosztása szerint jellemzik, megkülönböztetve prolin-, szerin/treonin, glutamingazdag stb. gomolyokat.
Az átírásfehérjék biztosítják, hogy a gének átíródása a megfelelő sejtben, időben és mértékben menjen végbe. Nagyjából 2600-féle ismert; csoportosításuk a DNS-kapcsolódási gomolyuk szerinti, pl. cinkujj mintázati átírásfehérje. (→gomolyok) Az emberi DNS-ben ~2000 átírásfehérje által irányított gén van. Az átírásfehérjék zöme csak a célgénhez kapcsolódhat: az indítóhoz általános, a szabályozó bázissorokhoz sajátos átírásfehérjék társulnak. Azonban van olyan is, amely képes a magtestecskén lévő DNS-hez kötődni (úttörő átírásfehérje*).
általános átírásfehérje* general transcription factor, GTF (más néven: alapvető átírásfehérje, basal transcription factor) az indítómag fajlagos mintázatához kötődő, a polimerázt toborzó és az RNS képzést a megfelelő helyen indító átírásfehérje. Pl. az RNS-polimeráz-2 általános átírásfehérjéi a TFIIa, TFIIb, TFIId, TFIIe, TFIIf és a TFIIh.
úttörő átírásfehérje* pioneer factor a magtestecskén lévő DNS-sel kapcsolódó átírásfehérje. Ezeknek a fehérjéknek sajátos adottsága, hogy a néma, kromatinba ágyazott génekkel képesek kapcsolódni, és azokat beindítani, szerkezeti változásokat kiváltva a kromatinban. A törzsfejlődésben, a sejtek átalakításában van szerepük.
■ Az RNS-hez kapcsolódó átírásfehérje sajátsága az RNS-kötő gomoly.
Az átírásfehérjét szokásosan TF-fel jelöljük, ezután római számmal az általa kapcsolt polimeráz fajtáját írjuk. Például: TFII (a polimeráz-II-t kötő átírásfehérje [RNAP2; RNA polimerase 2]), TFIII (a polimeráz-III-at kötő átírásfehérje [RNAP3]). Ezek változatait tartozékbetűkkel azonosítjuk (TFIIb, TFIId, TFIIe, TFIIf, TFIIh, TFIIIa).
átíráskezdethely transcription start site, TSS (→indító)
átíráskövető módosítás, szabályozás post-transcriptional modification/regulation
átirat transcript az az RNS-bázissor, amely a DNS-ről, ritkán RNS-ről másolódott. Semmiféle módosítás nem történt rajta. Ha módosult, termék a neve.
átíróegység transcription unit a gének átíródását végző fehérjék: átírásfehérjéből és a polimerázból áll. (→génátírás, génátírási folyamat)
átváltás* transition a genetikában purinbázis helyettesítése purinbázissal, illetőleg pirimidinbázis helyettesítése pirimidinbázissal. A purin–purin, pirimidin–pirimidin átváltás aminocsoport eltávolításával jön létre; így keletkezik uracil a citozinból, hipoxantin az adeninből stb. Az átváltás génhiba.
chromatogranin-A, CgA a granin fehérjecsalád tagja, savas vegyhatású, 49 kDa tömegű polipeptidlánc. Szemcsék formájában raktározódik peptidekkel és aminokkal együtt, főleg a hormonsejtekben, de megtalálhatók a hámsejtekben, immunsejtekben és a környéki idegsejtekben is. A hormonsejtek és az ideg-hormonsejtek választják ki a keringésbe. Ideg-hormonsejtes daganatokban nagyobb mennyiségben keletkeznek, szérumszintjük emelkedik, ezért daganatjelzőként elterjedten használjuk: a szérummennyiségét mérjük.
cortical granules →kérgi szemcsék
csökkent cukorellenállás* impaired glucose tolerance, IGT nevezik cukorbaj előtti állapotnak (prediabetes) is. Olyan állapot, amelyben a vércukorszínt emelkedett, de nem annyira, hogy cukorbajt kórismézhetnénk; csak vércukorterheléssel állapítható meg. Értéke: éhomi 7 mmol/l-nél kisebb, a terhelés utáni kétórás érték 7,8 – 11,1 mmol/l. Jellegzetes tünetei nincsenek, maradhat észrevétlen, ezért érdemes – főleg időseknél – egyszer-egyszer ellenőrizni a vércukorszintet. Veszélye, hogy előbb-utóbb átalakulhat 2-es formájú cukorbajjá. Rendszerint a hasnyálmirigy β-sejtjeinek csökkent működése miatt alakul ki. Hasonlóan az inzulinérzéketlenséghez, a túlsúly, kövérség, mozgáshiány, 45 év feletti életkor, családi hajlam, magas vérnyomás, agy- és szívérrendszeri károsodás; nőknél terhességi cukorbaj előfordulása és soktömlős petefészekbaj hajlamosítanak a kialakulására. A megfelelő (kevés cukros vegyes) étkezés, rendszeres mozgás és a súlyfelesleg leadása gátolja a keletkezését. A csökkent cukorellenállás népbetegség: hozzávetőlegesen minden harmadik felnőtt érintett.
Megjegyzés: az IFG-t és az IGT-t egyaránt cukorbaj előtti állapotnak (prediabetesnek) tartják.
DNS-metil-transzferáz (DNA methyltransferase, DNMT) fehérjecsalád, amelynek három tagja, a DNMT3A, DNMT3B és a DNMT1 metilezi a DNS-t. A DNMT3A és 3B főleg a korai fejlődés szakaszában működik, a sejtosztódások S-szakaszában leginkább az DNMT1 tevékenykedik. DNS-metil-transzferáz a metilcsoportot DNS citozinjának 5-ös szénatomjához csatolja az S-adenozil-metioninról, és 5-metil-citozin keletkezik. (→DNS-metilezés)
A metilcsoportot a ten-eleven translocation (TET) enzimcsalád három tagja, TET1, TET2 és TET3 távolítja el: elektront von el az 5-metil-citozinból. A TET és a DNMT fehérjék szerkezete nagyon hasonló, ezért nevezik őket DNS-metilező íróknak és törlőknek (DNA methylation writers, erasers).
DNS-szál DNA strand a DNS egyik fele: nukleotidok (dezoxiribózok, foszfát és bázis) foszfodiészter-kötéssel kapcsolódott hosszú sora. Két DNS-szál gyenge kötésekkel egymás köré tekeredve alkotja a DNS-t. A DNS-folyamatokban a két szál átmenetileg elválik; feladatuk szerinti megkülönböztetésükre más az elnevezésük. A génátírásban azt a DNS-szálat, amelynek bázissorrendje megegyezik az RNS bázissorrendjével, kódoló vagy pozitív (sense, értelmes) szálnak nevezzük, a mintául szolgáló pedig a negatív (antisense, értelmetlen) szál. Ez utóbbi másolódik, ezért mintaszálnak is mondjuk. A kódoló DNS-szál a másolódott szál, vagyis az RNS. A DNS-kettőződésben a másolódó, vagyis a minta DNS-szálat szülői, a másolódott szálat pedig leány DNS-szálnak nevezzük.
DP ( dimerization partner) fehérjék transcription factor DP fehérjecsalád, átírásfehérjék. Az E2F fehérjékhez kötődnek, kettőst képezve (innen kapták a nevüket) tevékenyek. Az emberi sejtekben háromféle fordul elő: a DP1, a DP2 és a nem régen felfedezett DP3. A DP1 és DP2 serkentő: az E2F–DP1/2 kettősként kapcsolódnak a célgének indítójához, és fokozzák a gének átíródását. A DP3 gátló hatású. A sejtkör és a sejtvégzet szabályozásában vesznek részt.
durranógáz két rész hidrogénből (H2) és egy rész oxigénből (O2) álló gázelegy, amely robbanásveszélyes. A durranógáz vízzé alakulásával (durranógáz-vegyülés) energia szabadul fel. A vegyülésben két hidrogénmolekula és egy oxigénmolekula vegyül egymással és két vízmolekula keletkezik ( 2 H2 + O2 → 2 H2O + energia). A durranógáz hajtóereje nagy (1,23 V); a hidrogén és oxigén 2:1 arányú elegye meggyújtva robban.
ellentett átíródás reverse transcription az átírásnak, vagyis a DNS-ről való RNS képződésének a fordítottja: az RNS átírása DNS-sé. A visszugrálatokban és a retrovírusokban megy végbe a fordított transzkriptáz hatására. (→retrovírus, ugrálat)
előcukorbajLL impaired glucose tolerance, IGT, prediabetes; nevezhetjük csökkent cukorellenállásnak* is. Olyan állapot, amelyben a vércukorszínt emelkedett, de nem annyira, hogy cukorbajt kórismézhetnénk; csak vércukorterheléssel állapítható meg. Értéke: éhomi 7 mmol/l-nél kisebb, a terhelés utáni kétórás érték 7,8–11,1 mmol/l. Jellegzetes tünetei nincsenek, maradhat észrevétlen, ezért érdemes – főleg időseknél – egyszer-egyszer ellenőrizni a vércukorszintet. Veszélye, hogy előbb-utóbb átalakulhat 2-es formájú cukorbajjá. Rendszerint a hasnyálmirigy β-sejtjeinek csökkent működése miatt alakul ki. Hasonlóan az inzulin-érzéketlenséghez, a túlsúly, kövérség, mozgáshiány, 45 év feletti életkor, családi hajlam, magas vérnyomás, agy- és szívérrendszeri károsodás; nőknél terhességi cukorbaj előfordulása és soktömlős petefészekbaj hajlamosítanak a kialakulására. A megfelelő (kevés cukros vegyes) étkezés, rendszeres mozgás és a súlyfelesleg leadása gátolja a keletkezését. A csökkent cukorellenállás népbetegség: hozzávetőlegesen minden harmadik felnőtt érintett.
Megjegyzés: az IFG-t és az IGT-t egyaránt előcukorbajnak tartják.
EMSY (BRCA2-interacting transcriptional repressor EMSY) Átírást szabályozó fehérje; az EMSY gén (11q13-11q14) kódolja. Kisagyban, tüdőben, emlőben, petefészekben, méhben és bőrben képződik. A kromatinalakító együttesben* (chromatin remodeling complex) gátolja, a H3- (hiszton-3-) fajlagos metil-transzferáz együttesben fokozza a génátírást. A BRCA2 átíródásának gátlásával nehezíti a DNS-hiba kijavításában. Szerepe van a gyulladásokban is: az AKT1 (fehérje-kináz) szabályozza az interferonválaszt az EMSY foszforilezésével.
ESCRT ( endosomal sorting complex required for transport) elosztóössztes, amely – járulékos molekulák közreműködésével – képes a sejt hártyáit úgy alakítani, hogy belőlük apró hólyagocskák váljanak le a sejtplazmával ellentétes irányban. Részt vesz a sokhólyagcsás test (beltestecs) kialakításában, a sejtek szétválásában a sejtosztódás legvégén (citokinezis), valamint a burkos vírusok (például a HIV vagy a SARS-Cov2) leválásában a sejt felszínéről a külső térbe – ezek a vírusok így jutnak külső, buroknak nevezett hártyájukhoz (viral budding).
Ötféle ESCRT össztes ismert (ESCRT0, -1, -2, -3 és a VPS4 [ vacuolar protein sorting] össztes). Az ESCRT0 a VPS27, vagy más néven HRS (HGF-regulated tyrosine kinase substrate) és a HSE1 - emberben STAM (signal transducing adaptor molecule) kettőséből tevődik össze; ezeket a GAT gomoly kapcsolja egybe. 5 ubikvitin megkötésére képes. Az ESCRT1 a TSG101-ből, valamint a VPS28, VPS37 és MVB12 egységből áll. 25 nm hosszú pálcika alakú. Az ESCRT2 négy fehérjéből tevődik össze, egy VPS36, egy VPS22 fehérjét és egy VPS25–kettőst tartalmaz. Mindegyik eddig felsorolt össztes a sejtplazmában található állékony együttes. Az ESCRT3-ban négy fehérje (VPS20, SNF7, VPS24és VPS2) és 3 járulékos rész (DID2, VPS60 és IST1) található. Ezek átmenetileg társulnak a beltestecs felszínén és a belső hólyagcsák végső kialakításában van szerepük. A VPS4 együttes az 1-es AAA-ATPáz VPS4-ből és a VTA1 társtényezőjéből áll; az ESCRT3 kapcsolja a beltestecshez.
Az ESCRT0 indítja a sokhólyagcsás test kialakítását: kapcsolódik a PI3P-hez, és ubikvitinkötő gomolyaival maga köré csoportosítja az ubikvitinnel jelölt, így lebontásra ítélt hártyafehérjéket, továbbá kapcsolja az ESCRT1-et, amelyik szintén köt két ubikvitinjelzett fehérjét. A hártyához kötődő ESCRT1 kapcsolja az ESCRT2-t, amely ugyancsak köt ubikvitint, és kapcsolódik PI3P-hez is, így rögzíti az együttest. A fonalas szerkezetű ESCRT3 az ESCRT2 VPS36 gomolyához kapcsolódva rendezi a fehérjéket és alakítja ki a belső hólyagocskát. (→beltestecs)
étkezés utáni vércukorvizsgálat 2-hour postprandial blood sugar test (→vércukorvizsgálat)
fehérjemódosítás* (más néven: átfordításkövető módosítás) post-translational protein modification az eredetfehérje (az átfordítással keletkező vonalas fehérje) szerkezeti változtatása, aminek következtében megfelelően hajtékolttá és tevékennyé válik. Ez határozza meg a fehérje helyét a szervezetben és a feladatát. A működőképes fehérjét kialakító fehérjemódosítás a sejtcsövecsezetben megy végbe; magában foglalja a hajtékolást, a hatáscsoport, szénhidrát, lipid stb. kapcsolását, S–S- és más kötések kialakulását, fehérjehasítást, acetilezést, foszforilezést, metilezést stb. Több mint százféle módosítás ismert, utalva ennek fontosságára.
fonák transzkriptáz (riverz
transzkriptáz) reverse
transcriptase (egyéb elnevezése: RNA directed DNA polymerase) a
retrovírusok különleges enzime: DNS-polimeráz és ribonukleáz-H (RNáz-H) hatású
gomolya van, mindkettő alapvető az RNS–DNS átalakuláshoz. Az RNáz-H gomoly
endonukleáz, az RNS-t vágja le a rövid DNS–RNS kettősről. A polimeráz gomoly
másolja a bázisokat. A fornák traszkriptáz alakítja át a vírus-RNS-t DNS-sé. A
retrovírus képezi. Részt vesz a hepadnavírusok életfolyamataiban. Jelentős
laboratoriumi vizsgálatokban is, pl. PCR (polymerase chain reaction).
(→belretrovírusok, hepadnavírus, retrovírus)
génátírás transcription a DNS génszakaszának átírása RNS-sé; az RNS bázissorának kialakítása az adott DNS-szakasz bázissora szerint. Azonos a génműködés fogalmával. A fehérjét képező gének átíródásából elő-mRNS, a fehérjét nem kódolókból nem fehérjeképező RNS-ek (noncoding RNAs) keletkeznek.
Az RNS bázissora mindig az adott DNS-szakasz (gén) kettős szálának egyikéről másolódik. Azt a DNS-szálat, amely átíródik, mintafelületnek (template) nevezzük. Mivel csak kiegészítő bázisok kapcsolódhatnak egymással, az RNS bázissorrendje teljesen azonos lesz az adott gén másik DNS-szálának bázissorrendjével, azzal a különbséggel, hogy a timin helyett az RNS-be mindig uracil épül be. Megegyezés alapján azt a DNS-szálat, amelynek bázissorrendje megegyezik az RNS bázissorrendjével, kódoló vagy pozitív (sense, értelmes) szálnak, a mintául szolgáló pedig negatív (antisense, értelmetlen) szálnak mondjuk. Egy gén bázissorrendjének leírásakor a kódoló DNS-szál bázissorrendjét adjuk meg (5’–3’ irányban), mivel ez határozza meg a fehérjeképződést.
Egyes gének kódoló szála a DNS-lánc egyik szálán, más géneké a DNS-lánc másik szálán van, attól függően, hogy a gén a DNS-ben milyen irányultságú. Egy-egy génben azonban mindig ugyanaz a szál íródik át; nem fordul elő, hogy egyazon génnek egyszer az egyik DNS-szála a kódoló, másszor a másik.
A génátíráskor a polimeráz folyamatosan írja át a gént újra és újra a sejt szükséglete szerint. Ezt irányító rendszerek (erősítők, csendesítők stb.) szabályozzák
génátirat* transcript (→átirat, génátírás, génkifejeződés)
génműködés azonos a génátírás (transcription) fogalmával
génalulműködés a gén csökkent átíródása. A gén átíródik, de nem a szükséges mértékben.
génátirat transcript a génátírásból keletkező elsődleges RNS.
génnémulás a gén egyáltalán nem íródik át.
géntúlműködés fokozott génátíródás. (→génátírás, génkifejeződés)
G-fehérje-kapcsolt jelfogó G protein-coupled receptor, GPCR (egyéb nemzetközi nevei: seven-(pass)-transmembrane domain receptor, 7TM receptors, 7 membrane spanning, heptahelical receptor, serpentine receptor, G protein-linked receptors, GPLR). A hazai irodalomban használatos a 7TM-jelfogó (7 transmembrane [7TM] domain) elnevezés is.
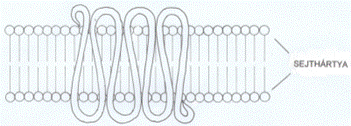 A 7TM-fehérjék a külső és belső felszínen hurkokkal
összekapcsolt hét sejthártyán áthaladó α-csavarulattal rögzülnek a
sejthártyában; ezen kívül a polipeptid lánc mindkét vége is hurkot formál - az
N-vég a sejten kívül, míg a C-vég a sejten belül található. A sejthártyán
kívüli rész köti a jelvivőt, a sejtbe nyúló hurkok közül kettő pedig a
háromalegységes G-fehérje α-alegységét; ez utóbbi esemény általában akkor
következik be, amikor a jelfogó gerjesztődik a jelvivő hatására, de az is
előfordul, hogy a G-fehérje a jelfogó tevőtlen állapotában is hozzá kapcsolt..
(Az ábrát Teleki Katalin készítette.)
A 7TM-fehérjék a külső és belső felszínen hurkokkal
összekapcsolt hét sejthártyán áthaladó α-csavarulattal rögzülnek a
sejthártyában; ezen kívül a polipeptid lánc mindkét vége is hurkot formál - az
N-vég a sejten kívül, míg a C-vég a sejten belül található. A sejthártyán
kívüli rész köti a jelvivőt, a sejtbe nyúló hurkok közül kettő pedig a
háromalegységes G-fehérje α-alegységét; ez utóbbi esemény általában akkor
következik be, amikor a jelfogó gerjesztődik a jelvivő hatására, de az is
előfordul, hogy a G-fehérje a jelfogó tevőtlen állapotában is hozzá kapcsolt..
(Az ábrát Teleki Katalin készítette.)
Ez a legnagyobb jelfogócsalád, emberben 800-nál több génváltozatot ismerünk. Az általuk kötött jelvivők szintén igen változatosak: a fotontól (rodopszin) az ionokon (H+, Ca++), a kis molekulákon (odor- [szaglás-] molekulák) és a lipideken át a viszonylag nagy polipeptidekig (FSH, LH, trombin, WNT) terjed. A 7TM-jelfogókat öt alcsaládba (rodopszin-, szekretin-, glutamát-, adhéziós és a Frizzled típusú receptorok) sorolják. Az általuk indított jelközvetítések egymásba is kapcsolódnak, behálózzák az egész sejtet.
GLUT4 (glucose transporter type 4) ([solute carrier family 2, facilitated glucose transporter member 4]; glükozszállító-4) glükózt szállító fehérje, leginkább a zsír- és izomsejtekben van.
Viszonylag egyszerű fehérje; az N-végen fenilalanin és két leucin van, a COOH-végen savmintázat. Ezek segítik elő a cukor szállítását a sejthártyán át. Található benne UBX gomoly, amelynek a jelközvetítésben van szerepe. Az SLC2A4 (solute carrier family 2 member 4) gén kódolja; a 17-es kromoszómán helyezkedik el.
A GLUT4 a sejtplazmától elkülönülve, tároló hólyagcsában (GLUT4 storage vesicle) található. A hólyagcsa a mag körül helyezkedik el a sejt tubo-vesicularis hálózatába építve, és kapcsolatban az endosomalis trans-Golgi hálózattal. A GLUT4 a sejthártyától nyúló actinfonallal (actin filament) van összekötve; ennek az összehúzódásával jut a sejthártyához. A sejthártyával összeolvadva szabaddá válik a sejtkörnyezet felé, felveszi a cukrot, és a sejtbe szállítja.
A sejtek glükózfelvétele a GLUT4 közreműködésével valósul meg. A GLUT4 egyike a 13 (GLUT1–12) glükózt szállító fehérjének; sajátos tulajdonsága, hogy inzuliningerre a sejthártyához vándorol, de az inger elmúlásával visszakerül az eredeti helyére.
granulosasejt granulosa cells (→[fali] tüszőhámsejt)
haránt hüvelyi sövény transverse vaginal septum Rendkívül ritka testikromoszómás lappangó fejlődési rendellenesség. A hüvely (a Müller-cső alsó részének) tökéletlen egyesüléséből jön létre, ez pedig a hüvelylemez nem megfelelő társulásának a következménye. Haránt izom-kötőszöveti sövény keletkezik, kialakulhat a hüvely bármely részén. Nem társul más Müller-csői vagy vizeletelvezetői rendszeri hibával. A betegek elsődleges vérzéshiányban szenvednek, időszakos hasi görcsei vannak, vérteli méh (hemotometra) alakul ki, hiszen a sövény elzárja a havibaj útját. A legegyszerűbben ultrahanggal állapítható meg. Az MR a részleteket is mutatja. A sövény kivágásával megoldódik a helyzet, a későbbi fogamzást általában nem befolyásolja.
hiszton-acetiltranszferáz histone acetyltransferase, HAT, histone acetylase végzi a hisztonok acetilezését: a hiszton N-végi lizinjére acetilcsoportot visz át az acetil-koenzim-A-ról; ε-N-acetil lizin keletkezik.
hőátadás (hőközlés, hőterjedés) heat transfer a hőenergia továbbítása. A hőenergia átadásának módjával és arányával foglalkozik; nem része az egyensúlyállapot tárgyalása. Jele: Q’ = h × A × DT (h a hőátadási állandó [W / m2 × K, K = kelvin]; A a terület, amelyben a hőátadás zajlik; a DT a hőátadást okozó hőmérséklet-különbség, vagyis a melegebb és a hidegebb részek közötti hőmérsékletkülönbség). A hőátadás mindig a melegebből a hidegebb rész felé történik. A hőátadásnak három formája van:
▪ Hővezetés (thermal
conduction, kondukció). A hőátadás két test közvetlen kapcsolatában, az
atomok, molekulák sorozatos ütközésével (mozgási energiájával) valósul meg. A
gyorsabban mozgó (nagyobb energiájú) atom/molekula ütközik a másikkal, energiát
ad át, aminek következtében a másik felgyorsul, és a következővel ütközve annak
ad át energiát, a folyamat így folytatódik. A hővezetéskor az anyag nyugalomban
van, csak az atomjai, molekulái ütköznek, de nem vándorolnak el.
Jele: G, egyenlő a hőáramlás (j) és a hőmérséklet-változás (DT) hányadosával = j / DT. SI-egysége: watt/kelvin (W/K = W × K−1)
A hővezetés végbemehet szilárd testekben, folyadékokban és gázokban is, a szilárd testekben a legkifejezettebb: az atomok közel vannak egymáshoz, gyorsan, láncszerűen ütköznek.
Az anyagok hővezető képessége különböző, az atomok/molekulák összeállásának (az anyag szerkezetének) függvénye. A rossz hővezető anyagok (például a folyadékok, gázok) hőszigetelők. Sok szigetelőanyagban légbuborékok vannak, ezért jó hőszigetelők.
▪ Hőáramlás (thermal
convection, konvekció) (nevezik hőáramnak is) a hőenergia szállítása
tovaterjedő atomokkal, molekulákkal. A molekulák áramlása jelenti a hőenergia
terjedését. Másként: hőátadás folyadékáramlással, vagyis ellentétben a
hővezetéssel – amelyben az anyag nyugalomban van – a hőáramlással az anyag is
mozog. Például hőátadás vízben sűrűségkülönbség alapján: a meleg hatására a víz
sűrűsége csökken (molekulái gyorsabban mozognak), felszáll, helyét a nagyobb
sűrűségű hideg víz foglalja el. Ez is felmelegszik, felszáll és így tovább. Ez
ismétlődik, amíg a folyadék egyenletesen fel nem melegszik. A molekulák
felszállásából adódó hőenergia a víz felszínét képező nagyon sűrű vékony
rétegben azonban vezetéssel adódik tovább.
A hőáramlás jele a j, egyenlő a hőmennyiség (Q) és az idő (T) hányadosával = Q / T. SI-egysége a watt (W), egyezik a teljesítmény egységével.
hőáramsűrűség a hőáramlás (hőáram, j) és a terület (A) hányadosával kifejezett mennyiség. Jele: q = j / A. SI-egysége watt/négyzetméter: W/m2.
▪ Hősugárzás (thermal
radiation, radiation heat, radiáció) elektromágneses sugárzással
közvetített hőátadás; 0,1–100 μm hullámhosszú elektromágneses hullámok
közvetítik (akár fényt is tartalmazhat), tehát nem az atomok, molekulák adják
át egymásnak. Az atomok hőhatásra bekövetkező mozgása által kibocsátott elektromágneses
sugárzás. A tökéletes 0 fok (0 K) felett minden testnek (bármekkora is a
hőfoka) van hősugárzása; függetlenül a környezet hőmérsékletétől. Terjedéséhez
nincs szükség közegre, légüres térben a legkifejezettebb, de közegben is
rendkívül gyorsan terjed.
A
hősugárzás kibocsátásakor (emission, emisszió) a belső energia alakul
elektromágneses energiává; a hősugárzás elnyelésekor pedig az elektromágneses
energia alakul belső energiává, az elnyelő test atomjainak mozgási energiájává.
A hősugárzás arányát (Q’rad) a Q’rad = ε × σ × AT4s (az ε a kisugárzás [emissivity] mértéke, amely 0–1 között van; a σ a Stefan–Boltzmann-állandó; az AT a felszíni [s = surface] hőmérséklet Kelvin-fokban) egyenlet fejezi ki. A Stefan–Boltzmann-állandó (σ) = 5,67 × 10−8 × W (m2 × K4).
idegingerület-átvivők neurotransmitters egyszerű molekulák (aminosavak, peptidek, monoaminok
stb. – az idegsejtekben bőséggel jelen lévő anyagokból származnak): a központi
idegrendszer és az idegcsatolatok (synapses, szinapszisok) jelvivői. Az
idegcsatolat előtti (presynaptic) idegsejtből szállítják a jelzést
(idegingerület) az idegcsatolaton keresztül az idegecsatolat utáni (postsynaptic)
sejtnek. A küldő sejtben kis hólyagcsákban vannak elzárva. Ingerület hatására
kibocsátódnak a parányi (~0,1 μm) idegcsatolati hézagba, és azon áthaladva
kötődnek a fogadó ideg ingerfogójához; hatásukra szokásosan ioncsatornák
nyílnak meg. Hatásuk (milyen ioncsatornák nyílnak meg) attól a jelfogótól függ,
amelyhez kapcsolódnak.
A legjelentősebb idegingerület-átvivők a glutamát, GABA (gamma-amino-vajsav), acetilkolin, glicin és norepinefrin.
Serkentést és fékezést is közvetítenek: a GABA és a glicin például a központi idegrendszer egyik leggyakoribb gátló, az glutamát pedig a serkentő jelvivője. Az acetilkolin az ideg–izom jelátvitelben (neuromuscular junction) vesz részt.
Idegingerületi jelfogó található azonban az idegcsatolaton kívül is, például sejtközi jelvitelnél.
jelátvitel* signal transduction a vérkeringéssel vagy a sejtközi állományban érkező jel (vízoldékony jelvivő) fogadása a sejten található jelfogó fehérje által. A jelvivő és a sejtfelszíni jelfogó kapcsolódásával jön létre; a jelfogó viszi át a jelzést a sejthártyán.
Korábban úgy véltük, hogy egyazon jelvivő ugyanolyan jelfogóhoz kapcsolódva csak egyfajta jelátvitelt vált ki. Tehát nemcsak a jelvivő–jelfogó kapcsolódása fajlagos, hanem a jelátvitel is. Az elmúlt évtizedekben körvonalazódott, és vált elfogadottá a válaszállapot* (functional selectivity) elmélete; más néven: biased agonism, biased efficacy, signalling bias. Veleje: egyazon jelfogóhoz kapcsolódó egyazon jelvivő különféle jelközvetítéseket válthat ki, valószínűleg a jelfogó állapotától függően. (→jelvivő–jelfogó kapcsolódás) Vagyis nem tartható az a korábbi elmélet, amely szerint azonos jelfogó által átvitt más-más jelközvetítéshez más-más jelvivő szükséges. A jelenséget először a mesterségesen előállított jelvivőknél, például gyógyszereknél figyelték meg, de kiderült, hogy a szervezetben keletkezőknél sem kivételes.
jelviteli kötőhely az a hely, ahol a jelvivő kötődik a jelfogóhoz. Leginkább a sejt felszínén van, de lehet a sejtplazmában, sőt a sejtmagban is. (→jelfogó)
kérgi szemcsék cortical granules a még meg nem termékenyített petesejt sejtplazmájában levő szervecskéi a petesejt sejthártyája alatt. 300–400 nm átmérőjűek. Enzimeket tartalmaznak, amelyek az ondósejtnek a petesejt plazmájába kerülésekor kiválasztódnak a petesejtből és a fénylő burkot módosítva megakadályozzák, hogy másik ondósejt jusson át a fénylő hártyán.
késlekedő szál lagging strand 3’→ 5’ irányban másolódó új DNS-szál a kettőződési villában. Ez a szakasz darabonként (Okazaki-töredékek) másolódik, majd a DNS-ligáz rakja egybe őket. (→DNS-szálak képződési folyamata)
linea vonal ■ linea arcuata félkörvonal (→medencecsont/csípőcsont) ■ linea iliopectinea (→medencecsont) ■ linea terminalis határvonal (→medencecsont) ■ lineae transversae harántélek (→medencecsont/keresztcsont)
maghártya nuclear membrane, nuclear envelope a magot a sejtplazmától elválasztó kettős hártya (külső és belső hártya): két párhuzamos, kettős lipidrétegből áll, amely lapos teret (maghártyatér*, perinuclear space/cysterna) fog közre. Feladata a sejtmagállomány elválasztása a sejtplazmáétól. Megakadályozza, hogy a molekulák szabadon átjárjanak, mert akkor keveredi a kettő állománya,s megszűnnek önálló egységek lenni. A kettős lipidrátegen csak a kis semleges atomok, molekulák (H, CO2, etanol) képesek átjutni.
A külső hártya a durva felszínű plazmahálózat (endoplasmatic reticulum) folytatása, ezért a maghártyatér közlekedik a durva felszínű plazmahálózat üregével. A maghártya sejtplazmai felszínén ennek megfelelően ribotestecsek (ribosomes) helyezkednek el. A belső hártyában azonban a sejtmagra sajátos fehérjék vannak.
A maghártya belső (mag felőli) felületén 10 nm vastag laminfonalakból álló rácsrostozat van (laminalemez); ezzel kapcsolódik a tömörödött kromatin – együttesen állnak ellen a sejtplazma nyomásának. Nemcsak támasztó szerepe van, hanem a kromatinok és a belső hártya fehérjéinek tevékenységében is részt vesz. (→lamin)
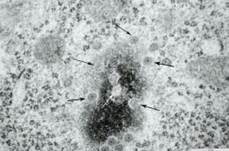 A hártyában számos apró, kerek átjárás (pores) van, ezek a molekulák
ki-bejutására szolgálnak. Mindegyik átjárást fehérjeössztes (nuclear pore
complex, magyarul: magjáratössztes*) fog körül. Ez a sejt legnagyobb
(~130 MDa) fehérjetömörülése, ~100-féle fehérjéből (nucleoporins, nups) tevődik
egybe.
A hártyában számos apró, kerek átjárás (pores) van, ezek a molekulák
ki-bejutására szolgálnak. Mindegyik átjárást fehérjeössztes (nuclear pore
complex, magyarul: magjáratössztes*) fog körül. Ez a sejt legnagyobb
(~130 MDa) fehérjetömörülése, ~100-féle fehérjéből (nucleoporins, nups) tevődik
egybe.
Az ábra a maghártya érintőleges átmetszetének elektronmikroszkópos képe. A tömörödött kromatinban egy (fehér nyíl), a széli részein öt (fekete nyilak) kerek képlet, az átjárás látható (Oláh Imre felvétele.) A maghártya az átjárásoknak megfelelően befordul, elzárja a magkörüli teret.
A mag–plazma átjárás pontos szabályozása lényeges a sejt működésében, például az átírásfehérjék ellenőrzött átjutásában, a gének bekapcsolásában.
Az átjárás az egyetlen olyan kapcsolat, amelyen nagymolekulák (fehérjék, RNS) képesek átjutni a sejtplazmába és fordítva. A ~9 nm-nél kisebb molekulák a megnyílt átjárásokon átszivárognak. A nagyok, például ribonukleofehérjék, azonban nem férnek át. Ezeknek a magjáratössztes tágra (25 nm) nyitja az átjáratot, amelyen keresztül a nagymolekula csak az egyik irányba mehet; a magból a plazmába, avagy fordítva. A nyitás szükségességét jelzések közvetítik.
A maghártya két lemezét, hártya alatti rácsrostozat és a magjárat össztes együttes nemzetközi neve nuclear envelope, magyarul maghártyaboríték*.
MIT–TFe (microphthalmia/transcription factor E, MIT/TFE) átírásfehérje-család a MYC-nagycsalád tagja. Jellemző rájuk a 10 bázispárnyi (a hagyományos E-dobozra emlékeztető), CLEAR (coordinated lysosomal expression and regulation) elemnek nevezett mintázatot (GTCACGTGAC) felismerő képesség. Ez a mintázat a savas hidrolázokat, az emésztőtestecs hártyai szállító és társfehérjéket kódoló emésztőtestecs-gének indítójában van; a MIT–TFe átírásfehérjék (MITf, TFeb, TFe3 és TFec) ezt felismerve kapcsolódnak a génhez. Hasonlóan kötődnek az önfalás folyamatát irányító (autophagy) génekhez is. Mint a legtöbb átírásfehérje, általában kettőst képezve hatékonyak, mindegyikben megtalálható a kettős képezéséhez szükséges gomoly, és DNS-kötő gomoly is.
Működésük szigorúan szabályozott: pl. a tápanyaggazdag sejtben a TFeb és a TFe3 átírásfehérjét az emésztőtestecs hártyájában lévő RAG-GTPáz toborozza, és a tevékeny mTORC1 foszforilezi. A foszforilezett TFeb és TFe3 tétlen, mert a 14-3-3 fehérjéhez kötődik, és fogva marad a sejtplazmában. Tápanyaghiányos sejtben a RAG-GTPáz és az mTORC1 is tevőtlen, a TFes és a TFe3 defoszforileződik a foszfatáz calcineurin által, elválik a 14-3-3-tól, beszállítódik a sejtmagba és kötődik a DNS-hez. Ha helyreáll a tápláltsági állapot, a RAG-GTPáz tevősíti az mTORC1-et, ez utóbbi újra foszforilezi a sejtplazmában lévő TFEB-t és TFE3-at, megakadályozva, hogy újabb átírásfehérjék kapcsolódjanak a célgénekhez.
A MIT–TFe átírásfehérjék tevékenységét – kapcsolódásukat a DNS-hez – a foszforilezés mellett az acetilezés, SUMO-ilezés, elektronleadás, ubikvitinjelölés, továbbá kóros sejthelyzetek (sejtártmány, energiatestecs-, DNS-hiba, gyulladásállapotok, rák stb.) szintén befolyásolják. Foszforilezéssel hatnak rájuk a növekedést szabályozó kinázok (MEK/ERK), valamint a GSK3 (glycogen synthase kinase 3) is. Ezek együttesen irányítják az emésztőtestecs-önfalási gének tevékenységét.
neurotransmitter idegingerület-átvivő (→jelvivő)
OGTT (Oral Glucose Tolerance Test) vércukorterhelés (→vércukorvizsgálat)
PARP (poli(ADP-ribóz)-polimeráz) poly(ADP-ribose) polymerase, ADP-ribosyltransferase, poly ADP-ribosylated proteins a sejtmag egyik fehérjéje. 18 féle ismert (PARP1, PARP2 stb.); ezek fehérjecsaládot alkotnak. Hatféle PARP-ról tudjuk, hogy ADP-ribózt kapcsol a NAD+-ról a célfehérjéhez, egyet vagy akár több százat, kialakítva hosszú poli(ADP-ribóz)-láncot (PAR-lánc; poly(ADP-ribose) polymers); innen a poli előtag az enzim nevében. Ezt a folyamatot nevezzük PARilációnak (poly[ADP-ribosyl]ation; PARylation).
A család három tagja, PARP1, PARP2 és PARP3, vesz részt a DNS-javításban. A PARP DNS-javító enzim: az egyszálú DNS-töréshez kötődik.
▪ A PARP1 nagy mennyiségben van jelen a sejtmagban (106/sejtmag); az alaphisztonok PARilációjával fellazítja a kromatint, lehetővé téve a DNS kettőződését, a DNS-javítását vagy a génátíródást. Alapvetően vesz részt a DNS-hiba báziskivágó* javításában, és szabályozza a kétszálú DNS-törés hasonmás átrendeződéses*, valamint a nem hasonmás végegyesítéses* javítási folyamatait. Meghatározó szerepe van a génátíródásban: részben átíródási társtényező (transcriptional cofactor), másrészt gátolja sajátos bázisszakaszok metilezését; szabályozza a sejt genetikai egyensúlyát, energia folyamatait, és közreműködik a sejthalál parathanatosnak… nevezett sajátos formájában. Hat gomolya van: az N-végen három cinkujj gomoly (Zn1, Zn2, Zn3 [Zn = zinc fingers]), ezt követi az önPARiláló (AD) gomoly, majd a nyított kromatinnal kölcsönhatásba lépő (WGR) gomoly, a C-végen pedig a sarkallógomoly van. A cinkujj gomolyok közül kettővel kötődik a DNS-hez a DNS törési szögénél, tehát nem a nyítottá vált nukleotidhoz.
▪ A PARP2 tevékenysége hasonló, de csekélyebb: a PARP-működések 5–10%-át teszi ki.
▪ A PARP3 a sejtkörben szabályoz.
A PARP fehérjék háromféle gomolyt tartalmaznak:
• DNS-kötő gomoly (DNA binding domain, DBD). Az N-végen, három cinkujjmintázatból áll; kettő ismeri fel az egy- és kétszálú DNS-törés, és kapcsolja a PARP-ot, a harmadik szabályoz.
• Szerkezetalakító gomoly (automodification domain), amely sajátos glutamát és lizin aminosavakat tartalmaz, valamint kis BRCT gomolyt a DNS-t javító fehérjékkel való kölcsönhatáshoz.
• sarkallógomoly – a C-végen van,
Ha DNS-törés keletkezik, a PARP1 azonnal PARilálja önmagát, tevékennyé válik, és kapcsolódik a törés helyéhez az N-végén lévő mintázata segítségével. A kötődéssel (szerkezetváltozás) ötszázszorosára tevősödik a C-végén lévő sarkallógomoly, PARilálja a kromatin hiszton és nem hiszton fehérjéket és topoizomerázokat, szerkezetükben elektronkötési változást hoz létre. A PARilált fehérjéknek nemcsak működésük változik, de képessé válnak más fehérjék megkötésére is. A PARP1 autoPARilációjával a saját szerkezetét alakítja át, aminek következtében elválik a DNS-törés helyéről, lehetővé téve a helyreállító fehérjék kapcsolódását a töréshez, és a törés helyreállítást.
A PARP túlműködése felhasználja a sejt energiakészletét, sejthalálhoz vezet.
Philadelphia-kromoszóma Philadelphia chromosome, Philadelphia translocation (Ph) átcserélődés következtében kialakult sajátosan rövid 22-es kromoszóma, amelyen jelen van a ABL-BCR egyesült gén. Az átcserélődés a 22-es és a 9-es kromoszóma között jön létre: a 9-es kromoszóma hosszú karjának alsó része (q34) cserélődik a 22-es kromoszóma q11-es részével t(9q34;22q11). A származék 9-es kromoszóma (derivative chomosome 9, der9) hosszabb, a 22-es pedig lényegesen rövidebb, csonka (trancated chromosome 22, 22q-, the Philadelphia chromosome). A töréspontnál a 9-es kromoszómán (q34.1) van az ABL gén, a 22-esen (q11.2) a BCR gén. Az átcserélődés következtében ezek egyesülnek, és kialakul a felemás ABL-BCR gén: az ABL génnek 3’-végi, a BCR gén 5’-végi részéből keletkezik. A ABL-BCR gén az ABL-BCR fehérjét képezi, amely tirozin-kináz, és folyvást bekapcsolt állapotban van. Ennek következtében a sejt megállás nélkül osztódik, sokasodik.
A Philadelphia-kromoszóma jelenléte a fehérvérűség egyes formáinak jellemzője: csaknem mindig jelen van az idült mieloid fehérvérűségben (CML), ritkában a heveny nyiroksejtes (ALL) és még ritkábban a heveny mieloid (AML) fehérvérűségben.
post-translational modification molekulamódosítás* (→fehérjemódosítás)
Az elnevezés a fehérjék módosítására született, hiszen csak a fehérjék keletkezésében van átfordítás, mégis alkalmazzák más kialakult (végső formájú) molekulák változtatására is, pl. valamely érett RNS módosítása metilezéssel.
RAD50 (RAD50 Double Strand Break Repair Protein) (→MRN-össztes)
reverse (riverz) fonák ■ reverse transcriptase (reverz transzkriptáz) →fonák transzkriptáz
RNS-állomány transcriptome (transzkriptom) a sejt RNS-einek összessége; a DNS bármely részéről
átíródott RNS. Nemcsak a különböző sejtek RNS-állománya eltérő, de egyetlen
sejté is folyamatosan változik.
signal transduction (szignál traszdukció) a biológiai jelzésnek az átkerülése a sejthártyán. Három formát
foglal magában; ezeket magyarul külön nevezetekkel illetjük. (→jelátadás, jelátjutás, jelátvitel).
SPEN (spen family transcriptional repressor) (egyéb elnevezése: SHARP) DNS-kötő, a géneket némító, sokgomolyos fehérje; az X-kromoszóma némításának meghatározó molekulája. Négy RNS-felismerő mintázata, magjelfogóval kapcsolódó gomolya és 3’-végi fehérjéket kötő gomolya (SPOC [SPEN paralogue/orthologue C-terminal domain]) van. Kromatint módosító gomolya nincs. RNS-ekkel kölcsönhatásban, társnémítók kapcsolásával némítja a géneket.
SSB-fehérjék (single strand binding protein) az egyszálú DNS-hez azonnal kötődő fehérje. Megakadályozza, hogy az egyszálú DNS károsodjék, avagy kettőződéskor azonnal ismét egyesüljön. Minden olyan sejtfolyamatban nélkülözhetetlen, amelyben egyszálú DNS keletkezik, így hibajavításokban is.
Törzsökös fehérje, a fajok mindegyikében jelen van. Jellegzetes a DNS-kötő gomolya, ezzel ismeri fel és kapcsolódik az egyszálú DNS-hez.
SSXT fehérje ( synovial sarcoma translocated to X chromosome protein) a SWI–SNF össztes egyik alegysége. Más néven protein SYT. Az SS18 (egyéb nevei: SSXT, SYT) gén kódolja, amelyik a 18-as kromoszómában van. Az X és a 18-as kromoszóma áthelyeződése: t(X;18)(p11.2;q11.2) az ízületi savóshártya szarkómáinak (synovial sarcoma) ~90%-ban van jelen. Az áthelyeződés génegyesülést hoz létre; a közös termék az SSXT-SSX1 vagy SSXT-SSX2 valószínűleg kórosan módosítja a kromatint. (→SWI–SNF össztes)
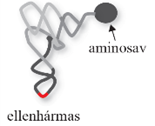
szállító RNS, tRNS transfer RNA, tRNA kis, 75–90 nukleotidból álló, jellegzetes – a fajokban többé-kevésbé azonos – szerkezetű ribonukleinsav; a keletkező polipeptidlánc és az átfordítódó mRNS közötti kapocs: az aminosavat szállítja a fehérjeképző rendszerhez, a ribotestecshez. Két működési egysége van: az ellenhármas (anticodon), amely 3 bázisból áll, és az mRNS kiegészítő bázishármasával társul, biztosítva, hogy a megfelelő aminosav kerül a fehérjébe; valamint az aminosavat kapcsoló rész.
Sok száz tRNS gén ismert; a DNS-ben szétszórva helyezkednek el, csak a 22-es és az Y-kromoszómán nincs. Nem mindegyik tRNS gén tevékeny. 22 tRNS gén a mitokondriumokban…… is található. Az átíródást a TF3B és TF3C indítja, és az RNS-polimeráz-3 végzi.
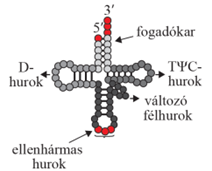 elő-tRNS a génekről egyszálú elő-tRNS másolódik, amelyben hidrogénkötésekkel
bázispárok keletkeznek. A hidrogénhidak állandósítják a molekulát, és
párhuzamosan rendezett kettős szálú szakaszokat alakítanak ki. A kétszálú
szakaszok között négy egyszálú hurok formálódik. A hurkok a nem kiegészítő
bázisok szembekerülésével jönnek létre: ezekhez ugyanis nem kapcsolódnak
hidrogénkötések, ezért nem alakul ki a kettős szál. A nem kiegészítő (adenin,
guanin és citozin) bázisok között keletkező kölcsönhatások (London-féle erők
stb.) alakítják az egyenes vonalú nukleotidsort hurok alakúvá. Lóhere alakú
szerkezet keletkezik, amelyből kivágásokkal – hasonlóan, mint az elő-mRNS–mRNS
átalakulásnál – jön létre a másodlagos szerkezetű tRNS. Ez a folyamat az
átíródáskor és rögtön utána megy végbe.
elő-tRNS a génekről egyszálú elő-tRNS másolódik, amelyben hidrogénkötésekkel
bázispárok keletkeznek. A hidrogénhidak állandósítják a molekulát, és
párhuzamosan rendezett kettős szálú szakaszokat alakítanak ki. A kétszálú
szakaszok között négy egyszálú hurok formálódik. A hurkok a nem kiegészítő
bázisok szembekerülésével jönnek létre: ezekhez ugyanis nem kapcsolódnak
hidrogénkötések, ezért nem alakul ki a kettős szál. A nem kiegészítő (adenin,
guanin és citozin) bázisok között keletkező kölcsönhatások (London-féle erők
stb.) alakítják az egyenes vonalú nukleotidsort hurok alakúvá. Lóhere alakú
szerkezet keletkezik, amelyből kivágásokkal – hasonlóan, mint az elő-mRNS–mRNS
átalakulásnál – jön létre a másodlagos szerkezetű tRNS. Ez a folyamat az
átíródáskor és rögtön utána megy végbe.
másodlagos szerkezetű tRNS lóhere alakú képlet, négy hurkot alakít ki, páros és páratlan karokkal összekapcsolva. Megkülönböztetünk D-hurkot (DHU-hurok; D-loop), TΨC-hurkot (TΨC loop), ellenhármas* hurkot (anticodon loop), és egy kisebb, változó alakú (fél) hurok (variable loop) is előfordul, amelyet változó többletkarnak/-huroknak is nevezünk – ez a páratlan kar; nincs mindegyik tRNS-ben. A hurkok elnevezése a bennük lévő módosított nukleotidok szerint (D-hurokban dihidro-uridin van, ezért DHU-huroknak is nevezik; a TΨC-hurkban pedig pszeudouridin [Ψ]). A páros karokat a hozzájuk tartozó hurkok szerint D-, TΨC- és ellenhármas karnak nevezzük. A 3’-végét a fogadókar (aminosav kar) alkotja a CCA-végződéssel (pirossal jelölve) és egy szabad hidroxil (OH) csoporttal, melyhez a szállítandó aminosav kapcsolódik, az 5’-végen pedig foszfátcsoport van. Az ellenhármas hurok alsó bázishármasa (pirossal jelölve) az mRNS valamelyik bázishármasainak a megfelelője, ellentétes bázishármasa (anti-codon), egyszerűen ellenhármas.
 érett tRNS A másodlagos szerkezetű tRNS a sejtplazmában tömörödik (base-stacking) a
fogadókar és a TΨC-hurok között, illetőleg a D-hurok és az ellenhármas kar
között; L formájú lesz. Ez a tRNS harmadlagos szerkezete, amely
meglehetősen állékony. A harmadlagos szerkezet a nukleozidok módosulásával
(metil-guanozin [mG]; áluridin
[pseudouridine, ψ]),) jön létre; amit a
tRNS-módosító enzimek (tRNA-modifying enzymes,
tRNAmods) végeznek. A harmadlagos szerkezetű tRNS-t nevezzük érett tRNS-nek. Az
aminosav a tRNS3-véghez kapcsolódik, az ellenhármas pedig az mRNS illeszkedő
bázisaival társul.(Az ábrákat Balla Éva készítette.)
érett tRNS A másodlagos szerkezetű tRNS a sejtplazmában tömörödik (base-stacking) a
fogadókar és a TΨC-hurok között, illetőleg a D-hurok és az ellenhármas kar
között; L formájú lesz. Ez a tRNS harmadlagos szerkezete, amely
meglehetősen állékony. A harmadlagos szerkezet a nukleozidok módosulásával
(metil-guanozin [mG]; áluridin
[pseudouridine, ψ]),) jön létre; amit a
tRNS-módosító enzimek (tRNA-modifying enzymes,
tRNAmods) végeznek. A harmadlagos szerkezetű tRNS-t nevezzük érett tRNS-nek. Az
aminosav a tRNS3-véghez kapcsolódik, az ellenhármas pedig az mRNS illeszkedő
bázisaival társul.(Az ábrákat Balla Éva készítette.)
A nukleozidok átalakulása és a következményes harmadlagos szerkezet meghatározó, mert biztosítja a tRNS állékonyságát a sejtplazmában, továbbá, mert a tRNS csak így juthat a ribotestecsbe (ribosome), és kötődhet az aminoacil-tRNS-szintetázzal; az enzim ugyanis a térszerkezet egyes elemei alapján azonosítja a megfelelő tRNS-t. Ha a nukleozidok módosítása nem megfelelő, a tRNS rendre lebomlik. Megmaradása betegségeket (köztük rákot is) okozhat; kivált az ellenhármas zavara veszélyes.
Mivel a bázishármasok 64 változatban fordulhatnak elő, várható, hogy az mRNS-hez is 64 különböző tRNS társuljon. A valóságban azonban kevesebb, az emberi sejtekben 48-féle tRNS keletkezik. A hiányzó hármas párosodás a lötyögő párosodással oldódik meg. Ez azt jelenti, hogy egy-egy tRNS akkor is kapcsolódhat az ellenhármassal, ha csak az első két bázisuk kiegészítője egymásnak.
TANGO1 (transport and Golgi organization protein 1) (más néven MIA3 – MIA Src homology 3 (SH3) domain ER export factor 3) a plazmahálózat küldőhelyén lévő jelfogó, nagy molekulákat (pl. kollagén) köt, nagy szállítmányokat hoz létre. Köti a HSP47-et, amely a prokollagén dajkafehérjéje; ennek következtében a prokollagén kapcsolódik a COPII-vel (burokfehérje-összlet-2), és elkezdődik a burokképződés.
A szokványos COPII-burok nem elegendő a nagy prokollagén burkolására. A nagyobb hólyagcsa keletkezését a TANGO1 teszi lehetővé: olyan molekulákat köt, amelyek korlátozzák a SAR1 GTPáz tevékenységét. Ennek következtében a COPII gyűrűs szerkezetűvé válik, lehetővé téve a burok növekedését, a prokollagént tartalmazó nagy hólyagcsa kialakulását. A TANGO1 hasonlóan segíti más nagymolekulák, pl. lipidszemcsék (very low-density lipoproteins) beburkolását is.
A TANGO1 – gyűrűs COPII kettőshöz a Golgi felszínéről kiválasztódó mucin kötődik, kialakítva kapcsolódást a plazmahálózat és Golgi között. A TANGO1-nek szerepe van a sejtkívüli állomány és a csontok formálásában is.
TAP (transporter associated with antigen processing) szállítófehérje, az ATP-binding cassette (ABC) transporter family tagja. Szerkezetileg hasonló két fehérjéből, TAP1 és TAP2 áll. Mindegyiknek van egy sejthártyai gomolya az N-végen, és sejtplazmai gomolya a C-végen, ez köti a peptidet.
A TAP az antigénbemutatásra keletkezett kis peptideket (antigén-meghatározókat) szállítja a sejtplazmában a plazmahálózat hártyájához, amelyen az N-végi gomolya átnyúlik; lehetővé téve az MHC1 és az antigén-meghatározó kötődését a peptidkapcsoló össztes közreműködésével. Vagyis a TAP teremt kapcsolatot a sejtplazmai peptidek és a plazmahálózati MHC1 között, ezért az antigénbemutatás (szerzett immunitás) alapvető molekulája.
TAP-hiányos sejtek nem képesek megfelelő MHC1-hez kötött antigénbemutatásra. Többféle vírus is, pl. a herpeszvírus képez TAP-gátlókat, bénítva az immunvédekezést. TAP-gátlókat kezelésekre is alkalmaznak. (→peptidkapcsoló össztes)
telomeráz telomerase, telomere terminal transferase ribonuklein-fehérje, fonák transzkriptáz, amely TTAGGG ismnétleteket köt a végrészhez a DNS-kettőződéskor, akadályozva a végrészek rövidülését. A végrészek 3’-végéhez kapcsolja az ismétleteket, azaz fordított (3’ → 5’) átírással.
Két részből,
▪ a másoló enzimből (TERT; telomerase reverse transcritase – más néven: protein human reverse transcriptase, hTERT)
▪és rövid nem kódoló, mintasorként szolgáló RNS-ből, a telomeráz-RNS-ből (TERC, telomerase RNA component) tevődik össze. (→telomeráz-RNS)
A telomeráz védi a végrészt, meghatározó az öregedés fékezésében. A daganatsejtekben a G1-szakaszt is szabályozza. Az ép sejtekben nincs vagy csak nagyon kis mennyiségben van jelen, a DNS-kettőződésekor tevősödik. A ráksejtek 80–90%-ban jelentős a mennyisége, növeli a végrészeket; ez teszi a ráksejteket halhatatlanná, és serkenti az osztódásukat.
téralakzati azonmások configurational isomers összetételükben és a kötési sorrendben is egyező, csupán elektronkötésük körüli térszerkezetükben eltérő vegyületük. Egymásba csak valamelyik elektronkötésük felbomlásával és új elektronkötés kialakulásával alakulhatnak át; a kötések elfordulásával nem. A téralakzati azonmásoknak két alapformáját, a tükörképi és a nem tükörképi azonmásokat különböztetjük meg:
■ Tükörképi (térközponti) azonmások (enantiomers,
enantiomerek) egy vagy több térközpontot (térközponti szénatomot)
tartalmazó vegyület olyan két formája, amelyek egymásnak tükörképei, de fedésbe
– miként a jobb és bal kéz – nem hozhatók. Másképp: olyan molekulák, amelyeknek
velük fedésbe nem hozható tükörképi párja is van.
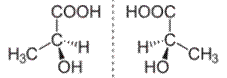 A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A kétféle tükörképi azonmás megkülönböztetésére az R,
S betűt alkalmazzuk (R–S azonmásság*); és a szénatomhoz
kapcsolódó molekulák rangsora szerint határozzuk meg. A rangsort az atomok
rendszáma és kapcsolódási sora adja. A legkisebb rangja a legkisebb rendszámú
atomnak (H) van. A hatócsoportok rang szerinti sora: ─OCH3 > ─OH > ─NH2 > ─COOH > ─CHO >
─CH2OH > ─CH3 > ─H. Az atomok rang szerinti sorát a rendszámuk határozza
meg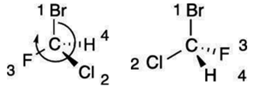 . A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
. A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
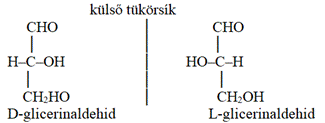 A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
■ Nem tükörképi azonmások* (diastereomers, diasztereomerek) egymásnak nem tükörképei, és egymással fedésbe sem hozhatók, fizikai és
vegyi tulajdonságaikban eltérők. Bennük a molekulák kapcsolódási rendje azonos,
egy vagy több nem kapcsolódó atom térbeli helyzete más. Kialakulhat egy vagy
több szénatom körül. Ilyenek a cisz–transz azonmások.
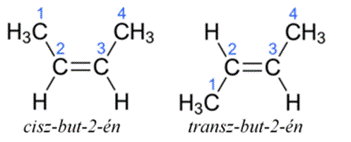 cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
A kétféle helyzet csak a kettőskötés átmeneti felszakadásával és újraegyesülésével alakulhat át egymásba. A hatócsoportok más térállása miatt különbözik az azonmások tulajdonsága, kölcsönhatása; megváltozik az alakja. A kettő tehát más-más molekula; ez legtöbbször a hagyományos nevükben is kifejeződik. (→cisz–transz)
A cisz–transz nevekkel előfordulhat félreértés, ezért a IUPAC bevezette a szigorúbban szabályozott Z–E rendszert, amely a szénatomokhoz kapcsolódó atomok/molekulák atomszámán alapszik, és rangsort állít fel ennek alapján. Ha a rangsorban nagyobb értékű molekula (példánkban a CH3, metilcsoport) ugyanazon oldalon van, Z (zusammen), ha különböző, E (entgegen) betűt kap. Pl. (2Z)-but-2-én, illetve (2E)-but-2-én.
térbeli elrendeződés, térszerkezet spatial arrangements
▪ A fizikában az élő és az élettelen tárgy térbeli elhelyezkedése, illetve részeik egymás közti térbeli kapcsolata.
▪ A kémiában és a biokémiában a molekulák vagy a molekulákat alkotó egységek (csoportok, atomok) egymáshoz való térbeli viszonya.
terheléses vércukorvizsgálat oral glucose tolerance test, OGTT (→vércukorvizsgálat)
TFIIh (transcrition factor IIH, TFIIH) IIh-átírásfehérje törzsökös fehérjetömörülés; tíz polipeptidből álló, gyűrű alakú, ~500 kDa tömegű fehérjeösztes kettős tevékenységgel:
▪ Általános átírást indító tényező a polimeráz-II általi átírásokban. Ez az egyetlen olyan átírásössztes, amelyiknek enzimműködése is van.
▪ Helikázössztesként vesz részt nukleotidkivágó DNS-javításban (NER), de szerepe van a sejtkör szabályozásában is.
Két nagy része a TF2H-mag és a CAK (CDK-activating complex).
▪ A TF2h-mag hét alegységből áll: tartalmaz két ATP-függő, ellenkező irányú helikázt (XPB és XPD), valamint a p62, p52, p44, p34 és p8 polipeptidet. Ez vesz részt a DNS javításában.
▪ A CAK a CDK7-kinázból (ciklinfüggő kináz), a ciklin-H-ból (CCNH) és a MAT1-ből tevődik össze; Ennek van szerepe a génátírásban. Pontosítja a DNS-hibát, helikázként bontja a hidrogénkötéseket, a DNS-szálat az XPA, XPC és XPG fehérjékkel együttműködésben. A nukleotidkivágó DNS-javításban nincs szerepe.
TFIIIa (transcription factor IIIA, TFIIIA) IIIa-átírásfehérje a polimeráz-III-at kapcsoló átírásfehérje, az 5S rRNS átírását indítja. A cinkujj mintázatot tartalmazó fehérjék nagycsaládjába tartozik. Kilenc cinkujj gomolya és egy különösen hosszú, ~52 bázispárnyi, DNS-t felismerő bázissora van. Sajátos, hogy a DNS-hez és az RNS-hez is képes erősen kötődni.
trans- ’át, keresztül’ jelentésű előtag ■ trans-acting
regulatory elements, TREs bázissor-szabályozók
(→bázissor-szabályozás) ■ transcript →átirat ■ transcription transzkripció →átírás ■
transcription factor transzkripciós
faktor →átírásfehérje ■ transcription
start site, TSS átíráskezdethely* (→indító) ■ translation, transzláció →átfordítás
■ translocation transzlokáció áthelyeződés
(reciprocal translocation átcserélődés*) ■ translocon hártyajárat* (→plazmahálózat) ■ transmembrane
(protein) hártyaátjáró (→fehérje) ■ transposon,
transposable elements (transzpozon) →ugrálat
transactivation domain, TAD kölcsöntevősítő gomoly kölcsönhatást teremtő állványfehérje. (→fehérjegomoly)
transcriptome →RNS-állomány
translational reading frame átfordítási olvasáskeret (→olvasáskeret)
translational reading frameshift olvasáskeret-eltolódás (→olvasáskeret)
transz–cisz (→cisz–transz)
transzpozáz transposase, Tase az ugrálat (transposon) által kódolt enzim, amely kivágja és áthelyezi az ugrálatot a DNS egyik helyéről a másikra. Az önálló DNS-ugrálat végein lévő fordított ismétleteket (végismétletek) azonosítja, ezekhez kötődve vágja ki a végismétletek közötti részt. (→ugrálat)
tüszőhámsejtek granulosa cells a petefészek egyik sejtfélesége, tüszők működésének alapsejtjei. A tüszők fejlődésével jelennek meg, és a tüszők érésével mind több sorban fogják körbe a fénylő burokkal védett növekvő petesejtet; a tüszők falát képező hámsejtekhez hasonló sejtek. Ösztrogént és progeszteront termelnek, az utóbbi oroszlánrészben hozzájuk kötött, a sárgatestben keletkezik.
ugrálat*
transposon, transposable element (transzpozon); (egyéb nevek: jumping
gene, selfish NDA, molecular parasite, controlling element) mozgékony
DNS-bázissor; képes áttevődni a DNS másik helyére. Egyesek másolódás nélkül,
mások másolódással helyeződnek át. Az előbbiek száma állandó, mert csak áthelyeződnek.
Az utóbbiak száma viszont nő, mert a másolódott bázissor ékelődik be a DNS
valamely részébe, az eredeti – amelyről a beékelődő bázissor másolódik –
megmarad az eredeti helyén. Az ugrálatok áthelyeződését különböző állapotváltoztató
(metilezési, kromatinátalakulási) folyamatok szabályozzák a korai ébrény
fejlődésétől kezdve. Szabályozásukat környezeti hatások (ártmányok, öregedés,
életmód stb.) befolyásolják. Az ugrálatoknak két csoportját, a kivágódóugrálat*
és a visszugrálat*, különböztetjük meg.
■ kivágódóugrálat* (DNA transposon, class/type II transposon) másolódás nélküli áthelyeződésű mozgékony DNS-szakasz; a szakasz kivágódik és beékelődik. 1000–40 000 bázispár nagyságú. Két formája az önálló és a hiányos kivágódóugrálat.
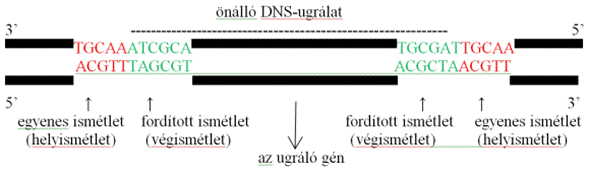 ▪ Önálló kivágódóugrálat*
tartalmazza a saját kivágását és áthelyezését végző enzimet (transzpozáz,
transposase) kódoló génrészt. A génrész négy képzőt tartalmazó olvasáskeret. Ez
közvetlenül kódolja a transzpozászt, RNS nem vesz részt benne. A génrész két
végén fordított ismétlet* (végismétlet*) van, az ugrálat ennek alapján
ismerhető fel. Az önálló kivágódóugrálat tehát a génrészből és a végismétletből
áll. A fordított ismétleteket egy-egy egyenes ismétlet* (helyismétlet*)
szegélyezi (target site duplication, TSD), ezek jelölik az ugrálat kivágásának,
illetve beékelődésének a helyét. A helyismétletek nem részei az ugrálatnak; az
ugrálatok kivágását követően szabályozhatják az utánuk lévő gének működését.
▪ Önálló kivágódóugrálat*
tartalmazza a saját kivágását és áthelyezését végző enzimet (transzpozáz,
transposase) kódoló génrészt. A génrész négy képzőt tartalmazó olvasáskeret. Ez
közvetlenül kódolja a transzpozászt, RNS nem vesz részt benne. A génrész két
végén fordított ismétlet* (végismétlet*) van, az ugrálat ennek alapján
ismerhető fel. Az önálló kivágódóugrálat tehát a génrészből és a végismétletből
áll. A fordított ismétleteket egy-egy egyenes ismétlet* (helyismétlet*)
szegélyezi (target site duplication, TSD), ezek jelölik az ugrálat kivágásának,
illetve beékelődésének a helyét. A helyismétletek nem részei az ugrálatnak; az
ugrálatok kivágását követően szabályozhatják az utánuk lévő gének működését.
▪ Hiányos kivágódóugrálat* csak külső enzim segítségével képes áthelyeződni, önállóan nem. Sok változata ismert, pl. van olyan, amely az önálló DNS-ugrálattól csupán néhány bázis törlődésében különbözik, de olyan is, amelyben az egész transzpozázt kódoló rész hiányzik stb.
Az önálló és a hiányos DNS-ugrálatok családot alkotnak. A DNS-ben több ilyen ugrálatcsalád van, ezeknek egymáshoz semmi közük.
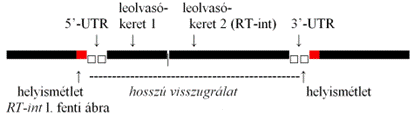
■ visszugrálat (retrotransponson, class/type I transposon) másolódással áthelyeződő mozgékony DNS-szakasz. Áthelyezéséhez szükséges egy indító – innen kezdődik a fordított átírás –, valamint a fordított transzkriptáz, amely fordított átírással képezi a másolatot, továbbá egy RNSáz-H – ez bontja (szabadítja fel) az ugrálatot – és egy integráz, pl. a transzpozáz, amely beékeli az ugrálatot. Az önálló visszugrálatokban mindegyik tevékenység benne van. Háromfélét különböztetünk meg:
 ▪ hosszú végismétletű visszugrálat* (long terminal repeat, LTR) a végek hosszú (~300
bázispár) egyirányú ismétletei jellemzik (hosszú végismétlet*). Közéjük
tartoznak a belretrovírusok. Mindkét végismétletet egy-egy egyenes ismétlet
(helyismétlet*, direct repeat) szegélyezi. Ezek határozzák meg a beékelődés
helyét.
▪ hosszú végismétletű visszugrálat* (long terminal repeat, LTR) a végek hosszú (~300
bázispár) egyirányú ismétletei jellemzik (hosszú végismétlet*). Közéjük
tartoznak a belretrovírusok. Mindkét végismétletet egy-egy egyenes ismétlet
(helyismétlet*, direct repeat) szegélyezi. Ezek határozzák meg a beékelődés
helyét.
A gén részében 4 képező van:
Gag csoportfajlagos (group specific) antigént képez. Ez vírusszerű fehérje; tartalmazza a fordítottan átírt visszugrálat-DNS-t.
RT fordított transzkriptázt kódol, amely fordítottan átírt másolatot képez a visszugrálat-DNS-ről.
Prt proteázt kódol, amely lebontja a vírusszerű részecskét, ahogy a visszugrálat a sejtmagba kerül.
int integrázt kódol, ez szükséges az ugrálat beékelődéséhez.
Az utóbbi 3 részt (Prt, RT és int) magában foglaló DNS-szakaszt együttesen Pol-nak nevezzük. Az olvasáskeretek átfednek.
 ▪ hosszú elszórt visszugrálat* (long interspersed nuclear element, LINE) ősi DNS-elem, ~6 kb hosszú; a törzsfejlődés
során ékelődött be a DNS különböző helyeire. A genom ~15%-át teszi ki. Önálló,
nem LTR visszugrálat (non-LTR retrotransposon), enzimet kódol. Nincs végismétlete,
a génekhez hasonlóan, nem átfordítódó bázissorral kezdődik és végződik.
Indítója az 5’-UTR-ben van.
▪ hosszú elszórt visszugrálat* (long interspersed nuclear element, LINE) ősi DNS-elem, ~6 kb hosszú; a törzsfejlődés
során ékelődött be a DNS különböző helyeire. A genom ~15%-át teszi ki. Önálló,
nem LTR visszugrálat (non-LTR retrotransposon), enzimet kódol. Nincs végismétlete,
a génekhez hasonlóan, nem átfordítódó bázissorral kezdődik és végződik.
Indítója az 5’-UTR-ben van.
 ▪ rövid elszórt
visszugrálat* (short interspersed nuclear element, SINE) ~300 bázispárnyi,
nem önálló, nem LTR visszugrálat (non-LTR retrotransposon/retrosposon). Nem
kódol enzimet, csak segítséggel (pl. hosszú visszugrálat közreműködésével)
helyeződhet át – a hosszú visszugrálatból származik. Indítója az 5’-UTR-ben
van.
▪ rövid elszórt
visszugrálat* (short interspersed nuclear element, SINE) ~300 bázispárnyi,
nem önálló, nem LTR visszugrálat (non-LTR retrotransposon/retrosposon). Nem
kódol enzimet, csak segítséggel (pl. hosszú visszugrálat közreműködésével)
helyeződhet át – a hosszú visszugrálatból származik. Indítója az 5’-UTR-ben
van.
Az ugrálatok többsége „halott”: nem tevődik át; ezek másulás következtében elvesztik áthelyeződési képességüket. Jelentős részük epigenetikai szabályozókkal, pl. metilezéssel, a hisztonok módosításával némított, és csak nagyon kevés tevékeny, helyeződik át alkalomadtán. A kromatin tömörülése gátolja az áthelyeződést, ezért a heterokromatinban jóformán nincs is áthelyeződés.
Az emberi DNS ~50%-át ugrálatok teszik ki; összességében 2,5 billió bázispár nagyságúak. A gének 70–80%-ában vannak ugrálatok, zömében a köztesekben. Van olyan köztes, amely ~100 ugrálatot tartalmaz.
Az ugrálatok a DNS-állomány tartalékai, a DNS törzsfejlődési változásanak letéteményesei: Az áthelyeződés lehetővé teszi új gének kialakulását, pl. ha az ugrálat génbe ékelődik, megváltozik a gén szerkezete, az átalakulásból új gén keletkezhet. Így alakultak ki a törzsfejlődésben a környezeti változásokhoz alkalmazkodó gének. A másolódással áthelyeződők növelték a DNS-t, lehetővé téve, hogy a törzsfejlődésben bonyolultabb, a magasabban szerveződött élőlények létezéshez szükséges DNS-szerkezetek alakuljanak ki. Az ugrálatok szabályozhatják a gének működését, pl. áthelyeződésük valamely gén inditójának közelébe fokozhatja vagy gátolhatja az átíródást. Elősegítik a heterokromatin képződést, és ezzel rögzítik a DNS-t. A némított ugrálatok körüli kromatin ugyanis tömörül. Jelentősek az egyedfejlődésben a génműködés szabályozásával. Az ugrálat áthelyeződése azonban károsíthatja is a DNS működését: ha génbe ékelődik, megszűnik az adott gén működése, az indítórészhez kapcsolódása fokozhatja, pl. a daganatgének átíródását, de keletkezhet DNS-ingatagság, kromoszómatörés is. Ezek a DNS-hibák autoimmun, idegrendszeri, genetikai betegség és rák keletkezéséhez vezethetnek, fokozhatják a rákburjánzást.
várandóssági cukorbaj gestational diabetes változó nagyságú vércukor-emelkedéssel járó olyan szénhidrát-anyagcsere zavar, amely először a várandósságban nyilvánul meg, avagy derül ki. A szénhidrát-anyagcsere zavarának bármely formája lehet. Legtöbbször a 24–28. héten végzett szűréskor ismerjük fel. Akkor beszélünk várandóssági cukorbajról, ha az éhomi vércukorérték 7+ mmol/l és/vagy a kétórás terhelés 7,8+ mmol/l. Felismerése fontos, mert károsíthatja az anyát és a magzatot is. A szülést követő 6–8. héten ellenőrző vércukorterhelést végzünk. Az értékek lehetnek élettaniak, de maradhatnak kórosok is. Ezek az asszonyok veszélyeztetettek, folyamatos ellenőrzést igényelnek.
Korábban terhességi
cukorbajnak nevezték, és ezt ma is gyakran mondják. Mióta a babát váró édesanya
jelzője várandós, állapotos stb., de nem terhes, a szénhidrát-anyagcserezavar
is várandóssági cukorbaj (terhességi cukorbaj).
vegytérszerkezet spatial arrangement a molekula atomjainak térbeli elhelyezkedése. Szerepe meghatározó a molekulák tevékenységében, kapcsolódásában más molekulákkal. Például a fehérjék működését a térszerkezeti változások irányítják; az egyenes vonalú fehérjék működésképtelenek. Jelentős továbbá a molekulák felismerése szempontjából is, például az enzimek ugyanannak a fehérjének csak egyik térszerkezetét azonosítják. A molekula (ion) térbeli szerkezetét a legkisebb energiaállapot (local minimum) jellemzi; a térszerkezet kialakulása eszerint megy végbe.
A molekula-térszerkezetnek két formáját különböztetjük meg: téralakzatot és térhelyzetet.
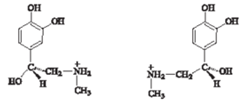 ▪ Téralakzat* (configuration,
▪ Téralakzat* (configuration, konfiguráció)
a molekula atomjainak, atomcsoportjainak az elektron kötések szerinti térbeli
elhelyezkedése, pl. egy központi szénatom körül miként helyezkednek el a
kapcsolódó atomok/molekulák. (→térazonmásság) Az ábra az epinefrin természetes
és nem természetes formáját mutatja. Az enzim csak az előbbit ismeri fel: ez
illeszkedik az enzim sarkalló hasadékába (catalytic cleft).
▪ Térhelyzet* (conformation, konformáció)
a molekula atomjainak, atomcsoportjainak nem elektron kötések szerinti térbeli
elhelyezkedése: az egymással nem elektronkötéssel kapcsolódó atomok hoznak
létre másodlagos kapcsolódásokkal. Egy egyszeres kötés mentén való
elfogathatóság következményei. Gyűrűs vegyületek lehetséges gyűrűalakzata.
(→térazonmásság)
- Térhelyzetváltozás (allostery, allosztéria)
enzimnek vagy más fehérjének olyan térhelyzeti módosulása, amely a térkötő
helyéhez (nem a hatóhelyhez) kapcsolódó molekula következtében jön létre.
(→enzim, fehérje).
- Térhelyzeti (térkötéshelyi) szabályozás (allosteric regulation, allosztérikus szabályozás)
a több kötőhelyes fehérjéknek (enzimeknek) olyan térhelyzetváltozásából adódó
szabályozása, amely a szabályozómolekulának (effector molecule) a fehérje
(enzim) térkötő helyéhez (nem a hatáshelyéhez) való kapcsolódására jön létre. A
kapcsolódó molekula kivált olyan térbeli átalakulást, amely befolyásolja a
fehérje másik kötőhelyének viselkedését, például szabaddá válik, és molekulát
köt. Ez a fehérjék (enzimek) egyik leggyakoribb szabályozási formája.
vezető szál leading strand 5’→ 3’ irányban másolódó új DNS-szál a kettőződési villában. Ez az új DNS szál a kettőződési buborék növekedésével azonos ütemben, folyamatosan jön létre. A vezető DNS-szál képződése a villa keletkezési irányával – az eredeti DNS-lánc szétválásával – megegyező irányba halad. (→DNS-szálak képződési folyamata)