Fc-peptid peptibody peptidből és Fc-töredékből álló vegyület, általában gyógyszerek. A peptidek, mint hatóanyagok jól használható gyógyszerek; a peptidek ugyanis könnyen fajlagossá tehetők, meglehetősen tisztán előállíthatók, továbbá – mert a sejtekbe alig hatolnak be – célzottan a jelfogók sejtkívüli részeihez kapcsolódhatnak. Hátrányuk a rövid élettartam. Ez hidalható át az IgG Fc-töredékének a peptidhez való kapcsolásával: lényegesen növekszik a keringési felezési idejük.
Találatok címszavakban (4 szócikk):
peptidek peptides peptidkötéssel kapcsolódó aminosavak (ábra). A peptidek a szervezetben szabadon is előfordulnak, működésük nagyon változatos. Az összekapcsolódott aminosavak számától függően di-, tri- stb. peptidekről beszélünk. A néhány aminosavat tartalmazó az oligopeptid, a 10+ aminosavból állót pedig egyezményesen polipeptideknek nevezzük. Nagyobb polipeptidben az aminosavak száma akár kétezer is lehet.
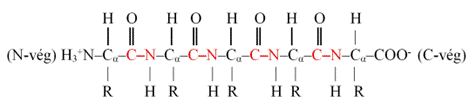 A peptid aminosavsora (peptidlánc) vázlatosan. A
molekula gerincét (peptidgerinc) az ismétlődő peptidkötésekkel [pirossal
jelölve] kapcsolódó szénatomok alkotják; ezek egy síkban helyezkednek el. A
molekula egyik végén amino- (N-vég, N terminal) a másikon karboxilcsoport
(C-vég, C terminal [carboxyl]) van. Megállapodás szerint az elöl lévő az N-vég, a
hátul lévő pedig a C-vég. Az aminocsoport pozitív, a karboxilcsoport negatív
töltésű – a peptidek tehát (miként az aminosavak) ikerionok. A bennük lévő
aminosavak az egymáshoz kötődések miatt nem teljesek; ezek nemzetközi neve amino
acid residue, magyarul aminosav-maradék. Az R az aminosavak
oldalláncait jelöli; ezek a peptidekben is változatlanok, és szokásosan
ellentett (transz) helyzetűek, vagyis az oldalláncok ellentétesen helyezkednek
el, egymástó távolodva, ezért elférnek, nem akadályozzák egymást – nincs
térbeli nehézség. Az azon- (cisz) helyzetben az oldalláncok az egyik oldalon
vannak, közöttük térbeli akadály lehetséges. A térbeli akadályoztatás
elektronok kilökődéséhez vezethet, ezért kell több energia az azonhelyzetű
molekula egybetartásához, és ezért nem marad meg. Az ellentett helyzet tehát
kisebb energiaigényű, következésképpen biztonságosabb.
A peptid aminosavsora (peptidlánc) vázlatosan. A
molekula gerincét (peptidgerinc) az ismétlődő peptidkötésekkel [pirossal
jelölve] kapcsolódó szénatomok alkotják; ezek egy síkban helyezkednek el. A
molekula egyik végén amino- (N-vég, N terminal) a másikon karboxilcsoport
(C-vég, C terminal [carboxyl]) van. Megállapodás szerint az elöl lévő az N-vég, a
hátul lévő pedig a C-vég. Az aminocsoport pozitív, a karboxilcsoport negatív
töltésű – a peptidek tehát (miként az aminosavak) ikerionok. A bennük lévő
aminosavak az egymáshoz kötődések miatt nem teljesek; ezek nemzetközi neve amino
acid residue, magyarul aminosav-maradék. Az R az aminosavak
oldalláncait jelöli; ezek a peptidekben is változatlanok, és szokásosan
ellentett (transz) helyzetűek, vagyis az oldalláncok ellentétesen helyezkednek
el, egymástó távolodva, ezért elférnek, nem akadályozzák egymást – nincs
térbeli nehézség. Az azon- (cisz) helyzetben az oldalláncok az egyik oldalon
vannak, közöttük térbeli akadály lehetséges. A térbeli akadályoztatás
elektronok kilökődéséhez vezethet, ezért kell több energia az azonhelyzetű
molekula egybetartásához, és ezért nem marad meg. Az ellentett helyzet tehát
kisebb energiaigényű, következésképpen biztonságosabb.
A peptideket alkotó aminosavak sorrendjét az NH2-csoportot tartalmazó aminosavtól (N-vég) kezdjük, és az aminosavak nevének három vagy egy betűs rövidítéseivel írjuk le. Pl.: Leu–Asp–Gly–Lys (leucin, aszparagin, glicin és lizin).
Az egy síkban lévő peptidgerincet az N–Cα–C–N kötések sora alkotja. Ezek a Cα melletti kötésekben (N–Cα, illetőleg Cα–C) kötésekben elfordulhatnak, kialakítva a peptidek térhelyzetét. Az N–Cα kötés elfordulásának szöge a φ-szög, Cα–C kötésé a ψ-szög. A szögeket a négy atom síkja szerint állapítják meg, azt fejezik ki, hogy Cα–C–N által meghatározott sík mennyire fordult el a N–Cα–C síkjához viszonyítva.
A peptidek tulajdonságait (savas, bázikus jelleg, kötődések, részvétel vegyfolyamatokban, oldhatóság stb.) alapjában az oldalláncok határozzák meg. A peptidek azonban nemcsak az oldalláncokon, hanem a szabad amino- (N-vég) vagy karboxilcsoportokkal (C-vég) is kapcsolódhatnak más molekulákhoz.
A peptidek a szervezetben szabadon is előfordulnak, működésük nagyon változatos, pl. peptidhormonok. Gyakori bennük a szerkezetüket rögzítő S–S-híd (inzulin, oxitocin stb.).
peptidkapcsoló össztes peptide loading complex, PLC az antigén-meghatározót (kis peptid) az MHC1-fehérjével kapcsoló fehérjeössztes, amely a sejtcsövecsezetben (ER – endoplasmatic reticulum) képződik. A TAP (transporter associated with antigen-processing) szállítófehérjéből és az MHC1–peptid kapcsolódást végző dajkafehérjékből (tapazin, ERp57, kalretikulin-kalnexin kettős) tevődik össze. A TAP szállítja a sejtplazmában keletkező, bemutatandó kis peptideket a sejtcsövecsezet hártyájához, és kötődik hozzá. A hártya belső felszínén a dajkafehérjék a módosulatlan MHC1-fehérjét a hártyához fűzik. A tapazin létesít kapcsolatot a megfelelő peptidet tartalmazó TAP fehérje és az MHC1 között, az ERp57 és a kalretikulin–kalnexin kettős rögzíti a szerkezetet. Így válik lehetővé a megfelelő peptid (antigén-meghatározó) és az MHC1 kapcsolódása. A fajlagossá formálásban részt vesz még az ERaap (aminopeptidase associated with antigen processing in the ER, ERAAP) (→ERp57, kalretikulin, TAP, tapazin)
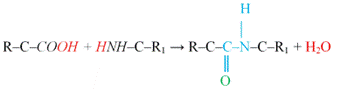 peptidkötés peptide bond akkor keletkezik,
ha az egyik aminosav karboxilcsoportjának α- (nem oldallánci) szénatomja a
másik aminosav α-aminocsoportjának nitrogénatomjával elektronkötéssel társul;
ez az amino- és a karboxilcsoportok vízkilépéssel végbemenő egyesülésével jön
létre (–CO–NH–). Az NH2-ből egy hidrogén, a COOH-ból egy OH-csoport
hasítódik le, és alakul vízzé (pirossal jelölve). R az egyik, R1 a
másik aminosav oldallánca. A peptidkötés hagyományosan írva, kékkel jelölve. A peptidkötésben
a hidrogén és az oxigén ellentett oldali (transz térhelyzetű). A folyamat
fordítva is végbemegy: a peptidkötés vízhozzáadással bontható.
peptidkötés peptide bond akkor keletkezik,
ha az egyik aminosav karboxilcsoportjának α- (nem oldallánci) szénatomja a
másik aminosav α-aminocsoportjának nitrogénatomjával elektronkötéssel társul;
ez az amino- és a karboxilcsoportok vízkilépéssel végbemenő egyesülésével jön
létre (–CO–NH–). Az NH2-ből egy hidrogén, a COOH-ból egy OH-csoport
hasítódik le, és alakul vízzé (pirossal jelölve). R az egyik, R1 a
másik aminosav oldallánca. A peptidkötés hagyományosan írva, kékkel jelölve. A peptidkötésben
a hidrogén és az oxigén ellentett oldali (transz térhelyzetű). A folyamat
fordítva is végbemegy: a peptidkötés vízhozzáadással bontható.
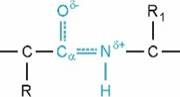 A peptidkötés
elektroneltolódással rögzített (resonance stabilized), ez a peptidkötésben lévő
nitrogén nem kötő elektronpárjának a kötés oxigénjére való áttevődésével jön
létre. Az elektronpárt átadó nitrogénnek részleges pozitív (δ+)
töltése van, a karbonil (C=O) oxigénje viszont részlegesen negatív (δ-),
ezért keletkezik közöttük gyakran hidrogénhíd, ha közelségbe kerülnek
egymáshoz. Az átalakulás következtében részleges kettőskötések alakulnak ki:
A peptidkötés
elektroneltolódással rögzített (resonance stabilized), ez a peptidkötésben lévő
nitrogén nem kötő elektronpárjának a kötés oxigénjére való áttevődésével jön
létre. Az elektronpárt átadó nitrogénnek részleges pozitív (δ+)
töltése van, a karbonil (C=O) oxigénje viszont részlegesen negatív (δ-),
ezért keletkezik közöttük gyakran hidrogénhíd, ha közelségbe kerülnek
egymáshoz. Az átalakulás következtében részleges kettőskötések alakulnak ki:
A részleges kettőskötés a szén- és a nitrogénatom, illetve a szén- és az oxigénatom közt rögzíti a kötést, ezért a kötés mozdulatlan, nem fordul el, szöge 120o. A peptidkötés atomjai és a hozzájuk kötődő 1-1 szénatom egy síkban vannak.
izopeptidkötés isopeptide bond olyan peptidkötés, amely a kapcsolódó két aminosavnak nem a COOH és az NH2 szén és nitrogénje (α-C és α-N) között jön létre; a nitrogén valamelyik másik szénatomhoz kötődik.
Találatok alcímszavakban (1 szócikk):
poli- az angol poly- magyarosan írt formája (→poly) ■ polimer, polimerizáció →összlet ■ polimorfizmus (→sokalakúság) ■ polipeptid (→peptid)
Részleges egyezések (1 szócikk):
TPP1 (tripeptidyl-peptidase 1) a kromoszómák végrészében található fehérje, a védlet (shelterin) tagja. Korábban 3 csoportból ( TINT1, PTOP, PIP1) álló fehérjének tartották, nevét ezek kezdőbetűiből kapta) (egyéb név: ACD adenocortical dysplasia protein homolog) kettőst képez a POT1 fehérjével (POT1–TPP1 kettős), így fejti ki hatását, és így kapcsolódik a TIN2-höz. (→POT1, végrész)
Az N-végen van az OBD1 gomoly (OB-fold domain), amely a telomerázt toborozza a végrész DNS-éhez. Középen található a PBD (POT1 binding domain) a POT1-t kötve képez kettőst. A C-végen pedig a CTD (C terminal domain) található, több serin–treonin foszforilációs hellyel. Ez lép kapcsolatba a TIN2-vel.
A TPP1 a végrész alapvető védője: a telomerázt kapcsolja a DNS egyszálú túlnyúlásához, és szabályozza a működését. Továbbá összeköti a végrész egyszálú és a kétszálú DNS-t rögzítő fehérjéket a védletben. Hibája végzetes következményekkel járhat.