ész többjelentésű. 1. Értelmi képesség (ésszel felfoghatatlan). 2. Józan gondolkodás (inkább az eszemre hallgatok). 3. Tudat (mindig tartsd az eszedben).
Találatok címszavakban (4 szócikk):
észlelés apperception az inger tudatossá (képzetté, fogalommá) válása; az inger feldolgozása az elmével; több részből tevődik össze. Ez a felfogás harmadik szakasza.
észlel tudatosulva érzékel.
észlelet az észlelés eredménye.
észlelhető felfoghatóan érzékelhető.
észrevevés noticing megpillantás, meghallás, felfigyelés valamire (pl. tudományos vizsgálatnál); tárgya az inger. Ez a felfogás első szakasza.
észrevesz megpillant, meghall, felfigyel (valamire).
észrevehető meglátható, meghallható (tünet).
észterek észterkötést tartalmazó vegyületek, az oxigéntartalmú szénvegyületek egyik csoportja. Savakból (karbonsavak és ásványi savak) és alkoholokból vízkilépéssel keletkeznek.
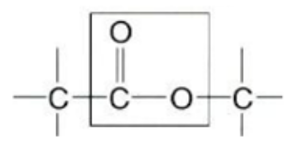
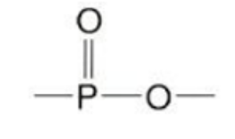 észterkötés olyan kétoxigénes kötés, amelyben a szén- vagy más atomhoz egy egyes és
egy kettős kötéssel kapcsolódik oxigén. Az első ábrán az észtercsoportot, a
szénatomú észterkötést, keretezés jelöli. A második ábra foszfátészter.
(→foszfodiészter-kötés)
észterkötés olyan kétoxigénes kötés, amelyben a szén- vagy más atomhoz egy egyes és
egy kettős kötéssel kapcsolódik oxigén. Az első ábrán az észtercsoportot, a
szénatomú észterkötést, keretezés jelöli. A második ábra foszfátészter.
(→foszfodiészter-kötés)
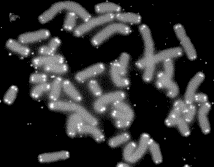 végrész* telomere (
végrész* telomere (telomer)
a kromoszómák végződése, tömör kromatinba csomagolt sajátos nukleinfehérje
rendszer, amely megóvja a kromoszómákat attól, hogy a DNS-hibajavító rendszer
tévesen kettős törésnek nézze, és kivágja vagy vég a véghez egyesítse stb.
Vagyis akadályozza a kromoszóma elhajlását, kóros átalakulását, valamint a
kóros sejtburjánzást és a rákosodást is. Az ábrán az osztódó sejt
kromoszómáinak végein látható fénylő részek a végrészek. (Forrás: Wikipédia.)
A végrész a végrész-DNS*-ből (telomeric DNA) és a hozzákapcsolódó sajátos fehérjékből, a végrészfehérjékből* (telomeric proteins) tevődik össze:
● Végrész-DNS. Rövid kétszálas fej–láb 5’→3’ irányú TTAGGG ismétletek sokaságából (500–3000 ismétlet, 2–10 kb hosszú) és 3’-végi guaninban gazdag, 50–300 nukleotidot tartalmazó egyszálas túlnyúlásból (overhang) áll. A túlnyúlás visszahajlik a kétszálú DNS-be, és azzal együtt hurkot formál, amelyet visszahajló T-huroknak* nevezünk (fold-back t-loop).
A TTAGGG ismétleteket telomere repetitive DNA sequencesnek nevezik, magyarul: végrészismétletek*. Az ismétletek száma nemcsak az emberek közt eltérő, de az egyénben is változik: a korosodással csökken.
A túlnyúlásban gyakoriak a másodlagos szerkezetek, mint a G-négyesek és az R-hurkok.
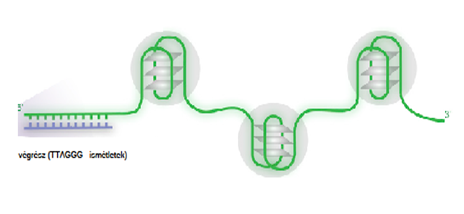
▪ A G-négyesek (guaninnégyesek, G-quadruplexes, GQs), amelyek törzsökös másodlagos DNS-mintázatok; az ábrán látható túlnyúlásban három G-négyes van. Kialakulásukat segíti, hogy a túlnyúlás különösen gazdag guaninban; előfordulnak benne sok guanint tartalmazó sajátos ismétletek is, pl. GGGCTA. Jellemző az is, hogy a túlnyúlásban kevés a cisztein.
A G-négyeseknek meghatározó szerepük van túlnyúlás védelmében. Ezek állékony szerkezetek, egymás után kialakulva tömör szerkezetet hoznak létre, így gátolják a túlnyúlás lebontását, vég a vég egyesülését más kromoszómával. A G-négyesek felismerő mintázatok, hozzájuk kapcsolódnak a helikázok és más fehérjék. Gátolják a végrészek telomerázok általi megnyújtását, ekként a ráksejtek elpusztításának célpontjai lehetnek.
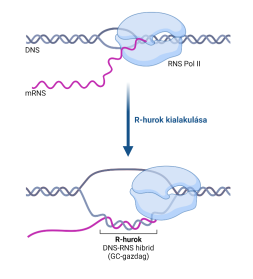 ▪ Az R-hurok háromszálú nukleinsavszerkezet, amely egy DNS–RNS
keresztezésből és a kapcsolódó, nem minta egyszálú DNS-ből áll. Az R-hurkok
különféle körülmények között képződhetnek, és a sejt megtarthatja vagy törli
őket.
▪ Az R-hurok háromszálú nukleinsavszerkezet, amely egy DNS–RNS
keresztezésből és a kapcsolódó, nem minta egyszálú DNS-ből áll. Az R-hurkok
különféle körülmények között képződhetnek, és a sejt megtarthatja vagy törli
őket.
Általában olyan DNS-bázissorok (főleg magas GC-tartalmúak) átíródásával hozhatók létre, amelyek elősegítik a haladó RNS-polimeráz mögötti RNS összekapcsolódását. Legalább 100 bp DNS–RNS kereszteződés szükséges az állékony R-hurok kialakításához.
Meglepően sok van a végrészeken, a kettőződésben keletkező hibák, a DNS-törések kialakulásában is van jelentőségük. Elősegítik a végrészek átrendeződéses hosszabbítását. (→végrészrövidűlés)
A visszahajló T-hurok szintén meghatározó a kromoszómák védelmében; úgymond „lefedi” a végrészt (telomeric capping). A visszahajlás következtében ugyanis a DNS-javító fehérjék nem nézik törésvégnek a végrészt, és nem bontják le. Gátolja még a kromoszómák elhajlását, az egymással való kapcsolódásukat, átrendeződésüket. A végrész átíródásában, másolódásában valószínűleg nincs szerepe.
Kialakulását elősegítik az ismétletek, ezekhez könnyen kapcsolódnak a túlnyúlás bázisai. A T-hurok nemcsak a túlnyúlást foglalja magában, hanem különböző hosszúságú kétszálas DNS-szakaszt is.
A túlnyúlás bázissoraiban előfordulnak sajátos hibák, mint a 8oxoG, amelyek kettőződési hibákat okozhatnak. (→8oxoG)
● Végrészfehérjék. Hat fehérje, a TRF1, TRF2, POT1, RAP1, TIN2 és a TPP1 képződmény, amelyet védletnek* (shelterin, telosome) nevezünk. (→POT1, RAP1, TIN2, TPP1, TRF1, TRF2)
A védlet fehérjéi eltérően kötődnek a végrészhez. A vázlatos ábrán ez látható.
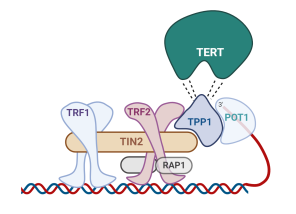 ▪ A TRF1 és a TRF2
kettős formában kötődik a kétszálú DNS-hez a C-végi MYB gomollyal. A
kapcsolódás vonzza a RAP1-et, amelyik az egyik TRF2-höz kapcsolódik.
▪ A TRF1 és a TRF2
kettős formában kötődik a kétszálú DNS-hez a C-végi MYB gomollyal. A
kapcsolódás vonzza a RAP1-et, amelyik az egyik TRF2-höz kapcsolódik.
▪ A POT1 sajátosan az egyszálú túlnyúláshoz kötődik, és kettőst képez TPP1-gyel, így fejti ki hatását. A POT1–TPP1 kettős toborozza a telomerázt.
▪ A TIN2 összekapaszkodik a TRF1, TRF2–RAP1, és POT1–TPP1 kettős fehérjékkel.
▪ A TIN2–TPP1–POT1 önállóan – a TRF1-hez és a TRF2-höz való kapcsolódás nélkül – is előfordul, ezért a védlet alegységének tartják.
A végrészen számos védlet van: A TRF1–TRF2–RAPI–TIN2 négyesek szakaszosan kapcsolódnak a kétszálú végrészhez, a POT1 – TPP1 szintén szakaszosan az egyszálúhoz. A kettő csak ott kapcsolódik össze, ahol közel kerülnek egymáshoz; az ábra ilyen helyzetet mutat.
A védlet jelen van minden sejtben, függetlenül a burjánzási állapotától, és megmarad a sejtkör egészében, a végrészek oltalmazója. Tevékenysége többrétű:
▪ Állványfehérjeként szolgál más fehérjék kapcsolódásához, például a TIN2–TPP1 kapcsolódás toborozza a telomerázt a végrészhez.
▪ Megakadályozza, hogy az ATM és az ATR kinázok a kromoszómavéget tévesen kétszálú DNS-törésnek érzékeljék, és elindítsák a javítási folyamatokat. A TRF1 gátolja a DNS-kettőződési ártmányt (replication stress); TRF2 feltartóztatja az ATM-jelzést és a végegyesítést (non-homologous end-joining, NHEJ); a POT1 pedig az ATR-jelzést akadályozza meg. (→DNS-hibajavítás)
▪ Gátolja a G1–S és a G2–M átmenetet, a sejtöregedést és a sejtvégzetet.
▪ A telomeráz kötésével elősegíti a végrész-DNS hosszabbítását, a TTAGGG ismétletek telomeráz általi hozzákapcsolását, akadályozva a sejtvégek rövidülését, és ezzel befolyásolja a sejt élettartamát:
Az emberi sejtekben ugyanis, kivéve a csírasejteket, az éretlen sejteket és néhány őssejtet, a végrész minden sejtosztódással rövidül; végül olyan röviddé válik, hogy elveszti a védletet, megszűnik a hurok. Az egyenes végeket a DNS-hibajavítók törésnek érzékelik, kapcsolódnak hozzá, és megállítják a sejtkört, nincs további sejtosztódás. A végrészek a hasonmás és/vagy vég–vég egyesítés következtében átalakulnak, nem védik a kromoszómát, beindul a sejtvégzet, a sejt elpusztul. Ezért nevezik a végrészt a sejt biológiai órájának. (→végrészrövidülés)
■ Végrészkromatin. A végrészeket tömör kromatin burkolja, benne a kromatin tömörödés jellemzői, a metilezett H3 és H4 (H3K9me3, H4K20m) gyakoriak. A tömör kromatin védi a végrészeket a hibás átrendeződésektől és gátolja a gének átírását; távhatással is. Ez azt jelenti, hogy a végrész kromatin a közelében (a végrész alatti szakaszban) lévő géneket is némítja. A jelenséget a nemzetközi irodalom telomere position effect (TPE) elnevezéssel illeti, magyarul végrészhatásnak* mondhatjuk. Ennek ismeretében meglepő, hogy a végrész átíródik, végrész-RNS keletkezik.
Részleges egyezések (46 szócikk):
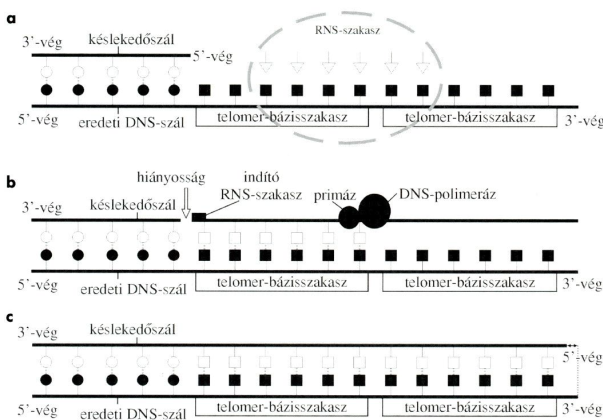 DNS-végrészek másolása A kromoszómavégek, a végrészek (telomers),
hat–nyolc nukleotidos ismétletekből állnak.
DNS-végrészek másolása A kromoszómavégek, a végrészek (telomers),
hat–nyolc nukleotidos ismétletekből állnak.
a. Az újonnan képződött DNS-lánc 5’-vége a késlekedő-, a 3’-vége az eredeti DNS-szál; a szálak egyforma hosszúak. Az utóbbihoz a telomeráz hozzákapcsolt két hatnukleotidos ismétlődő bázissort (végrész-bázisszakaszt) (■ négyzetekkel jelölve). A bázissor a telomerázban lévő RNS bazissorrendje szerinti.
b. A végrész-bázisszakaszok mintafelszínül szolgálnak. A primáz és DNS-polimeráz ennek alapján képezik a késlekedő DNS-szál 5’-végénél az utolsó töredékszakaszt. Ez a töredékszakasz szintén két, hat-hat nukleotidot tartalmazó végrész-bázisszakaszból áll.
c. A töredékszakasz összekapcsolásakor az RNS-nukleáz eltávolítja az indító RNS-szakaszt; a késlekedő DNS-szál – az 5’-végénél – ennyivel rövidebb marad.
A végrészek csak azokban a sejtekben kettőződnek, amelyekben tevékeny telomeráz enzim van jelen. A telomeráz – vagy a telomeráz-működés – szöveteink nagy részében idővel csökken, de néhány sejtformában, mint például a szöveti őssejtekben, az ivarsejtekben vagy a daganatsejtekben folyamatos.
egészség health a szervezet olyan élettani állapota, amelyben sejtjei, szövetei, szervei, rendszerei stb. jóformán az élettani feladataiknak megfelelően működnek, az előforduló kisebb-nagyobb zavarok nem okoznak betegséget. Magában foglalja a szervezet megfelelő testi, lelki és tudati tevékenységét.
egészségmegőrzés* health longevity az egészséges állapot megtartása, a betegségek elkerülése.
Egészségmegőrzés-tan* health longevity medicine tudomány, amely magában foglalja az egészség megtartásának kérdéseit.
Egészségmegőrzősi klinikaSP health longevity medicine clinic olyan intézmény, amely az egészség megőrzésének gyakorlati kérdéseivel foglalkozik.
elektronrészecsszám* electron quantum number az elektron energiáját kifejező számértékek. Négyféle van. Csak egész- vagy félegészszám lehet. Gyakran betűkkel jelöljük.
▪ főrészecsszám*, héjenergia* (principal quantum number, jele: n) az elektronnak az elektronhéj szerinti energiaszintjét jelölő szám. Az elektronhéj száma; a Bohr-féle atomelmélet energiaszintjét jelölő sorszám: n = 1, 2, 3, 4, 5, 6 vagy 7 (nem lehet 0 vagy negatív). Minél nagyobb az elektron n értéke, annál távolabb van az atommagtól – tehát a magtól távolibb elektronok n értéke a nagyobb. Az n = 1 az az energia, amely az elektronnak a H atomból való eltávolításához szükséges; értéke: ~13 eV. Az n = 2, 3… gerjesztett állapot. (→Bohr-féle atomelmélet, elektronburok)
▪ mellékrészecsszám, perdületszám*, alhéjenergia* (angular momentum quantum number; jele: l [az 1-gyel való összetévesztés miatt írható L-lel is]) az elektronalhéjakra vonatkozik, az elektronpálya egybevágóságát írja le. Az l értéke a főrészecsszámtól (n) függ; nem lehet nagyobb, mint n−1 (0, 1, 2, 3… n−1); például ha n = 3, az l lehet 0, 1 vagy 2 (2 = 3−1). Az l értékeit az alhéjak betűivel (s, p, d, f) adjuk meg: az l = 0 az s-alhéjnak, az l = 1 a p-alhéjnak, az l = 2 a d-alhéjnak, az l = 3 pedig az f-alhéjnak felel meg. (→elektronburok)
▪ mágnességi részecsszám* (magnetic quantum number) az elektronhelyeket adja meg az alhéj energiatartományában. Jele: ml. Értéke a perdületszám (l) függvénye = −l → l. Ha l = 0, az ml is 0 – ez felel meg a s-alhéj egyetlen elektronhelyének. Ha l = 1, az ml lehet −1, 0, 1 – megfelel a p-alhéj elektronhelyeinek; ha l = 2, az m1 lehet −2, −l, 0, 1, 2 (a d-alhéj elektronhelyei); ha l = 3, az ml, lehet −3, −2, −1, 0, 1, 2, 3 – megfelelően az f-alhéj hét elektronhelyének. (→elektronburok)
▪ sajátperdületszám* (spin quantum number) az elektron sajátperdületi állapotát jelöli. Értéke kétféle: +1/2 (spin up) vagy −1/2 (spin down).
Két elektronnak egy atomban nem lehet ugyanaz a négy részecsszáma, a Pauli-féle kizárási elvből adódóan. Azaz a részecsszámokkal minden egyes elektron leírható.
enyészetjelfogók scavenger receptors, SRs mintázatfelismerő sejtfali jelfogók. Különböző szerkezetű és tevékenységű jelfogok sokaságának nagycsaládja. Nemcsak a károsságmintázatokat (DAMP, demage-associated molecular pattern), hanem kórokozótársult mintázatokat (PAMP, pathogen-associated molecular pattern) mintázatokat is felismerik. A szervezet számára káros saját és idegen molekulákat távolítják el a sejtbekerülés, a sejtfalás, tapadások és jelzések segítségével; ez a közös bennük. Lényeges a szerepük van a szabadgyökök rendszerében, a sejtvégzetben és az érképződésben. Sokféle enyészetjelfogó van; ezeket osztályokba sorolják. Az egyes osztályokat nagybetűvel jelöljük (A–L: SR-A, SR-B… SR-L [SR a scavenger receptor nemzetközi betűszója]). Az osztályon belüli fajtát arab szám jelzi (SR-D1), ennek változátát pontot követő szám adja meg (SR-A1.2 – az enyésztésjelfogó A osztálya első fajtájának második változta).
Class A (SR-A) 2-es formájú (~400–500 aminosavas) sejtfali jelfogó rövid sejtbeli (N-vég), kifejezett sejten kívüli résszel. Jellegzetessége a kollagénszerű gomoly; kollagéneket kötnek. Jelentősek: SR-A1, SR-A3, SR-A4, SR-A5 és SR-A6 (részletezésük túlterjed a nevezettár keretein; egyet-egyet külön címszóként ismertetek).
Class B (SR-B) Patkó alakú (~400–450 aminosavas) sejtfali jelfogó két hártyai résszel. Az N- és a C-vége is a sejtplazmában van. Jelentősek: SR-B1, SR-B2 és SR-B3; a jelzésközvetítésben és sejtbeli szállításban vesznek részt.
Class C (SR-C) emberi sejtben nincs.
Class D (SR-D) Csak az SR-D1 jelentős, amely 1-es sejtfali (354 aminosavas) jelfogó; az immun- és a csontvelősejteken fejeződik ki. Rövid (12 aminosavas) sejtbeli és kétgomolyos sejten kivüli része van: az N-vég közeli nyákszerű (N-proximal mucin-like domain) és a LAMP (lysosome-associated membrane protein) gomoly; ezeket proléngazdag kapcsolórész köt össze. Az SR-D1 (CD68) gén kódolja, amely a 17-es kromoszómán van.
Class E (SR-E) Csak az SR-E1 (más néven lectin-like oxidized low-density lipoprotein receptor, LOX-1/OLR1/SR-E1) jelentős, amely 2-es sejtfali (273 aminosavas) jelfogó rövid sejtbeli véggel. A sejtkívüli C-lecitinszerű gomoly (C-type lectin-like domain) fonadék (coiled-coil) nyélen ül. A természetes immunfolyamatokban vesz részt. A 12-es kromoszómán lévő SR-E1 gén kódolja.
Class F (SR-F) Az SR-F1 (SREC1) és SR-F2 (SREC2) jelentős. Mindkettő 1-es sejtfali (850–900 aminosavas) jelfogó, sejtkivűli ~450 aminosavas gomolyukban EGF-szerű ismétletek vannak, a sejtbeli gomolyuk viszonylag nagy (~400 aminosavas). Az SR-F1 gén a 17-es, az SR-F2 gén a 22-es kromoszómán található. Az SR-F1 LDL- (cLGL, acLDL [acetylated low-density lipoprotein], oxLDL [oxidized low-density lipoprotein]) részecskéket köt, az idegsejteken és béléssejteken fejeződik ki. Az SR-F2 kettőst képez az SR-F1-gyel, és gátolja annak működését.
Class G (SR-G) Az Sr-G fehérje (SR-PSOX) 1-es sejtfali (254 aminosavas) jelfogó; más néven kemokin-16 (CXCL16). Sejkívüli gomolya irányítja a foszfatidilszerin (oxLDL) sejtesedését és a beltestecs–emésztőtestecs rendszerbe szállítását. Jelentős szerepe van természetes immunitásban, baktériumokat köt. Az SR-G gén a 17-es kromoszómán van.
Class H (SR-H) Az SR-H1 és SR-H2 ismert, mindegyik 1-es sejtfali jelfogó; szénhidrátfehérje sokféle sejtkívüli gomollyal: fascilin, EGF-szerű, laminin-formájú EGF-szerű és kapcsoló (FEEL) gomoly. Többek között immunfolyamatokban vesznek részt. Az SR-H1 gént a 3-as, az SR-H2 gént a 12-es koromoszóma tatrtalmazza,
Class I (SR-I) Az SR-I1 (CD163) ismert, ez 1-es sejtfali jelfogó; szénhidrátfehérje, rövid sejtbeli, hosszú sejtkívüli résszel, benne SRCR (type B scavenger receptor cysteine-rich) gomollyal. Elsődlegesen a vérsejtek rendszerében van szerepe. Főleg az egymagúakon (monocytes) és nagyfalósejteken fejeződiok ki. Az SR-I1/CD163 (M130) gén a 12-es kromoszómán van.
Class J (SR-J) Egyedüli tagja az SR-J1, amely 32 kDa nagyágú, mintazátfelismerő sejtfali jelfogó; génje az immunglobolinok nagycsaládjához tartozik. Sejtkívüli változó formájú gomolya (extracellular V [variable]-type domain) sokféle mintázati elemmel kötődhet: β-amiloid, kalgranulin (S100/calgranulin), foszfatidil-szerin, HMGB1 (high-mobility group protein 1) stb. A sejtbeli gomolya két C-forma gomoly (C-type domains). A gyulladásmolekulák tevékenységében van szerepe.
félegész szám ½-re végződő szám; a páratlan számok fele. A számítástani képlete n + ½, az n az egészszám, pl. 1½, 3½ stb.
foszfodiészter-kötés a
DNS-ben és az RNS-ben két nukleotidot összekapcsoló kötés; a dezoxiribóz/ribóz
3’OH és és a következő 5’OH szénetomjai közt jön létre foszfátcsoport
közbeiktatásával. ATP szükséges hozzá. A foszfátcsoport két oxigénatomja és két
dozoxiribóz vagy két ribóz hidroxilcsoportja között alakul ki. (→DNS-szerkezet, észterek) 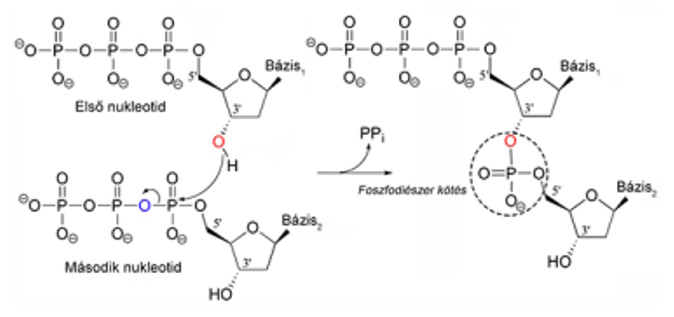
függvény (f) a számítástanban halmazok közötti hozzárendelés, Általában az A és egy tetszőleges B halmaz közötti. Ez azt jelenti, hogy az A-ból a B-be ható f függvény az A halmaz minden eleméhez hozzárendeli a B halmaz egy elemét. f: A → B. Ha az a az A halmaz egy tetszőleges eleme, akkor az f(a) az f függvény egyetlen értéke az a-ban.
■ Függvénnyel kapcsolatos fogalmak:
▪ Értelmezési tartomány. Az f: A → B függvényben az A halmaz az f függvény értelmezési tartománya. Jele: Df vagy D(f). Ekként ebben a függvényben a D(f) = A.
▪ Értékkészlet. A függvény értékkészlete; jele: Rf vagy R(f), a felvett értékek halmaza, amely a B halmaz része, de lehet azonos is vele. R(f) = {f (a): a ϵ D(f)} Ez azt jelenti, hogy az értékkészlet az f függvény összes értelmezési tartománybeli helyén felvett értékeinek a halmaza. ϵ = eleme. A képletben az a az értelmezési tartomány bármely elemét jelöli, az f(a) az f függvény a helyén felvett értéke. Az értékkészlet az f(a) értékek halmaza az összes lehetséges a értékre.
▪ Függvények egyenlősége. Két függvény, f és g, akkor egyelő, ha megegyezik az értelmezési tartományuk és azok minden pontja ugyanazt az értéket veszi fel.
■ A függvények megjelenítése: többféle. Megadhatjuk:
▪ Rendezett párok (az összekötött párok) között. A rendezett párok számpárok. f = {(0,0), (1,2). (2,4)… }. Ezt jelölik Venn-ábrázolással halmazábrákkal is, amelyben kör vagy lapított kör formájában rajzoljuk le a két halmazt (A-val és B-vel jelöljük őket), beleírjuk az elemeket, és nyilakkal jelöljük az összetartozókat.
▪ Táblázatban, amelyben vízszintes vonal két oldalán jelöljük az elemeket; az egyik oldal az x, a másik az y, és ezek mellé írjuk az elemeket:
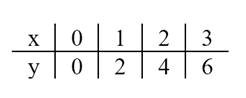
▪ A számpárokat elhelyezhetjük derékszögű →síkvonalas rendszerben.
▪ Képlettel. Ebben először azt jelöljük, hogy az első tagokból miként számoljuk a másodikat. A példánkban a második az elsőnek a kétszerese, vagyis: y = 2x.
A következőben jelölni kell, hogy mi lehet az első elem. Ha természetes számokkal dolgozunk, vagyis az x halmaz elemei természetes számok, amelyeknek a jele: N (ha a 0 is benne van: N0), akkor így: xϵN (mivel ϵ az „eleme” viszonyt jelöli, az xϵN azt jelenti, hogy az x elem természetes szám).
hámeredetű petefészekrák a petefészekben keletkező hámsejtekből létrejövő rák. A petefészekben kialakulhat rák a méhkürtből vagy a medence más területének a petefészekbe került hámsejtjeiből is. Ennek megkülönböztetése csak a fogalom szempontjából jelentős, ugyanis a saját vagy megtapadt hámsejtekből keletkező petefészekrák megjelenésében egyforma, genetikailag azonos; megkülönböztetésük az orvoslás szempontjából sem lényeges.
A petefészek, a méhkürt és a hashártya hámja azonos ébrényi eredetű, az ébrényi testüreg (coeloma) hámjának burjánzásából kialakult Müller-csőből származik. A Müller-csőből eredő különféle hámszövet (petevezető, méh, hüvely felső harmada, hashártya hámja) klinikailag és biológiailag is közel azonos; ekként a belőlük keletkezet rákok is. Ezt tükrözi közös eredetnevük: Müller-csői mirigyrákok (adenocarcinomas of Mullerian origin). Közös származásuk alapján a hámeredetű petefészekrákot, a méhkürtrákot és a hashártyarákot egy csoportba sorolják.
hámeredetű petefészekrákok szövetszerkezeti osztályozása az Egészségügyi Világszervezet (WHO) szerinti, azonos a méhkürtrákok és az elsődleges hashártyarákok szövettani osztályozásával; a WHO a hármat egy csoportba vonta. A következő csoportokat különbözteti meg:
◾ Savós petefészekrák
- határeseti, alacsonyfokú petefészekrák (5%) borderline, low-grade serous ovarian cancer (LGSOC)
- magasfokú petefészekrák (70–80%) high-grade serous ovarian cancer (HGSOC)
◾ Nyákos petefészekrák (3%) mucinous cancer (MC)
- alacsonyfokú petefészekrák low-grade mucinous ovarian cancer
- magasfokú petefészekrák high-grade mucinous ovarian cancer
◾ Savós-nyákos petefészekrák
- határeseti, nem csoportosított, meghatározott fokozatú, áttöréses
◾ Méhhámszerű petefészekrák (10%) endometrioid cancer (EC)
- alacsonyfokú méhhámszerű petefészekrák low-grade endometrioid ovarian cancer
- magasfokú méhhámszerű petefészekrák high-grade endometrioid ovarian cancer
◾ Világos sejtes petefészekrák (10%) clear cell carcinoma (CCC)
◾ Brenner-daganat (1–2%) Brenner tumor
◾ Elkülönületlen rák (1–2%) undifferentiated cancer
Kiegészítések:
▪ A hámeredetű petefészekrákok szövetszerkezete nagyon sokféle, messze nem egységes. Alapvetően négy főcsoport van (savós, nyákos, méhhámszerű és világos sejtes), a többi módfelett ritka.
▪ A p53-pozitív magasfokú savós, magasfokú világos sejtes és magasfokú méhhámszerű rákokat egybeveszik a magasfokú rákok, avagy a HGSOC fogalomköreként.
▪ A savós-nyákos petefészekrákok külön csoportba sorolásának jogosságát többen kétségbe vonják; a méhhámszerű petefészekrák változatának tekintik őket. Nevük arra utal, hogy savós és nyákos együttes daganatok, amely nem igaz; csupán a méhnyakra emlékeztető szövetszerkezetűek.
▪ A határeseti rákok a petefészekrákok ~15%-ában fordulnak elő.
▪ Gyakorlati jelentőségű, hogy a hámeredetű petefészekrákok zöme (>95%) magasfokú savós petefészekrák.
Szöveti elkülönülés szerint két fokozatot: alacsonyfokozatú (low-grade, low risk) és magas fokozatú (high-grade) formát különít el. A WHO szövetszerkezeti felosztásába nem építi be a génhibákat, fehérjeváltozásokat.
health longevity →egészségmegőrzés
kezelés therapy, treatment az orvostudományban betegség leküzdésére alkalmazott gyógymód; gyógykezelés.
bevezető kezelés neoadjuvant therapy általában daganatgyógyászati fogalom: valamelyik kiegészítő kezelés (gyógyszeres kezelés és/vagy sugárkezelés) adása az elsődleges kezelés előtt, pl. a daganat zsugorítására a szóródások mérséklésére stb.
első kezelés primary therapy, primary treatment, induction therapy, first-line therapy időben, sorrendben a legelső, pl. a műtét az első/elsőleges kezelés; a gyógyszert utána adjuk.
elsődleges (fő) kezelés first-line therapy, main therapy, primary
therapy/treatment, induction therapy (első
vonal kezelés, első vonalbeli kezelés)
elfogadottan a legjobb kezelés. Ha nem hatásos, vagy súlyos mellékhatásai
vannak, kiegészíthető vagy helyettesíthető mással. Utal időbeliségre is, a
fontosság hangsúlyozásával, pl. a vérzéscsillapítás az elsődleges teendő –
nemcsak a legfontosabb, de a legelső is.
kiegészítő kezelés adjuvant therapy az elsődleges kezeléshez hozzáadott kezelés, szokásosan az elsődleges kezelés után alkalmazzuk.
második kezelés időben, sorrendben az elsőt követi. Pl. a második kezelés a gyógyszeres; a műtéttel kezdünk.
másodlagos kezelés second-line
therapy (második vonal kezelés, második vonalbeli kezelés) az
elsődleges kezelés eredménytelensége (nem hatásos vagy nem elviselhető volta)
esetén alkalmazott kezelés.
támogató kezelés palliative therapy (palliatív kezelés) a
beteg életminőségét javító kezelés. Az ilyen kezelésnek nem a beteg
meggyógyítása a célja; legtöbbször azért, mert erre jóformán nincs esély.
kromoszómakészlet set of chromosomes egyetlen szülőtől örökölt 23 kromoszóma, n-nel jelöljük (n=23). Mondhatjuk esetleg egyszülős készletnek. A megtermékenyített petesejt és az utódsejtek (testi sejtek) mindegyike, élettani körülmények között, 46 kromoszómát, tehát két készletet (2n=46), egy anyait és egy apait tartalmaz. Kétkészletes sejtek (kétszülős készlet).
A nemzetközi irodalomban a kromoszómakészletek számának jelölésére a ploidy szakszót alkalmazzák. Az egykészletes a monoploid (uniploid), de leginkább haploidnak mondják. A kétkészletes sejtek a diploid sejtek, elterjedten euploid sejtek. Kóros sejtekben három vagy még több készlet is lehet (triploid, tetraploid, pentaploid stb.). Magyar szövegkörnyezetben ezek használata szükségtelen.
kromoszómák kiegészítő festési módszerei Kétfélét alkalmazunk.
▪ FISH (fluorescent in situ hybridization). A FISH vizsgálatot alakított kromoszómákon, sejteken, lenyomati vagy egyéb szöveti metszeteken is el lehet végezni, de visszérből, köldökvérből, amnionból vett mintákban (amnionvíz, chorionminta), nyiroksejteken és paraffinba ágyazott mintákból is.
A módszer rövid, fluoreszcensen jelölt DNS/RNS mintákat alkalmaz, amelyek bázispárosodnak a kromoszómán.
A minták előkészítése azok fajtájától függ. Pepszinnel emésztik a szövet fehérjéit. Ezután a kromoszómák és a minták szálait szétválasztják, és a mintát a fluoreszcens mintával hőn tárolják 12-24 órán keresztül. Ez idő alatt a minta a kiegészítő DNS szakasszal kereszteződik (amennyiben van olyan a kromoszómán). A sejtmagokat DAPI festékkel teszik láthatóvá, végül fluoreszcens mikroszkóp segítségével vizsgálják a folyamat eredményét.
A FISH jelentősége abban van, hogy nagyon gyorsan mutatja ki a kórismét megerősítő elváltozást, ami, például válságos állapotban lévő csecsemőnél nagyon fontos.
Használható:
- számbeli kromoszóma-eltérés kimutatására (például háromféle kromoszóma kimutatására fajlagos mintát alkalmazunk. Ha látható mind a három, igazolt a kromoszómahármas),
- mikrotörések (például valamely és a mellette lévő G-sávra fajlagos a DNS-minta; ha egyik nem festődik, a sáv hiányára utal),
- bonyolult áthelyeződések (olyanokra is, amelyek G-sávokkal nem azonosíthatók),
- de gének túlkifejeződésére is.
▪ m-FISH / multicolor FISH: lépései nagyjából megegyeznek a FISH-ével, csak egyszerre akár 24 különböző fluoreszcens DNS/RNS próbát alkalmazhatnak.
kromoszómapárok számbeli eltérései nem ritkák. Lehet a sejtben valamelyik kromoszómapárban kettőnél több vagy kevesebb tag. A kétfélét együtt a nemzetközi irodalomban aneuploidynek nevezik. Megtévesztő, mert a ploidy szakszó a kromoszómaszerelvényre utal. Egyszerűen kromoszómatöbbletnek, kromoszómahiánynak mondjuk, de pontosítunk:
▪ Például kromoszómahármas trisomy
(triszómia) egy többlet kromoszóma a szervezet néhány vagy az összes
sejtjében. Az adott kromoszómából nem pár, hanem három van. Ilyenek: a
Patau-kór, a 13-as hármasa, az Edward-kór, a 18-as hármasa, a Down-kór, a 21-es
hármasa, de hármas előfordul a nemi kromoszómákkal is: hármas X-betegség (47,
XXX), Klinefelter-kór (47, XXY).
▪ Kromoszómahiány monosomy (monoszómia) eggyel kevesebb kromoszóma a szervezet néhány vagy az
összes sejtjében. Az adott kromoszómából nem pár, hanem egy van. Ilyen a
Turner-kór, az egyik X kromoszóma hiánya.
Korábban elterjedt a
részleges
monoszómia (partial monosomy), illetőleg a
részleges triszómia
(partial trisomy) elnevezés; ez az elnevezéstípus téves, használata megszűnt.
kvantum quantum a fizikában →részecs
népegészségtan public health a nép (lakosság) egészségi állapotával, egészségének megóvásával és jobbításával foglalkozó tudomány. Vizsgálja az egészségre ható környezeti (természeti és társadalmi) hatásokat, az egészségügyi szolgáltatásokat a közösség egészségének javítása és védelme érdekében, a (fertőző és nem fertőző) betegségek és a rokkantság társadalmi előfordulását, azok okait, megelőzésének és elhárításának lehetőségeit az egészségtisztaság*, az oltások és a megelőző orvoslás eszközeivel.
betegségtan nem fertőző betegségek megelőzésével, okaival, elhárításával foglalkozó orvosi tudományág
járványtan a járványok megelőzésével, okaival, elhárításával foglalkozó orvosi tudományág. (→járvány)
népegészségtanász epidemiologist (epidemiológus) a népegészségtan szakembere.
népegészség-vizsgálás epidemiology adott népesség közegészségügyi kérdéseinek tanulmányozása, értékelése, elemzése az előforduló kóros egészségállapotok (betegség – fertőző és nem fertőző is –, rokkantság és más egészségre ártalmas események – mérgezések, természeti csapás, háború stb.) előfordulását, megoszlását, okait számmutatókkal* vizsgáló tudományág. Célja: a kóros egészségállapotok elkerülésére, elhárítására alkalmas módszerek kidolgozása, valamint ezek hatékonyságának ellenőrzése. A népegészségtan része.
népegészségügy a nép (lakosság) egészségének megóvásával és jobbításával foglalkozó társadalmi feladat, törvényes keretekben. A népegészségtanban megfogalmazott elveknek intézményesített társadalmi alkalmazása.
örökletes daganatokat vizsgáló sokgénes készletek* multigene hereditary cancer testing panels Gyárilag összeállított olyan készletek, amelyek számos, az öröklődő daganatokban szerepet játszó gén egyidejű vizsgálatát teszik lehetővé. Módszertanilag NGS alapúak. Például örökletes emlő- és petefészekrák esetén a BRCA1 és BRCA2 gén mellett további 23 gén, továbbá egy génszabályozó rész vizsgálatára alkalmas (→PALB2, CHEK2, BARD1, BRIP1, RAD51C, RAD51D, TP53, MRE11A, RAD50, NBN, FAM175A, ATM, STK11, MEN1, PTEN, CDH1, MUTYH, BLM, XRCC2, MLH1, MSH6, PMS2, MSH2, 3’ UTR of EPCAM).
örökletes petefészekrák hereditary ovarian cancer az a petefészekrák, amelynek létrejöttében rákképződésre hajlamosító csírasejtes génmásulás is részt vesz. Csaknem mindegyik HR-hiányos rák, vagyis olyan, amelyben a kétszálú DNS-törés rokonmás javítása nem megy végbe, genetikailag ingatag sejtekből áll.
A HR-hiányos petefészekrákokat két csoportra osztjuk: a BRCA gének másulásából eredők (BRCA1-másulás ~17%, BRCA2-másulás ~5%) és más rokonmás átrendeződési gén (RAD51C, RAD51D, BRIP1 stb.) másulásából keletkezők (3%) csoportjára.
Nagyritkán (~1%) keletkezik örökletes petefészekrák Lynch-kórban és más csirasejtes génhibák eseteiben. Ezek nem HR-hiányos rákok.
piRNS (Piwi fehérje-RNS) piwi-interacting RNA, piRNA egyszálú, 23–30 nukleotid hosszú RNS; a kis közbeavatkozó RNS-ek közül a legnagyobb; a piRNS géncsoportosulások (piRNA clusters) terméke. Ezeket a géneket az RNS-polimeráz-II írja át; hosszú folytonos egyszálú RNS (ssRNA; single strand) keletkezik. Ez kerül a sejtplazmába, ahol RNáz hasítja piRNS-sé, vagy a már meglévő piRNS-t tartalmazó RISC (piRISC) köti bázispárosodással, és hasítja annak megfelelően.
Mindkét folyamatban 5’-monofoszfát közbenső piRNS (5’ monophosphate piRNA intermediate) képződik, amelyik hosszabb az érett piRNS-nél, és kapcsolódik PIWI fehérjével; ez alakítja érett piRNS-sé (→RISC).
Három alcsaládja ismert: a rasiRNS, a crasiRNS és a tel-sRNS – tevékenységük csak részben ismert.
rasiRNS (repeat-associated small interfering RNAs, rasiRNA) a férfi ivarsejtekben szabályozza az ugrálatok (transposons) és a visszugrálatok (retrotransposons) sokaságát.
crasiRNS (centromere repeat associated small interfering RNA) középrész-RNS* a kromoszómák középrészének ismétleteiről íródnak át, tevékenységük alig ismert.
telsRNS (telomere-specific small RNA, tel-sRNA) végrész-RNS* a kromoszómák végeinek, a végrészismétleteknek az átíródásából keletkező kis RNS (végrészátíratok, telomeric transcripts). A tel-sRNS-eket az ébrényi (embryonal) őssejtekben fedezték fel. Szerepük kevéssé ismert, bizonyára a végrészek kromatinjának szervezésében vesznek részt.
Az emberben a piRNS csak piRISC formájában van jelen. A piRNS-ek működésének megismerése további vizsgálatokat igényel. Jellegzetes, hogy a heterokromatikus területeken vannak jelen, feltehetően a heterokromatkus részek alapvető szabályozói. (→RISC)
quantum →részecs ■ quantum field theory →részecselmélet ■ quantum mechanics →részecsfizika ■ quantum number →elektronrészecsszám ■ quantum physics →részecsfizika ■ quantum theory →részecselmélet
részecs* quantum a fizikában valamely fizikai sajátosság (például energia, töltés, forgómozgás) egyesleges mennyisége, a fizikai sajátosság létrehozója. Másként: a fizikai sajátosság legkisebb mérhető része; természetes egyesleges egysége/csomagja, például a fény (elektromágneses sugárzás) részecse, azaz egyesleges (elemi) mennyisége, a foton; a fény fotonokként (részecsekként) bocsátódik ki és nyelődik el.
A részecs értéke viszonyított szám, szokásosan valamilyen állandóhoz viszonyítunk, például a perdület lehet 0, ½, 1 stb., amely a Planck-állandóhoz viszonyított érték; az ½ perdület = a Planck-állandó felével.
részecses (kvantált) részecsekből álló.
részecskölcsönhatás a részecskéknek részecsekkel létrejövő kölcsönhatása.
részecselmélet quantum (field) theory a nevéből adódóan azt fejezi ki, hogy az energia parányi csomagokban, azaz részecsekben bocsátódik ki és vevődik fel. Vagyis az energiamozgás nem folytonos, hanem végtelen sok elemi energiaadagban adódik tovább, ezért a mennyisége is csak egészszám lehet, tört nem. Például a fény egysége (részecse) a foton, valamely fényhullám energiájának nagysága pedig ennek egészszámú többszöröse. Ez azt jelenti, hogy valamely fénysugár energiája egyesleg érték, kétféle fénysugárnak nem lehet azonos energiatartománya.
Korszerű formájában a részecskék viselkedését és kölcsönhatásait különböző erőmezőkben a részecsfizika és a viszonylagosság (relativity) elveinek együttesével magyarázó elmélet. Két formája a részecses elektrodinamika és a részecses elektromágnesesség.
részecsfizika quantum physics, quantum mechanics az anyagnak és az elektromágneses sugárzásnak (fény, röntgensugár és gamma-sugár) az atomok és a részecskék (elektronok, protonok, kvarkok stb.) szintjén való megértésével, törvényszerűségeivel foglalkozó tudomány. Magában foglalja az atomok, a részecskék és az elektromágneses sugárzás kölcsönhatásait.
Ebben számos olyan fizikai sajátossággal találkozunk, amely a hagyományos fizika szerint nem értelmezhető, sőt nem is elképzelhető (perdület [spin]) és még egymásnak ellentmondó is, de mérhető. Emberi tulajdonság, hogy az egymásnak ellentmondó dolgokat nem tekintjük valósnak, például valami vagy szögletes, vagy henger alakú, a kettő együtt nem lehet. A valóságban a részecskék szintjén mégis lehet, csak elképzelni nem tudjuk.
A részecsfizika alapja az atom bomlásának felfedezése volt, amikor kiderült, hogy az atom sem bonthatatlan, hanem részecskékből áll, ezeket a töltésükből adódó vonzás tartja össze. Majd a XIX. század elején folytatódott azzal a felismeréssel, hogy az anyag és az elektromágneses sugárzás részecske és hullám is lehet. Előtte az anyagot részecskékből állónak, a sugárzást pedig hullámnak vélték. A kettős természet mindkettőre igazolódott, tudósok sora (Thomas Young, Augustin-Jean Fresnel, Max Planck, Niels Bohr, Erwin Schrödinger stb.) bizonyította. A fizikának ez az ága korunk és a jövő tudománya, a természet részecsszinten való feltárása.
részecske subatomic particle az atom összetevője, például proton, neutron, elektron stb. Az atom részecskékből épül fel. A részecskék állandóan, nagy sebességgel és rendezetlenül mozognak, vonzzák és taszítják egymást, rugalmasan ütköznek egymással. Minden részecske egyben hullám is. A meghatározás szerint az atom már nem részecske, miként az ion és a molekula sem. A részecske tehát csak az atom valamelyik alkotóeleme.
A részecskék töltésükkel és tömegükkel jellemezhetők, többségük még a perdülettel (spin) is. A részecskék tömegét, miként az atomokét, viszonyított tömegként adjuk meg. Például a neutron és a proton tömege nagyjából azonos, és 1-nek felel meg; azaz nagyjából azonos az atomi tömegegységgel. (→atomi tömegegység, atomtömeg)
A részecskéket két csoportra oszthatjuk: a tovább bontható részecskékre (composite particle), például proton, neutron, mezon, és azokra, amelyek már nem bonthatók (kvark, elektron, müon, neutrino, tau, tau neutrino, foton, gluon, mezon, pion, Higgs-bozon, W-bozon, Z-bozon, graviton). Az utóbbiak az elemi részecskék (elementary particles).
ellenrészecske antiparticle olyan részecske, amely az atom valamely részecskéjével teljesen egyező, csak a töltése ellentétes. Például a pozitron az elektron ellenrészecskéje; az elektronnal tökéletesen azonos, csak a töltése más.
részecskesugárzás (→atommagsugárzás)
részleges negativitás/pozitivitás/töltésállapot (→elektronegativitás)
scavenger receptors →enyésztésjelfogók*
subtelomeric repeat elements →végrész alatti szakasz
társadalom szervezett emberközösség
társadalombiztosítás a keresőképtelenekről (gyermek, beteg, idős) való gondoskodás (egészségbiztosítás, nyugdíjbiztosítás stb.).
társadalomlélektan (→lélektan)
társasnyelvészet (szociolingvisztika) a társadalmi rendszer és a nyelvészet összefüggéseit kutató
nyelvtudományi ág. (→nyelvészet)
társadalomtudomány, társadalomkutatás social sciences a szervezett emberközösség rendszerével, az ebben élőkkel foglalkozó tudomány.
telomer →végrész
telomere position effect →végrészhatás
telomere repetitive nucleotide sequences →végrészismétlet
természetes állapot* native state a nagymolekulának (fehérje, nukleinsav stb.) megfelelően hajtékolt és összeszerkesztett formája – ebben működik szabályosan. Magában foglalja az elektronkötésekkel létrehozott vázat és a gyenge kötésekkel kialakított másodlagos, harmadlagos és negyedleges szerkezetet. Ellentéte a szétalakult állapot* (denaturated state), amelyben a másodlagos kötések felbomlanak, többé-kevésbé a molekulának az elsődleges szerkezete marad meg. (→szétalakulás)
TERRA (végrészismétleteket tartalmazó RNS*, telomeric repeat-containing RNA) törzsökös RNS, meghatározó szerepe van a végrész hosszának és kromatinjának szabályozásában, valamint a végrész kettőződésében. A végrész kódolja. Változóan, 100 bázistól 9 kb-ig terjedő hosszúságú és UUAGGG ismétletek tartalmazó RNS. Tehát guaninban gazdag RNS, amely – hasonlóan a végrész túlnyúlásához – gyakran képez önmagában is G-négyeseket, de elősegítik az R-hurkok keletkezését is.
A TERRA:
▪ Sajátosan kötődik a végrészhez: a túlnyúlás G-négyesei és a TERRA G-négyesei alakítanak ki molekulaközi kapcsolódást, DNS–RNS felemás G-négyes* képződmények (DNA RNA hybrid GQ, HGQ) jönnek létre, kivált a túlnyúlás 3’-végén. Ezek a felemás G-négyesek a 3’-végen akadályozzák a túlnyúláshoz való hozzáférést, a telomerázok és más fehérjék kötődését.
A túlnyúláshoz kötődve R-hurkok keletkezhetnek, amelyek háromszálas felemás DNS–RNS szerkezetek.
▪ Képződése összefügg a sejtkörrel (keletkezik a G1- és G2-szakaszban, az S-szakaszban viszont nem) és a kromoszómák állapotával. Ha a végrész rövidül, vagy nem működik megfelelően, a TERRA tevékenysége fokozódik. A végrész túlrövidülésekor vagy a DNS károsodásakor jelzéseket is küld, toboroz kromatinmódosítókat (LSD1 [lizin-demetiláz-1], SUV39H1 [hiszton-3-lizin-9-metiláz]).
▪ Tevékenyen részt vesz a végrészek védelmében, működésében. Szabályozza a végrész hosszát a telomerázok, az exonukleáz-1 féken tartásával, az ALT (alternative lengthening of telomeres) sejtekben pedig az átrendeződés elősegítésével. Óvja a védletet is; kötődnek a POT1–TPP1 kettőshöz.
Az ez idáig nem kódolónak tartott végrész-RNS-ről kiderült, hogy átíródik, a polimeráz-II írja át, valin–arginin vagy glicin–leucin ismétleteket tartalmazó fehérjék keletkeznek RAN átfordítódással. (→RAN átfordítódás) Az olvasókerete kezdő bázishármas (ATG) nélkül fordítódik át. Ezek a fehérjék hatással vannak a sejtek működésére, valószínűleg károsak, de a részletek tisztázatlanok.
törékeny X-társult előmásulásos állapot* fragile X-associated premutation condition Az előmásulásos FMR1 gén által okozott betegségek közös elnevezése.
Előmásulásosnak nevezzük az olyan ismétletbővülésű FMR1gént, amelyben 55–200 ismétlet van. Minél több az ismétlet, annál kevesebb FMR1 fehérje képződik, és annál gyakoribbak, kifejezettebbek a tünetek.
Háromféle betegség tartozik közéjük:
törékeny-X-társult elmezavarodottság fragile X-associated neuropsychiatric disorder, FXAND viszonylag újonnan (2018-ban) elfogadott különálló előmásulásos betegség; tüneteit korábban a törékeny X-kromoszómával összefüggő egyéb betegségek részének vélték.
A feszültállapot (anxiety) és búskomorság (depression) a leggyakoribb megnyilvánulása. Fejlődési zavarok, mint ASD (autism spectrum disorder) és ADHD (figyelemhiányos túltevékenység, attention deficit hyperactivity disorder) – hasonlóan a törékeny-X-betegséghez – ezekben az érintett gyermekekben is előfordulnak, de jóval ritkábban és sokkal enyhébb formában; felnőtt korra többé-kevésbé megszűnnek. Értelemcsökkenés nem jellemző, legfeljebb nagyon enyhe; arányos az ismétletek számával: a >100 ismétletbővülés és csökkenő FMR1 fehérje képződés eseteiben jelentősebb.
törékeny X-társult korai petefészek-elégtelenség fragile X-associated premature ovarian insufficiency, FXPOI a petefészkek 40 éves kor előtti kimerülése. Vérzészavarok, fogamzásnehézségek és a korai változókor jellemzi. Legtöbbször az FMR1 gén előmásulásos ismétletválzata okozza a fokozott mRNS képződés miatt (mRNS-mérgezés). Ezekben az mRNS-ekben ugyanis bennük van a kóros ismétletbővülés. (→FMR1-betegségek)
Az előmásulásos ismétletválzatot hordozó nők 20%-ában alakul ki korai petefészek-elégtelenség. A törékeny-X-jellegek (idegrendszeri és testi fejlődési rendellenességek) rendszerint nincsenek jelen. A vérzés elmaradása az átlagosnál ~5 évvel korábban bekövetkezik, legkorábban a 80–90 ismétletszámú válzatot hordozókban; valószínűleg azért, mert náluk képződik a legtöbb mRNS.
törékeny X-társult remegéses mozgászavar fragile X-associated tremor/ataxia syndrome, FXTAS idősebb kori kezdetű, súlyosbodó mozgászavar (rendezetlen, terpeszkedő járás) és célirányos mozgásra jelentkező, nagy kitérésű remegés jellemzi. Társulhat viselkedési, emlékezési zavarokkal, szellemi leépüléssel és sok más idegrendszeri tünettel, izomzavarokkal, kimerüléssel stb. Képalkotókon a kisagyi fehérállományban láthatók eltérések. Szövettani jellegzetessége az idegsejtek és a csillagsejtek (astrocytes) magjában lévő zárványok.
Az előmásulásos FMR1 génről másolódó kóros ismétletbővületet tartalmazó mRNS-ek sokasága okozza. Megváltozik az átfordítódás: nem AUG kezdetűvé válik (repeat associated non AUG translation), aminek következtében sokglicines végződésű FMR1 fehérje, FMRpolyG keletkezik. Ezek ártalmasak, és az idegsejtek, csillagsejtek pusztulását okozzák. (→FMR1-betegségek)
végrész alatti szakasz subtelomeric repeats; telomere-associated sequences, TASs a végrész és a kromoszóma sajátos bázissora közötti átmenet. Ismétleteket tartalmazó, változó hosszúságú bázissor; legfeljebb néhány száz bázispár (10–500 kb) nagyságú. Hajlamos átrendeződésre, ezért egyének közt is nagyon különbözik.
A végrész alatti ismétletek neve: subtelomeric repeat elements (SRE). Pontosan nem ismertek, számos kromoszómában hasonlók. A végrész felőli ~200 bázissora CpG-ben (5'–C-phosphate-G–3') gazdag, CpG-szigeteket tartalmaz, amelyek a testi sejtekben, az ébrényi fejlődés korai szakaszában metileződnek, egyféle DNS-metil-transzferáz, a DNMT3B (de novo DNA methyltransferase) kapcsolja a metilcsoportot rájuk. A CpG-szigetek száma a kromoszóma felőli szakaszban mind kevesebb. Ellentétben a testi sejtekkel, az ondósejtekben nem metilezettek ezek a CpG-szigetek. Hasonlóan a ráksejtek zömében sem, ami felveti szerepüket a rákos átalakulásban.
A végrész alatti szakaszban van a végrész-RNS indítója, amely háromféle, 61, 29 és 37 bázispár hosszú ismétletekből áll. Ezek, kivált a 29 bázisú ismételetek nagyon gazdagok CpG-ben. Az indító metilezettsége szabályozza a végrész-RNS képződését. Ha kevéssé metilezett, mint pl. az ALT-sejtekben, fokozódik a végrész-RNS keletkezése. Az indító metilezettsége befolyásolja a végrészek állapotát, kóros metilezettség betegséghez vezethet, pl. immunhiányhoz.
A végrész alatti szakaszból indul a végrész kettőződése is.
végrészátíródás viszonylag új és meglepő felismerés, hogy a végrész átíródik, hiszen a tömör kromatinba burkolt ismétleteketből álló DNS-részek általában némák, nem íródnak át. Sőt, a végrész kromatin a közelében (a végrész alatti szakaszban) lévő géneket is némítja.
Az átírást az RNS polimeráz-II végzi; indítója a végrész alatti szakaszban van – az átírás innen kezdődik, és halad a kromoszóma végéig. Az átíródásból hosszú RNS, a végrész-RNS (TERRA) keletkezik. Nem mindegyik kromoszóma végrésze íródik át. (→végrész-RNS)
végrész-DNS (→végrész)
végrész-fehérjék →végrész
végrészhatás* telomere position effect az a jelenség, hogy a végrész tömörödött kromatinja távolhatású, a végrész alatti szakaszban is fékezi az átíródást.
végrészismétletek* telomere repetitive nucleotide sequences a kromoszómák végrészeinek zömét alkotó TTAGGG ismétletek. Az ismétletek száma nemcsak az emberek közt eltérő, de az egyénben is változik: a korosodással csökken.
végrészkettőződés a végrész kétszálú DNS-ében a szokványosan zajlik. Nehézséget a túlnyúlás másolása okoz. Ezt a jelenséget a nemzetközi irodalom end-replication problemnek nevezi (végmásolási nehézség*).
A másolás a végrész alatti szakaszból indul, a kettőződési villa a vége felé halad. A guanin ismétletekből alakuló másodlagos szerkezetek (G-négyes, R-hurok) és hibák (8oxoG) állják útját a villának. Ezeket különböző, a védlettel, DNS-sel, RNS-sel kölcsönhatásba lépő fehérjék átmenetileg eltávolítják.
Pl. a G-négyeseket a BLM és a RTEL1 fehérje (helikáz) felbontja, a DNS eredeti formájúvá válik. Ha nem tekerednek ki, zavarhatják a DNS másolódását, a kettőződési villa bizonytalanná válhat, avagy átugorja a G-négyest, és DNS-törések keletkezhetnek; ezek a következő osztódásokkor a kromoszómák szerkezeti változásához vezethetnek. Az R-hurkokat többnyire a végrész-RNS-hez kötődő fehérjék igazítják ki, mint az RNáz-H enzim, amely kapcsolódik hozzá és lebontja, vagy a NONO és az SPFQ fehérjék, amelyek gátolják, de számos más megoldás is előfordul. A bázishibák, mint az 8-oxoG-k, kivágódnak. A T-hurok felszakításában az RTEL1 fehérjének van döntő szerepe.
Az kettőződési nehézségek helyén a DNS törékennyé válhat, parányi rések keletkezhetnek, amelyek hasonlók a metafázis kromoszómák DAPI-negatív réseihez (common fragile site, CFS, magyarul: szokásos törékeny helyek*).
Ha a kettőződési villa összeesik, túlnyúló végződésű kétszálas DNS-törés keletkezik, amely nem javítható ki sem a végegyesítéssel, sem a rokonmás átrendezéssel, mivel ezek a kettős törtvéget ismerik fel. A bázisok egy része nem íródik át, ezek elvesznek, a végrész gyorsan rövidül. Javítás legfeljebb a törési kettőződéssel mehet végbe.
végrész-RNS*, TERRA telomeric repeat-containing RNA, TERRA változóan, 100 bázistól 9 kb-ig terjedő hosszúságú és UUAGGG ismétletek tartalmazó RNS. Tehát guaninban gazdag RNS, amely – hasonlóan a végrész túlnyúlásához – gyakran képez G-négyeseket, de elősegítik az R-hurkok képződését is.
A végrész-RNS-ek:
▪ Sajátosan kötődnek a végrészhez: a túlnyúlás G-négyesei és a végrész-RNS G-négyesei alakítanak ki molekulaközi kapcsolódást, DNS–RNS felemás G-négyes* képződmények (DNA RNA hybrid GQ, HGQ) keletkeznek, kivált a túlnyúlás 3’-végén. Ezek a felemás G-négyesek a 3’-végen akadályozzák a túlnyúláshoz való hozzáférést, a telomerázok és más fehérjék kötődését.
A túlnyúláshoz kötődve R-hurkok keletkezhetnek, amelyek háromszálas felemás DNS–RNS szerkezetek.
▪ Képződése összefügg a sejtkörrel (kifejeződnek a G1- és G2-szakaszban, az S-szakaszban viszont nem keletkeznek) és a kromoszómák állapotával. Ha a végrész rövidül, vagy nem működik megfelelően, tevékenységük fokozódik. A végrész túlrövidülésekor vagy a DNS károsodásakor jelzéseket is küldenek, felgyülemlenek, toboroznak kromatinmódosítókat (LSD1 [lizin-demetiláz-1], SUV39H1 [hiszton-3-lizin-9-metiláz]).
▪ Tevékenyen részt vesznek a végrészek védelmében, működésében. Szabályozzák a végrész hosszát a telomerázok, az exonukleáz-1 féken tartásával, az ALT (alternative lengthening of telomeres) sejtekben pedig az átrendeződés elősegítésével. Óvják a védletet is; kötődnek a POT1–TPP1 kettőshöz.
Az ez idáig nem kódolónak tartott végrész-RNS-ről kiderült, hogy átíródik, az RNS polimeráz-II írja át, valin–arginin vagy glicin–leucin ismétleteket tartalmazó fehérjék keletkeznek RAN átfordítódással. (→RAN átfordítódás) Az olvasókerete kezdő bázishármas (ATG) nélkül fordítódik át. Ezek a fehérjék hatással vannak a sejtek működésére, valószínűleg károsak, de a részletek tisztázatlanok.
végrészrövidülés a végrészek minden sejtosztódással 50–200 bázispárral rövidülnek, amíg el nem érik a határrövidülést* (Hayflick limit), amikor már nincs további osztódás, bekövetkezik a sejtöregedés. Ezért a végrészrövidülést osztódási órának is nevezik. Ha a rövidülés túllépi a határrövidülést, nem tudja elhárítani a DNS-hibajavító rendszert, a sejt elpusztul.
A DNS kettőződésekor a végrész azért rövidül, mert a 3’-véghez kötődő idtRNS-nek megfelelő DNS-bázisok nem másolódnak, adódóan a DNS-másolódás formájából. (→DNS-kettőződés)
A végrészek rövidülését a telomerázok egyenlítik ki, a TTAGGG ismétletek hozzáadásával. A sejtek telomeráz tartalma azonban a születés után fokozatosan csökken; felnőttkorban, a legtöbb sejtben már nincs vagy csak nagyon kevés telomeráz van, ezért rövidülnek a végrészek. Ebből következik, hogy a végrészek rövidülése összefügg a korral is, a korosodással mind kifejezettebb. A csírasejtekben és az őssejtekben bőven van telomeráz, ezért maradandók.
A ráksejtek ellenőrizetlen osztódásukat, halhatatlanságukat éppen azzal érik el, hogy bennük, ha kisebb mennyiségben is, de jelen van a telomeráz; így gátolják a végrészek rövidülését. A daganatok ~90%-ában van a sejtekben telomeráz. Ezt különböző folyamatokkal érik el, mint az indító, a közteskivágás és az állapotszabályozás módosításával (indító metilezése, miRNS), valamint a végrészhatás módosításával. A fentiekből következik, hogy a telomerázok gátlása (keletkezésük vagy kötődésük/tevékenységük akadályozása) a rákelleni kezelés egyik lehetséges formája.
Sejtártámány, pl. vegyülő oxigénelemek, ionizáló sugárzás, fokozza a végrész rövidülést, gátolva a rákburjánzást; pusztítja a ráksejteket.
Bizonyos sejtek a végrészek rövidülését – a telomerázok helyett – átrendeződéssel gátolják. Ezeket a sejteket ALT (alternative lengthening of telomeres) sejteknek nevezzük. Bennük sok végrész-RNS képződik. Ezek kötődnek a túlnyúlás 3’-végén lévő felemás G-négyesekhez, valamint kialakítanak R-hurkokat, elősegítve a végrészek átrendeződéses hosszabbítását.