ABL fehérje ABL protein
törzsökös nem jelfogó tirozin-kináz (TK). Sokféle van; fehérjecsaládot
alkot. Mindegyikben megtalálható az SH3–SH2–TK gomolyhármas (az N-végen lévő
SH3 gátolja a tevékenységét), valamint aktinkötő hely, lehetővé téve az aktinszálakhoz
való kapcsolódást. Két formája a gerincesekben az ABL1 és ABL2.
▪ Az ABL1-ben DNS-kötő gomoly is van, kötődik a
DNS-hez, szerepe van a DNS-hibák kijavításában, továbbá szabályozza a CBL
fehérjét (ubikvitin-ligázt). Az ABL1-et az ABL1 gén kódolja, amely a 9-es
kromoszóma hosszú karján van. Az ABL1 gént az Abelson murine lymphosarcoma
virusban fedezték fel, innen (Abelson) kapta a nevét.
▪ Az ABL2 főleg az aktinhoz és a sejtcsövezethez kapcsolódik
(az alapformához képest több aktinkötő gomolya is van), a sejtváz alakításában
és a sejtmozgásban (WASF3 fehérje foszforilezése) van meghatározó szerepe. Az
ABL2 gén kódolja; ez a gén az 1. kromoszómán található.
Az
ABL fehérjék számos egyéb sejtfolyamatban is részt vesznek foszforilezéssel;
így a sejtek kapcsolódásában, a bekebelezésben (ANXA1 fehérje foszforilezése),
önfalásban, számos jelközvetítésben (DBN1, DBNL, CTTN, RAPH1 és az ENAH fehérje
foszforilezése) stb.
ACTL6A fehérje (actin-like protein 6A) (egyéb nevei: BAF53A, actin-related protein BAF53a, 53 kDa
BRG1-associated factor A, BRG1-associated factor 53A, ArpNβ, INO80 complex
subunit K), aktinszerű fehérje (actin-related protein). Az SWI–SNF össztes egyik alegysége, előmozdítja az
össztes kapcsolódását a magállománnyal és a kromatinnal, serkenti a BRG1
kromatinmódosító tevékenységét. Részt vesz a hólyagcsás szállításban, az
osztódási orsó irányításában, magmozgásokban és az SWI–SNF össztes tagjaként a
kromatin módosításában. Sajátos – mint mindegyik aktinszerű fehérjében – az
ATP-t kötő és bontó szerkezeti hajtéka (structural fold). Az ACTL6 (egyéb
nevei: BAF53, BAF53A, INO80) gén kódolja. A gén a 3-as kromoszómában van.
Hibája változó súlyosságú szellemi zavarokkal és testtorzulásokkal jár.
ACTL6B fehérje (actin-like protein 6B) (egyéb nevei: BAF53B, actin-related protein BAF53b, 53
kDa BRG1-associated factor B, BRG1-associated factor 53B, ArpNα) az
ACTL6A-hoz mindenben hasonló fehérje. Az ACTL6B (egyéb nevei: BAF53B, ACTL6)
gén kódolja. A gén a 7-es kromoszómában van. Hibája Developmental and epileptic
encephalopathy 76 kialakulásához vezet.
BAF45A/B, más néven DPF1 (Double PHD Fingers 1) vagy cinkujj fehérje neuro-d4 az
idegszöveti SWI–SNF össztes tagja, neuronfajlagos átírásfehérje. Fontos szerepe
van a neuron kialakulásában és az idegsejtek túlélésében.
BAF45C, más néven DPF3 vagy cinkujj fehérje DPF3. Sajátosan a
hiszton-3 és hiszton-4 (H3 és H4) acetilezett lizinjeihez (H3K14ac, H3K9ac,
H4K5ac, H4K8ac, H4K12ac, and H4K16ac) kötődik; így kapcsolja a hisztonhoz az
SWI–SNF össztest. A szív- és a vázizmok fejlődésében jelentős.
BAF45D, más néven DPF2 vagy cinkujj fehérje ubi-d4.
Ösztrogénjelfogó-sajátos módosító, a sejttúlélési tényezők károsodására
bekövetkező sejthalál átírásfehérjéjét kapcsolja. Szabályozza a vérképzősejtek
burjánzását.
BAF47 más néven SMARCb1, INI1, SNR1, SNF5, SFH1 azonos
a gombák SNF5 fehérjéjével. Elősegíti az SWI–SNF össztes ATPázának
kapcsolódását a magtestecskei DNS-hez. (→SMARC/SMARCb1, SWI–SNF össztes)
BAF53 azonos az
ACTL6 fehérjével. Két azonmása a BAF53A és BAF53B. (→ACTL6A, ACTL6B)
BAF57, más néven BAP111 vagy SMARCe1. Az ösztrogénjelfogóval
kapcsolt átíródást szabályozza.
BAF60 (Bap60, SWP73, RSC6). Háromféle: BAF60A, BAF60B és
BAF60C ismert. Mindegyik az átírásfehérjét társítja az SWI–SNF össztessel.
BAF60A (SMARCd1, egyéb nevei: 60 kDa BRG-1/Brm-associated
factor subunit A, SWI/SNF complex 60 kDa subunit) főleg a máj, agy és a
zsírsejtekben képződik, a glükokortikoid-jelfogóval kölcsönhatásban van.
Meghatározó az előidegsejtek fejlődésében.
BAF60B (SMARCd2, 60 kDa BRG-1/Brm-associated factor subunit B)
elsősorban az immunsejtekben található; meghatározó a fehérvérsejtek
keletkezésében és tevékenységében.
BAF60C (SMARCd3, 60 kDa BRG1/BRM-associated factor subunit C)
kivált az izomsejtekben, agysejtekben és a szívsejtekben keletkezik;
meghatározó a szív és a szemideghártya keletkezésében és az izomsejtek
anyagcseréjében.
BAF155,
más néven SMARCc1 azonos a gombák
SWI3 fehérjéjével. (→SMARC, SWI–SNF össztes)
BAF180 (→hPB1)
BAF200 (→ARID2)
BAF250,
szokványos néven ARID1A. Megkülönböztetnek BAF250A és BAF250B fehérjét; az
előbbi az ARID1A, az utóbbi az ARID1B fehérjével azonos. (→ARID1A fehérje)
A BAF fehérjéknek többféle nevük is van. Sokat
használnak is a nemzetközi irodalomban. Az UniProt (Universal Protein Resource)
általában a SMARC elnevezések alkalmazását javasolja. Például SMARCc1 (SWI/SNF related, matrix associated,
actin dependent regulator of chromatin subfamily c member 1). (→SMARC) Egyes BAF fehérjéknek egyedi neve van, például ARID1A,
hPB1.
állványfehérje
scaffold protein a
jelutak alapvető fehérjéje. Ellentétben a kapcsoló fehérjével, amely egy,
legfeljebb két fehérjét hozz össze egy harmadikkal, az állványfehérje többet.
Általában sok gomolyt
tartalmaznak és sokban van rendezetlen szerkezeti rész – mindkettő szükséges a
többes feladatukhoz. A gomolyok kicsik (~80 aminosav) és hosszabb (~150
aminosav) rendezetlen hurkokkal kapcsolódnak; ez teszi lehetővé különleges
kötőképességüket: sokféle fehérjével és más molekulával (DNS, RNS, sejtelemek)
képesek kapcsolódni. Tevékenységük sokféle:
• Létrehoznak tevékeny
molekulaösszteseket, és többé-kevésbé egyidejű kölcsönhatásokkal szabályozzák
is azok működését.
• Kapcsolnak a jelközvetítésben
részt vevő fehérjéket, mintegy állványzatot formálnak nekik, lehetővé téve,
hogy létrejöjjön a kapcsolat közöttük. Például a MEK-fehérje összetartja a
RAS–GTP–RAF együttest, és hozzájuk köti a MAPK-molekulát. A kapcsolat térbeli,
időbeli változtatásával szabályozzák is a jelközvetítést. Előfordul az is, hogy
az állványfehérjéhez való kapcsolódás következményeként az enzim térszerkezete
megváltozik, és hatékonnyá válik – foszforilezi az állványfehérjéhez kötött
többi fehérjét, avagy gátlódik.
• A sejt valamelyik részéhez
(sejthártya, sejtszervecske, DNS stb.) horgonyoznak több molekulát (kinázokat,
foszfatázokat stb.), aminek következtében a célhelyen jöhet létre a kapcsolat a
közvetítő molekulák között (foszforilezés, defoszforilezés stb.). Ezzel
megakadályoznak káros kapcsolódásokat. Például: az AKAP (A-kinase anchor
protein) kapcsolja a PKA-t (fehérje-kináz-A) és a célfehérjé(ke)t); elszállítja
ezt az együttest a sejtmagba, ahol a PKA foszforilezi a célfehérjét – az
enzimhatás a végrehajtás helyén következik be. Egyúttal biztosítják, hogy a
szállítás közben a célfehérje nem kapcsolódik szükségtelenül, mivel még tétlen
állapotban van.
• Irányítják a jelközvetítést a
pozitív és a negatív visszajelzések továbbításával. Ezt a jelközvetítők
megkötésével érik el: a jel csak a kapcsolt molekulák közt adódik át; a
sejtplazmában lévő ugyanolyan molekulák között nem. Ilyen például a háromkináz-jelközvetítés:
az állványfehérje kapcsolja mindegyiket, ekként érintkezhetnek egymással.
• Különböző jelpályák
molekuláinak kapcsolásával összekötnek jelközvetítéseket.
• Elzárnak fehérjéket a lebontás
elől. A jelközvetítés visszafordítható és, ha megszakad, a tevékennyé vált
közvetítő fehérjék defoszforileződnek vagy lebontódnak. Ezt akadályozza meg a
fehérje megkötésével: elzárja a fehérjét a foszfatázok, illetőleg a hasító
enzimek elől. Az is megeshet, hogy a foszfatáz túl gyorsan defoszforilez, még
azelőtt, hogy az enzim elérné a célfehérjéjét. A kapcsolódás az
állványfehérjéhez, ennek is elejét veszi.
átírásfehérje* transcription factor (TF) a DNS-hez vagy
RNS-hez kötődő, azok működését szabályozó fehérje.
■ A DNS-hez kapcsolódó átírásfehérje a gének átíródását
irányítja (ki-bekapcsolás, fokozás, gátlás): kapcsolja a polimerázt a DNS-hez,
és kölcsönhatásban áll a szabályozó fehérjékkel. Leginkább az indítóhoz és egy
szabályozó DNS-szakaszhoz, pl. az fokozóhoz fűződik. Egyféle átírásfehérje
több, rendre azonos feladatot ellátó génhez is kapcsolódhat.
Jellegzetessége, hogy legalább egy
sarkalló- (DNA activation domain) és egy DNS-kötő gomolya (DNA-binding domain,
DBD) van. Az utóbbi fajlagosan fűződik a DNS (a szabályozandó gén) 8–20
bázisnyi törzsökös mintázatához (sequence-specific DNA-binding factor), amely
az indítómagban van. A sarkallógomolyok szerkezete viszont egyszerű, ezért
ezeket az aminosavak elosztása szerint jellemzik, megkülönböztetve prolin-,
szerin/treonin, glutamingazdag stb. gomolyokat.
Az átírásfehérjék biztosítják, hogy a
gének átíródása a megfelelő sejtben, időben és mértékben menjen végbe.
Nagyjából 2600-féle ismert; csoportosításuk a DNS-kapcsolódási gomolyuk
szerinti, pl. cinkujj mintázati átírásfehérje. (→gomolyok) Az emberi DNS-ben
~2000 átírásfehérje által irányított gén van. Az átírásfehérjék zöme csak a
célgénhez kapcsolódhat: az indítóhoz általános, a szabályozó
bázissorokhoz sajátos átírásfehérjék társulnak. Azonban van olyan is, amely
képes a magtestecskén lévő DNS-hez kötődni (úttörő átírásfehérje*).
általános átírásfehérje* general transcription factor, GTF (más néven:
alapvető átírásfehérje, basal transcription factor) az indítómag fajlagos
mintázatához kötődő, a polimerázt toborzó és az RNS képzést a megfelelő helyen
indító átírásfehérje. Pl. az RNS-polimeráz-2 általános átírásfehérjéi a TFIIa,
TFIIb, TFIId, TFIIe, TFIIf és a TFIIh.
úttörő átírásfehérje* pioneer factor a magtestecskén lévő
DNS-sel kapcsolódó átírásfehérje. Ezeknek a fehérjéknek sajátos adottsága, hogy
a néma, kromatinba ágyazott génekkel képesek kapcsolódni, és azokat beindítani,
szerkezeti változásokat kiváltva a kromatinban. A törzsfejlődésben, a sejtek
átalakításában van szerepük.
■ Az RNS-hez kapcsolódó átírásfehérje sajátsága az
RNS-kötő gomoly.
Az
átírásfehérjét szokásosan TF-fel jelöljük, ezután római számmal az általa
kapcsolt polimeráz fajtáját írjuk. Például: TFII (a polimeráz-II-t kötő
átírásfehérje [RNAP2; RNA polimerase 2]), TFIII (a polimeráz-III-at kötő
átírásfehérje [RNAP3]). Ezek változatait tartozékbetűkkel azonosítjuk (TFIIb, TFIId, TFIIe, TFIIf,
TFIIh, TFIIIa).
BCR-ABL fehérje (BCR-ABL1) BCR-ABL protein a BCR-ABL egyesült gén által képzett
tirozin-kináz: serkenti a sejtosztódást, és gátolja a sejtvégzetet. A BCR-ABL
egyesült gén (BCR-ABL fusion gene) a Philadelphia-kromoszómán van.
(→Philadelphia-kromoszóma). Kóros fehérje, fehérvérűséget okoz.
A szabályos vérsejtképzés a tevősített citokin
jelfogóhoz (IL3 vagy GMCSF) kapcsolódó JAK2 tirozin-kinázon keresztül zajlik. A
JAK2 a STAT5 átírásfehérje SH2 gomolya melletti tirozint foszforilezi, amely a
cél gén indítójához kapcsolódik. A BCL-ABL fehérje közvetlenül foszforilezi a
STAT5-t, a citokin jelfogó–JAK2 szabályozás elmarad, mert az ABL1 fehérje SH3
negatív szabályozója nem kerül a BCR-ABL fehérjébe. Ennek következtében a gén
állandóan tevékeny (a STAT5 folyamatosan kötődik hozzá), a sejt folyvást
osztódik.
A kromoszóma részek átcserélődésének töréspontjai
szerint többféle BCR-ABL gén keletkezhet, a két leggyakoribb hasonmás a p210
(210 kDa) és a p190 (190 kDa). Ezek szerkezetükben, tevékenységükben is
eltérnek, más fehérvérűséget okoznak. A p210 az idült nem nyiroksejtes
fehérvérűség (CNL) jellemzője.
Az ABL fehérjék sajátos gomolyai (SH3–SH2–TK, aktinkötő
gomoly) mellett DH (Dbl-homology) és PH (Pleckstrin-homology) gomolya is van. A
p190-ben ezek nincsenek. A p190 fehérjének a heveny fehérvérűségekben van
kóroki szerepe. Mindkettő gátolható gyógyszerekkel. (→ABL fehérje)
BCR fehérje breakpoint cluster
region protein, BCR, más néven: renal
carcinoma antigen NY-REN-26szerin-tirozin-kináz; a BCR gén kódolja.
A BCR gén a 9-es kromoszóma hosszú karján van (9q34); egyike a BCR-ABL1 felemás
génnek, amely a Philadrlphia-kromoszómán van. Tevékenysége részben ismert; a
GTPázokrho-családjának (rhoA) guanin-nukleotid cserélő tényezője.
BICRA fehérje (
BRD4
interacting
chromatin
remodeling complex
associated protein) (Egyéb nevei: CSS12; GLTSCR1; SMARCK1) a gBAF össztes
sajátos alegysége, amelyben hasonmásával BICRAl (BRD4 interacting chromatin
remodeling complex associated protein like; egyéb nevei: BICRA like chromatin
remodeling complex associated protein, GLTSCR1L, SMARCK2, KIAA0240) vagylagosan
fordul elő. A gBAF össztes alegységeként a kromatin módosításában vesz részt,
pontos szerepe nem ismert; kölcsönhat az össztes SS18 alegységével. A BICRA,
más néven GLTSCR1 (Glioma tumor suppressor candidate region gene1) gén kódolja,
amely a 19-es kromoszómában van. Hibájával függ össze a Coffin–Siris
tünetcsoport-12 (CSS12).
cserélőfehérje exchange factor valamilyen
vegyületcsoport leválasztásában és kicserélődésében vesznek részt. Legtöbbjük
foszfátcsoportot hasit le az ATP-ről vagy a GTP-ről. A jelvitelben részt vevő
gyakoribb cserélő fehérjék a →GAB, →GEF, →SOS.
dajkafehérje chaperon fehérjéket óvó fehérje. Ezek részben
hősokkfehérjéknek tekinthetők: ártmány hatására felszaporodnak, jóllehet
élettani körülmények között is fontos feladatokat látnak el. A nagymolekulák
működését segítik: a fehérjék feltekeredését, széttekeredését, valamint a
fehérjék társulását egységekké, illetőleg azok szétválást vigyázzák. Nem
módosítják a fehérjék gombolyodását, csak elősegítik.
Néha enzimként viselkednek (foldases): ATP
felhasználásával sarkallják a gombolyodást. Máskor csupán kötődnek a
fehérjéhez, amíg kialakul a teljes gömbszerkezete; ezzel védik meg attól, hogy
a még nem rögzült formájában kapcsolódjon más fehérjékkel, fehérjehalmazok
keletkezzenek.
DNS-hibaválasz
fehérje* DNA damage protein a DNS-hibát felismerő, a
javítást elindító fehérje.
egyesülésfehérje* fusion protein
olyan fehérje, amelyet két vagy több
egyesült gén kódol. Ezek a gének eredetileg külön fehérjéket képeztek. Az
egyesülésfehérjék tulajdonságai eltérnek az egyenként kódolt fehérjék
tulajdonságaitól, többnyire ebből is, abból is megőriznek valamit.
Tevékenységük ezért más és más. A fertőződések során keletkező
egyesülésfehérjék új tulajdonságokat adnak a vírusnak, nem ismert helyzetek
keletkezhetnek, például nem várt betegség.
Az egyesülésfehérjék mesterségesen is létrehozhatók a
gének átrendeződésével; ezeket átrendeződési egyesülésfehérjéknek (recombinant fusion proteins) nevezik.
 fehérjebontacs 26S proteasome sokfehérjés,
henger alakú, a fehérjék zömének lebontását végző törzsökös képződmény;
proteázok rendszere. A 20S magrészből (core particle, CP) és két 19S szabályozó
részből (regulatory particle, RP) tevődik össze. A szabályozó részek a magrész
két végén vannak, így alakul ki a fehérjebontacs hengeres formája két
sapkaszerű végződéssel. (Az ábrán a magrész kékkel, a szabályozó részek
bordóval jelölve láthatók. Forrás: Wikipedia) Az egységek összerendezése
meglehetősen bonyolult folyamat, dajkafehérjék támogatásával megy végbe. Négy
egymásra rétegződött gyűrűs szerkezet (két külső β- és két belső α-gyűrű)
képezi a hordószerű magrészt, amelynek 14 különböző, de összesen 28 alegysége
(kétszer hét α és kétszer hét β) van. A proteázok, amelyek a β-gyűrűben vannak,
tevékeny részükkel a magrész belseje felé néznek, ekként csak a magrész
belsejébe jutott fehérjéket bonthatják.
fehérjebontacs 26S proteasome sokfehérjés,
henger alakú, a fehérjék zömének lebontását végző törzsökös képződmény;
proteázok rendszere. A 20S magrészből (core particle, CP) és két 19S szabályozó
részből (regulatory particle, RP) tevődik össze. A szabályozó részek a magrész
két végén vannak, így alakul ki a fehérjebontacs hengeres formája két
sapkaszerű végződéssel. (Az ábrán a magrész kékkel, a szabályozó részek
bordóval jelölve láthatók. Forrás: Wikipedia) Az egységek összerendezése
meglehetősen bonyolult folyamat, dajkafehérjék támogatásával megy végbe. Négy
egymásra rétegződött gyűrűs szerkezet (két külső β- és két belső α-gyűrű)
képezi a hordószerű magrészt, amelynek 14 különböző, de összesen 28 alegysége
(kétszer hét α és kétszer hét β) van. A proteázok, amelyek a β-gyűrűben vannak,
tevékeny részükkel a magrész belseje felé néznek, ekként csak a magrész
belsejébe jutott fehérjéket bonthatják.
A szabályozó részek biztosítják, hogy a központi rész
proteázokat tartalmazó üregébe csakis a lebontandó fehérjék jussanak be. A
48-as vagy a 11-es helyzetű lizinen ubikvitinlánccal kapcsolt – sokubivitines –
fehérjéket azonosítják, és szálítják a magrészbe. Azokat a fehérjéket,
amelyeknek a lizinjén csak egy ubikvitin van, nem ismeri fel, akkor sem, ha a
fehérjén belül sok lizinen van egy-egy ubikvitin [többubikvitines fehérjék]).
Ismert egy-két fajta olyan fehérje (pl. ornitin-dekarboxiláz), amelyet a 26S
fehérjebontacs ubikvitinjelölés nélkül bont le – ezek szerkezete a
tevékenységük végeztével úgy módosul, hogy a fehérjebontacs felismeri. A
szabályozó részek nemcsak felismerik és kötik a fehérjét, hanem le is
választják az ubikvitineket róluk, amelyek újra felhasználódnak. A leválasztást
három dezubivitináz (deubiquitinases, DUBs) végzi. az izopeptidkötések
szétbontásával. A fehérjéket a magrész bontja le kis peptidekre. Emlősökben
három β alegység (β1, β2 és β5) vesz részt a fehérjék vízbontásában.
A fehérjebontacsok a sejtosztódás és a sejtvégzet
szempontjából is alapvetőek; gátlásuk a sejtkör megrekedéséhez, a sejt
elpusztulásához vezet, ezért rákok és fertőző betegségek (pl. HIV) kezelésének
célpontjai is.
A sejtben nemcsak 26S fehérjebontacs van: keletkeznek
más formák is, mint a PA200-kötött, az immun-fehérjebontacs vagy a
thymo-fehérjebontacs.
▪ A PA200 egyetlen nagy polipeptid, a C-végén sajátos
mintázattal (HBYX motif), amely szükséges a fehérjebontacs magrészéhez történő
kapcsolódásához. A PA200 többek között képes acetilált hisztonfehérjéket a
fehérjebontacshoz irányítani, így szerepe van a kromatin átszervezésében, és
részt vesz a DNS-hibák kijavításában is.
▪ Az immun-fehérjebontacsban az egyik 19S szabályozó
rész helyett egy 11S szabályozó egység található. Gyulladáskeltők (IFNγ, TNFα)
hatására fokozódik a szokásostól eltérő β1, β2 és β5 alegységek képződése, és
az immun-fehérjebontacs összeszerelődése, amely a plazmahálózattal kapcsolódik.
Feladatuk az MHCI-molekulák által bemutatott antigén peptidek képzése: ezek a
β1, β2 és β5 alegységek a sejtfehérjéket más helyen hasítják, mint a 26S
fehérjebontacsban, így lesznek a keletkező peptidek antigén tulajdonságúak. Az
MHCI-molekulákkal a plazmahálózatban társulnak. Az MHCI-ek által bemutatott
antigén peptidek zöme ezekben a fehérjebontacsokban képződik.
▪ A thymo-fehérjebontacs egyetlen β-egységben (β5)
különbözik az immun-fehérjebontacstól. Ezt a β-egységet a csecsemőmirigy kérgi
sejtjei képezik. Szerepe van a CD8+ T-sejtek pozitív
kiválogatódásában.
fehérjebontás a
polipeptidek elektronkötéseinek felszakítása. A sejtek fehérjebontó rendszerei
végzik. A bontás lehet részleges vagy teljes.
▪ Részleges a bomlás, ha egy-egy gomoly egyben marad,
és megőrzi tevékenységét is. Ilyenkor a fehérjebontó enzimek (proteázok)
többnyire a bolyhok közötti kapcsolatokat hasítják. Pl. az IgM hasításakor
keletkező Fab, amely megőrzi az antigént felismerő képességét.
• Teljes bontáskor a fehérje összetevőire, aminosavakra
esik szét.
A
fehérjék leépítése ugyanolyan fontos a fehérjék egyensúlyi állapotának
fenntartásában, mint a fehérjék képzése. A szükségtelenné vált, a hibás, a
káros fehérjék lebontása nélkül a sejt előbb-utóbb elpusztul.
A fehérjék élettartama nagyon változó; a felezési
idejük (half-life) széles határok között (egy pillanattól néhány napig)
változik. Az N-végi szabály értelmében a fehérjék felezési ideje az N-végükben
kódolt, de külső tényezők (pl. éhezéskor sok fehérje bomlik) és belső hatások
is befolyásolják. Például meghatározza a feladatuk: bizonyos folyamatok
ellátására képződnek, a közreműködésük lezajlásával rendszerint leépülnek.
Ilyenek a jelvitelben, az átírásban, a DNS kijavításában stb. résztvevők.
(→N-végi szabály)
A sejtfehérjék lebontása nagyon pontosan szabályozott;
mindig a sejt igényei szerint alakul. A hibás, kóros fehérjék azonnal
lebontódnak, az immunfelügyeletben résztvevők, a hormonok mindig szükség
szerint képződnek és bomlanak. A sejtplazma fehérjéi pillanatonként változnak a
végbemenő folyamatok (jelvitel, sejtválasz stb.) igényei szerint. Ennek
megfelelően képződnek és pusztulnak is; ha rögvest nem bomlanának le,
felhalmozódásukkal elpusztulna a sejt.
A fehérjék lebontásának másféle jelzése is van:
bizonyos aminosavsor és szerkezet viselkedik lebontási jelként. Ezek szokásosan
rövid szakaszok. Elsősorban a kötött, nem mozgékony, például sejtfali
fehérjéknél érvényesül ez a jelzés, és inkább fehérje-átalakuláshoz, semmint
lebontáshoz vezet. A fehérjéknek csupán töredéke választódik ki ennek alapján.
Előfordul fordított, a fehérje rögzülését biztosító jelzés is, például a
dezubikvitináció mozgósítása.
N-végi szabály N-end rule A
szabály értelmében a fehérjék zöme, mindenekelőtt a sejtbeli fehérjék, a
keletkezésük pillanatától hordoz az N-végen olyan jelet, amely meghatározza az
élettartamát. Ezeket angolul degronoknak nevezik, magyarul bomlásjelek*.
Az N-végi szabálynak két formáját különböztetik meg: az
Ac- és Arg-N-végi szabályt (Ac/N-end és Arg/N-end rule). Az elsőnél a befejező
aminosav vége acetileződik (N(α)-terminally acetylated, Nt-acetylated residues)
– a fehérjék ~80%-a tartozik ide. A másodiknál nincs acetileződés, a befejező
aminosavhoz arginin kapcsolódik (arginileződés, N-terminal arginylation). Az
N-végi jelzést létrehozó enzimek: metionin-amidopeptidáz, kaszpázok,
Nt-acetilázok/amidázok, calpains arginil- és a leucil-transzferázok.
A fehérjék N-végi szabályozása a fehérjeháztartás
alapvető része, a fehérjék tevékenységének csaknem minden folyamatában
meghatározó.
fehérjeelemek a fehérjék önálló tevékenységű részei, amelyek rendre
szerkezetükben is elkülönülnek. Alapvetően kétfélét különböztetünk meg: a
gomolyokat és a mintázatokat. (→gomoly, mintázat)
fehérje–fehérje kölcsönhatások protein–protein interactions, PPI két vagy több fehérje társulása; a sejtfolyanatok
mindegyikében bekövetkezik. Három alapformájuk ismert:
▪ felszíni
illeszkedés* surface–surface interaction a két fehérje felszini
domborzata illeszkedik egymásba, mint a kulcs a zárba. Rendkívül fajlagos,
viszonylag erős kapcsolódás.
▪ csavarmenetes illeszkedés*
helix–helix interaction a társuló fehérjék egy-egy csavarmenete
illeszkedik egymásba, fonadékot (coiled coil) képezve. Erős kapcsolódás;
jellemző a génműködést szabályozó fehérjék kötődésére. (→fehérjealakzatok)
▪ hurokágyazódás*
surface–string interaction az egyik fehérje kiálló hurka (aminosavlánca)
belefekszik a másik fehérje felszíni vájatába. Általában a foszforilezendő
gomolyok megnyúlt aminosavlánca kötődik így, pl. SH2 gomoly tirozonsora a
foszforilező fehérje vájatába.
fehérjeformák a
fehérjék megjelenési alakjai. A
fehérjéket formájuk szerint két csoportra osztjuk: a gombolyag és a szálas
fehérjékre.
gombolyag fehérjék globular proteins (globuláris) egy vagy több
hosszú polipeptidlánc vizes közegben végbemenő felgomolyodásának a
következményei. Többé-kevésbé gömb alakú, tömör gombolyagok, amelyeknek a
magját a víztaszító, a külsejét a vízkedvelő aminosav-maradékok alkotják. A
gombolyagos szerkezet létrejöttében tehát a vizes közeg a meghatározó; a
fehérjék zöme ugyanis vizes közegben van. A víz kiszorítja a víztaszító
aminosavak oldalláncait, ezek gombolyodnak, befordulnak, a fehérje belsejét,
magját (core) alkotják, a vízkedvelők pedig a felszínen helyezkednek el. A
fehérje gömbformájú lesz. A fehérjék felszínét alkotó vízkedvelő oldalláncok
védik a fehérjét a víznek a bomlasztó hatásától. Az aminosavaik sorrendje különböző.
Lényeges a fehérjék tömött, hézagmentes
szerkezete, az aminosavak szoros illeszkedése és kapcsolódása. Kapcsolódás
másodlagos kötésekkel jön létre; pl. van der Waals-kölcsönhatással, amely a
magban lévő, víztaszító aminosavak között keletkezik, azokat tartja össze, hogy
ne kerüljenek a felszínre. Jóllehet ez a kötés gyenge, de nagyon sok van
belőle, ekként jelentős. Keletkezhet ionos kötés a pozitív és negatív töltésű
aminosavak (leucin [negatív töltés] – aszparagin [pozitív töltés]) között, ha
közel kerülnek egymáshoz. Kialakulnak továbbá kettős szulfidkötések; ezek a
polipeptidláncot kötik keresztkötések formájában, rögzítve a szerkezetet.
Létrejöhet kapcsolódás a víztaszító és vízkedvelő aminosavak között is, ami a
felszíni aminosavakat láncolja a mag felé. A kötések száma és formája a
fehérjék egyediségének jellemzője, harmadlagos szerkezetük állékonyságának
biztosítója. Ha a fehérjében üresség keletkezik, helyét víz foglalja el,
bomlasztva a víztaszító belső szerkezetet.
A gomolyag fehérjék vízben oldódnak,
környezeti hatásokra (pH-, hőmérsékletváltozás) érzékenyek. Sokukban, főleg az
enzimekben, behúzódás is fellelhető, amely két lebenyre, az N- és a C-lebenyre
(N lobe, C lobe) osztja a molekulát. Az N-lebeny az N-végnél, a C-lebeny a
C-végnél lévő.
A gombolyagfehérjék többnyire a
helyváltoztató fehérjék, sokféle feladatot látnak el: enzimek,
szállítófehérjék, tapadó- cserélőfehérjék, jelközvetítők, immunfehérjék, de
részt vesznek szerkezetekben is, pl. G-aktin. (→aktin)
Előfordulnak sajátos formák, pl. a tüskefehérjék,
amelyek a felszínből tüskeszerű kinövéseket tartalmazó fehérjék; a
koronavírusok jellegzetességei.
szálas fehérjék fibrous (structural) proteins hosszú, erős, vízben nehezen oldódó fehérjék; zömében
szerkezeti fehérjék (structure proteins). Szokásosan kötésekkel (London-erők,
ionkötések, hidrogén- és S–S hidak) összetartott párhuzamos hosszú
polipeptidekből állnak, amelyek egymásba fonódva kötegeket alkotnak; mások
lemezes formájúak. Egy-egy polipetid több ezer aminosavmaradékot is
tartalmazhat, rendszerint ismétlődő szakaszokban. Gyakori köztük a glicin,
amely kis aminosav, és ezáltal lehetővé teszi, hogy a polipeptidek közel
kerüljenek egymáshoz, köztük erősebb kötések jöjjenek létre. A szálas fehérjék
erős szerkezetek (nagy a szakítószilárdságuk), védő- és tartófeladatokat
(vázfehérjék) látnak el, távolságokat hidalnak át, de közéjük tartoznak az
összehúzódók is (izomfehérjék). Idegen molekulát (prosthetic group) nem
tartalmaznak. Legjelentősebbek: →kollagén, →keratin, →elasztin.
A szálas fehérjék jószerivel mindig
kapcsolódnak másik polipeptiddel, egyesek többel is – tehát negyedleges
szerkezetek. A polipeptidek sokféle módon társulnak, egy-egy szálas fehérjére
jellegzetes szerkezetek jönnek létre, pl. elasztin, kollagén. A társulás egyik
gyakori formája két vagy több α-csavarulat fonódása az α-fonadék*
(coiled coil). (→fonadék)
fehérjegomoly* domain (domén) a fehérjében elkülönülő, 40–250 (általában 41–100)
aminosav nagyságú, önállóan (a fehérjék többi részétől függetlenül)
feltekeredő, állandósult, tömör, jellegzetes térszerkezetű, a másodlagos és a
harmadlagos szerkezeti szint közötti egység. Szokásosan β-kanyarokkal
összekötött α-csavarulat, β-lemez vagy ezek együttesének valamilyen
változatából áll. Általában a fehérjék feladatának, kapcsolódásainak a
megvalósítója, de van olyan is, amelynek elkülönült saját működése van – ez
teszi lehetővé, hogy a fehérjék többféle feladatot is ellássanak, többféle
fehérjével is kapcsolatba léphessenek, és összehangolt hálózatot hozzanak
létre. Egyes gomolyokban előfordul más molekula is, például. fémion
(hemoglobin). Általában egy képező kódol egy gomolyt, de előfordul, hogy a
közteskivágódás következtében összevágódott több képező hozza létre.
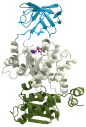 A legkisebb fehérjékben egy gomoly van, a nagyokban
akár száz is lehet. A magasabb rendű szervezetekben a fehérjék rendszerint több
gomolyt tartalmaznak jól elkülönülve; szokásosan más-más feladattal, például az
egyikkel kapcsolódik, a másik a feladatát hajtja végre. (Az ábrán a
háromgomolyos piruvát-kináz látható; forrás: Wikipédia.) Számos gomoly többféle
fehérjében is megtalálható; ezek működése különböző lehet. Vannak több egyforma
gomolyt tartalmazó fehérjék is.
A legkisebb fehérjékben egy gomoly van, a nagyokban
akár száz is lehet. A magasabb rendű szervezetekben a fehérjék rendszerint több
gomolyt tartalmaznak jól elkülönülve; szokásosan más-más feladattal, például az
egyikkel kapcsolódik, a másik a feladatát hajtja végre. (Az ábrán a
háromgomolyos piruvát-kináz látható; forrás: Wikipédia.) Számos gomoly többféle
fehérjében is megtalálható; ezek működése különböző lehet. Vannak több egyforma
gomolyt tartalmazó fehérjék is.
A gomolyok szerkezetét a másodlagos szerkezeti jelekkel
és a mintázatokkal írjuk le – sokszor hozzátesszük a tekervényeket is. Bármily
jellegzetesek is valamely egység mintázatai, azokból nem következtethetünk a
működésére, mert előfordulhat más egységekben és a polipeptid nem tevékeny
területein is.
Nemzetközi nevükben gyakorta szerepel a homology
(hasonlóság) szó, utalva arra, hogy a gomoly szerkezete hasonló az abban a
fehérjében lévőéhez, amelyben felfedezték. Például: PH-gomoly (pleckstrin homology domain), amelyet a pleksztrin fehérjében ismertek fel.
Egyébként a nevüket általában betűszóval jelöljük. A gomolyokat síkban henger
vagy doboz alakúnak ábrázolják – sokszor nevezik is őket az angol irodalomban boxoknak.
Sokféle gomoly ismert. Jellegzetesebb csoportjaik:
▪ DNS-kötő gomolyok* (DNA binding domains)
a DNS egyes szakaszait fajlagosan azonosítva kötődnek a DNS-sel. Szokásosan az
átírásfehérjékben és a DNS-hibajavító fehérjékben találhatók. (→DNS-kötő gomolyok)
▪ Fehérjekapcsolati gomolyok* (protein interaction domains),
protein–protein interaction domains, modular protein domains, protein modules a
fehérjék közötti kapcsolatokat hozzák létre. Sokféle fehérjében megtalálhatók;
egyazon fehérjében gyakran több is van. A fehérjekapcsolati gomolyok 40–200
aminosavat tartalmaznak, és rövid (3–6 aminosavból álló), vonalas mintázatokat
(aminosavsorokat) ismernek fel (sormintázat*), ezekkel kapcsolódnak. A gomoly
néhány aminosava létesít közvetlen kapcsolatot a társuló fehérjén felismert
aminosavakkal, gyenge kötésekkel. Az SH2 gomoly például ~100 aminosavból áll,
és foszfotirozint tartalmazó mintázatot ismer fel. Ugyancsak foszfotirozint
azonosít a PTB (phosphotyrosine binding), de más
mintázatban állót, mint az SH2. Az SH3 viszont többprolénes, 8–10 aminosavból
álló ismétlődéseket vesz észre. Az azonosító mintázat nemcsak a kapcsolódást,
hanem a ráhatást is irányíthatja, például, hogy melyik aminosav
foszforileződjék. Bizonyos gomolyok a pozitív és negatív töltések elrendeződése
(mintázata) szerint kapcsolódnak, és fejtik ki hatásukat – ilyen a PB1 (Phox
and Bem 1) gomoly. Mintegy 85 féle fehérjekapcsolati gomolyt ismerünk.
(→fehérjekapcsolódás)
▪ Kettősödési gomolyok* (dimerization domains) Bizonyos
fehérjék csak kettőst képezve hatékonyak; kettősödhetnek önmagukkal (azonos
kettős, homologic dimer) vagy más fehérjével (felemás kettős, heterologic dimer).
TRFH (TERF Homology Domain) a TERF1 (telomere repeat binding factor 1) vagy a TERF2 (telomere repeat binding factor 2) önmagával való párosodást hozza létre. Sajátos négyes
szerkezet keletkezik. Állványként is szolgál más fehérjék társulásához, például
RAP1. (→RAP1, TERF1, TERF2)
▪ Négyesítő gomolyok* (tetramerization
domains) négy fehérjét összekapcsoló gomoly. Egyes fehérjék, például a p53,
csak négyest alkotva hatékonyak; négy p53 fűződik egybe bennük (homotetramer).
▪ Nyolcszálas αβ-gomoly* (α/β barrel domain)
nyolc párhuzamos β-lemezből és az azokat körülvevő 7–8 α-csavarulatból áll; a
belső β-lemez mindegyike kapcsolódik egy α-csavarulattal, úgyhogy a szerkezet
(α/β)8 szerkezetként írható le. Hordóra emlékeztető formájából
származik a nemzetközi neve, ámbár nem teljesen olyan. Gyakran találunk bennük
további α-, β- és más mintázatokat, sőt másik gomolyokkal is összefonódhatnak.
Az ilyen enzimek családot képeznek, egyetlen „őstől” származnak, és igencsak
szétágazó tevékenységűek. Jellegzetes képviselőjük a tirozinfoszfát-izomeráz,
TIM1. (→TIM1)
▪ Proléngazdag gomolyok* (proline rich domains) sok
prolént tartalmazó gomolyok. A fehérje sajátos térszerkezetét hozzák létre, ami
elősegíti a fehérje kötődését más molekulával.
▪ Rendezetlen szerkezetű gomolyok* (intrinsically
disordered domains, IDDs) jellegzetes mintázat és sajátosság nélküli,
alig tekeredett gomolyok; térszerkezetüket könnyen változtatják. Mivel
szerkezetük kevéssé kötött, rugalmasan, nagyobb alkalmazkodással képesek részt
venni nagyon különböző biológiai folyamatokban (felismerésben, szabályozásban,
jelközvetítésben). A magasabb rendű szervezetekben gyakoribbak, ami arra utal,
hogy a fehérjék törzsfejlődésének magasabb fokozatai. Jelentősek a kutatás
szempontjából is: a szerkezetkutatás fordított megközelítésének módja – a
mintázathiány felől közelíthetők meg a szerkezeti összefüggések.
▪ RING (really interesting new gene) gomoly (RING finger
domain/protein) C3HC4 aminosav-mintázatot
és két cinkiont tartalmaz. 40–60 aminosavból áll; központi α-csavarodással és
szegélyező két hurokkal, amelyeket a cinkion rögzít. Az ubikvitjelölésben van
meghatározó szerepe, állványfehérjeként vesz részt: nem köti az ubikvitint
elektronkötéssel. A RING gomolyt tartalmazó fehérjéket RING fehérjéknek
nevezzük. (→ubikvitinezés)
▪ RNS-kötő gomolyok* (RNA binding domains) az
RNS egyes részeit, rendre a végeket, fajlagosan azonosítva kötődnek az RNS-sel.
(→RNS-kötő gomolyok)
▪ Sarkallógomolyok* (catalytic domains) az
enzimek hatóegységei. Általában törzsökös szerkezetűek, és jellegzetesek az
enzimcsoportokra. Például a kinázok mindegyikében ~250 aminosavból álló,
sajátos térszerkezetű foszforilező gomoly van (kinázgomoly).
▪ Kölcsöntevősítő gomolyok* (transactivation
domains, TAD) állványfehérje, több fehérjét köt, megteremtve kölcsönhatást
közöttük, hogy kölcsönösen tevősödjenek.
▪ Beágyazottt gomly* olyan gomolyak, amelyek másik gomolyban vannak. Ilyen például az E2F1
fehérjecsalád daganatgátló-társulási gomoly, amely a kölcsönhatást serkentő
gomolyba van beépítve.
fehérjehiány hypoproteinemia a szervezet olyan állapota, amelyben a
szükségesnél kevesebb a fehérje. A szérumfehérje szintje alacsonyabb az
élettaninál (50–65 g/l). A fehérjék 60%-a albumin, ez a májban képződik nagy
mennyiségben.
Vizenyőképződés
a leginkább szembetűnő tünet, főleg a lábon figyelhető meg, de a test más
területein is. Fogynak az izomsejtek, a haj száraz és hullik.
A
fehérjék a sejtek minden működésében részt vesznek, hiányukban szinte minden
gyengül, immunrendszer, szervek működése stb. Súlyos hiány életveszélyes
állapot.
A
fehérjék nem raktározódnak a szervezetben, az utánpótlásról folyvást
gondoskodni kell; ezt a megfelelő táplálkozás biztosítja. Fő fehérjeforrás:
vörös hús, szárnyasok, hal, tojás tej, tejtermékek, bab, borsó. Lényeges a
vitaminok, ásványi anyagok megfelelő mennyisége.
A
fehérje rögvest felszívódik, ha nincs felszívódási zavar, például, Crohn-baj,
előrehaladott rák stb.
fehérjehormonok endokrin jelvivők. Kis
mennyiségben képződnek a mirigysejtekben. A szérumba került hormonok jelentősen
felhígulnak, és sok le is bontódik. Többségük fehérjéhez kötve kering; szabadon
általában töredéknyi mennyiség van. A hatást az utóbbiak fejtik ki – az erekből
ugyanis csak a szabad hormonok lépnek ki, csak ezek kapcsolódnak a jelfogóhoz,
váltanak ki sejtválaszt.
fehérjekapcsolódások protein bindings a fehérjék kapcsolódása ionokkal, kis molekulákkal
vagy nagymolekutákkal. Két változata a fehérjék kötődése és a fehérjék
társulása.
▪ fehérjekötődés vegykötésekkel létrejövő fehérjekapcsolódás; a
kapcsolódást a vegykötés hozza létre. Lehet elektronkötéssel vagy gyenge
kötésekkel létrjövő, pl. →jelvivő–jelfogó kötődés. (→gomoly)
▪ fehérjetársulás szerkezeti
illeszkedésből keletkező kapcsolódás, nem vegykötés alakítja ki. Vegykötés
másodlagosan, a kapcsolódást követően jön létre; pl.→fehérje–fehérje társulás. Sajátos formája a kiváltott illeszkedés (induced fit),
amikor a fehérjetársulás következtében létrejövő térszerkezeti változás
alakítja ki a teljes illeszkedéshez szükséges térszerkezetet. (→jelvivő–jelfogó kötődés)
A
fehérjék szokásosan sajátos szerkezeti egységeikkel, a gomolyokkal kapcsolódnak
egymáshoz. (→gomolyok)
fehérjeképződés protein synthesis a gének által közvetített genetikai üzenet átformálás
mRNS-be és fehérjébe. Négy folyamatos részből tevődik össze: az üzenet átírása
elő-mRNS-re, az elő-mRNS átalakítása mRNS-sé, az mRNS átfordítása polipeptidre
és a polipeptid módosítása fehérjévé. A gének átírása a DNS-ben, az elő-mRNS
átalakítása mRNS-sé a sejtplazmában, az mRNS átfordítása polipeptidre a
ribotestecsekben, a polipeptid módosítása fehérjévé pedig zömében a
sejtcsövecsezet–Golgi rendszerben, kisebb részben a sejtplazmában megy végbe.
(→átfordítás, elő-mRNS, fehérjemódosítás, génátírás, hírvivő RNS)
fehérje-kináz protein kinase ATP felhasználásával foszforilező enzim. A
transzferázok csoportjába tartoizik (foszfát-transzferáz). Többféle ismert;
mindegyiknek ATP-kötő, foszforilező és szabályozó gomolya van. Egyesekben
találhatók még irányító (target) gomoly is; ez irányítja az enzimet a sejt
megfelelő részéhez. Az ATP-kötő gomoly glicinben gazdag aminosavsorhoz csatolt
lizinből áll, és ATPáz hatású: lehasítja az ATP γ-helyzetű foszfátcsoportját. A
foszforilező gomoly ~250 aminosavból áll, sajátos térszerkezetű (kinázgomoly);
a lehasított PO4-ot észterkötéssel köti a célfehérje szerin/treonin
vagy a tirozin oldalláncnak az észterkötésre képes OH-csoportjához, amelyet a
szegélyező arginin, lizin aminosavak sorrendje (consensus sequence)
alapján ismer fel. A fehérje-kinázok szerkezeti változás (pl. a jelmolekulával
kapcsolódva) vagy más fehérje-kináz általi foszforilezéssel válnak tevékennyé.
A fehérje-kinázok többsége vagy csak szerin/treonin
(szerin-treonin-kinázok) vagy csak tirozinoldalláncot (tirozin-kinázok)
foszforilez (az előbbi a gyakoribb), ám van mindkettőt foszforilező is. Vannak
csak egyetlen fehérjét foszforilező fehérje-kinázok, zöme azonban többfélét is
képes, sőt nagyon sokféle fehérje foszforilezésére alkalmasak is előfordulnak
(széles hatású kinázok).
Az emberi szervezetben
~500-féle fehérje-kináz fordul elő. Ezeket a foszforilező gomolyok
törzsfejlődési hasonlósága szerint hét csoportba sorolják:
TK (tirozin-kináz, tyrosine
kinase);
TKL (tyrosine kinase-like kinase);
STE (homologues of yeast Sterile 7, Sterile 11 és
Sterile 20);
CDK (cyclin-dependent
kinase) →ciklinfüggő kináz
MAPK (map kinase); GSK3 (glycogen synthase
kinase 3) és CLK (CDK2-like kinase,
CMGC); CK1 (casein kinase 1);
CAMK (calcium/calmodulin-dependent protein kinase) és
az
AGC kinázok csoportjába.
Valamely
szervezet génállománya által kódolt kinázok összességét kinomnak
(kinome) nevezik. (→AGC, CAMK, CDK, CK1, CLK, GSK3, MAPK, tirozin-kinázok, TKL, STE)
fehérje-kináz-A protein-kináz-A,
PKA (más néven: cAMP-függő kináz [cAMP-dependent protein kinase]) cAMP-t
kötő enzim, négyegységes fehérje: két sarkalló- (Kat2 [dimer]) és
kötőegységből (R2) épül fel. A két kötőegység kapcsolódik egymással,
és mindegyik köt egy kisebb sarkallóegységet. A sarkallóegységben ATP-t kötő,
foszforilező és a kötőegységgel társuló gomoly van. A kötőegységben két, cAMP-t
kapcsoló gomoly, valamint egymáshoz társuló és a sarkallóegységhez fűződő
gomoly van, amelyben szabályozó rész is elkülönül, ez irányítja a
sarkallóegységet. Tevékenységét a sejt sAMP-töménysége szabályozza. Ha a
sejtben a cAMP-szint emelkedik, a kötőegységek megkötnek cAMP-t, a
sarkallóegységek elválnak, és sejtplazmában vagy a magba vándorolva
foszforilezik a célfehérjéket mindaddig, amíg nem csökken a sejt cAMP-szintje. Ennek következtében ugyanis a cAMP elválik a
sarkallóegységtől, és az enzim két-két egysége újra egyesül. Megkülönböztetünk
1-es és 2-es formájú fehérje-kináz-A-t (PKA1, PKA2), az előbbi a sejtplazmában,
az utóbbi sejthártyákhoz kapcsolódva van.
A PKA sokszor társul AKAP (A kinase anchoring protein)
fehérjével, amely állványfehérje, köt egyesleg fehérjéket, pl. a sejtváz, a
sejtközpont fehérjéit. A PKA-t csatolva lehetővé teszi ezek foszforilezését. A
PKA társulhat még PKA-gátlókkal (protein kinase inhibitors), amelyek álcélfehérjék,
kötik a sarkallóegységeket.
A PKA széles hatású fehérje-kináz, foszforilez:
▪ sokféle enzimet (jellegzetes példa: a PKA
foszforilezi a foszforiláz-kinázt, ez pedig a glikogén-foszforilázt, amely a
glikogén lebontásához vezet);
▪
ioncsatornákat, pl. a kalcium ioncsatornát a szívizomsejtekben;
▪
hisztonokat;
▪
átírásfehérjéket.
Ennek
megfelelően nagyon sokféle sejtfolyamatban vesz részt.
fehérjeköpeny capsid (kapszid) a vírus DNS vagy a vírus RNS
fehérjeburkolata. A vírus rövid szakasznyi DNS-e/RNS-e ebben van becsomagolva,
Ez védi, nélküle azonnal elposztulna. A védőhatás mellett a vírus DNS/RNS
tevékenységét is befolysolja. (→vírusszerkezet) A fehérjeköpenyt alkotó
fehérjéket köpenyfehérjéknek (capsid proteins) vagy DNS/RNS rétegző fehérjéknek
(viral coat proteins) nevezzük. A virus DNS-t a fehérjeköpenyével köpenyes
DNS-nek, az RNS-t pedig köpenyes RNS-nek mondjuk.
A
fehérjeköpeny összetevőit az adott vírus génjei kódolják, ezért vírusonként
nagyon különbözők. Szerkezetük azonban hasonló: pártagú alegységekből
(oligomerek), fehérjékből tevődnek össze. A pártagú alegységeket a nemzetközi
irodalom proteomereknek nevezi; magyarul fehérjenéhányas*.
Az
egy-két tagú fehérjékből álló alegységek térszerkezeti képződményeinek –
amelyek megfelelhetnek, meg nem is egy fehérjének – capsomer a nevük,
magyarul köpenynéhányas*.
A
fehérjeköpenyeknek mértani szerkezetük szerint csavarvonalas és ikozaéderes
formája ismert. Ennek alapján osztályozzák őket.
fehérjeköpenyes
vírus DNS/RNS nucleocapszid a
vírus DNS vagy RNS és fehérjeköpenyének együttes neve.
fehérjemintázat a
fehérjék szerkezeti elemeiből keletkező jellegzetes, törzsökös alakulat
sajátszerű feladat ellátására; a fehérjéket sokszor ennek alapján ismerik fel.
Többé-kevésbé önálló elemként viselkedik, amely elveszhet, többszöröződhet vagy
változhat. Létrejöhet a fehérjék elsődleges és másodlagos szerkezetéből is. A
fehérjék bonyolult felépítése a szerkezeti elemeknek szinte végtelen
formálódási, társulási változatát teszi lehetővé, vagyis megszámlálhatatlan
mintázat jön létre. A molekulák kizárólag ezeket azonosítva kapcsolódnak; ez a
biológiai folyamatok fajlagosságának kulcsa. Néhány nagyon gyakori, sajátos
mintázatot külön elnevezéssel illetnek, gyakorlati jelentőségük miatt.
■ Elsődleges szerkezeti mintázatok
(vonalas mintázatok) sajátos feladatra (kötés, felismeréshely) összeállt 3–10
aminosav. Egysíkú mintázatok; innen a vonalas elnevezés. A nemzetközi
irodalomban sokféle nevük van: sequence motif (szerkezetmintázat*), core motif,
ligand-binding surfaces, ligand recognition pockets és linear motifs. Gyakoribb
elsődleges szerkezeti mintázatok:
▪ A cinkujj mintázat két ciszteinből és két
hisztidinből álló aminosavszakasza, amely a szerkezetet összetartó cink iont
köti.
▪ A foszforilezési mintázat (linear
phosphorylation motif), amely a foszforilezés helyét (phosphosite) kijelölő
aminosavsor.
▪ Walker-mintázatok az ATP-t kötő fehérjék
jellegzetes törzsökös mintázatai. Kétfélét: Walker-A- és Walker-B-mintázatot
különböztetünk meg. (→Walker-mintázat)
▪ Az RGG/RG mintázat argininben (R) és glicinben (G)
gazdag (RGG [arginin–glicin–glicin]). Ezernél is többféle fehérjében van jelen,
számos sejtbiológiai folyamatban (génátírás, elő-mRNS kivágása, DNS-hiba jelzése, átfordítás, sejtvégzet szabályozása
stb.) vesz részt. Ismert három és két RGG-s formája, és azoknak is számos
változata; az RG-tag különáll.

Az ábrán az RGG/RG mintázatoknak a FUS (fused
in sarcoma) RNS-t kötő fehérjében lévő három RGG-s formája (tri-RGG,
kékkel jelölve) látható. A feltüntetett RGGRG mintázat RG-
(arginin–glicin) tagja a sor végén van.
■ Másodlagos szerkezeti mintázatok (secondary
structural motifs) a másodlagos szerkezeti elemek (α-csavarulat, β-lemez stb.)
kapcsolódásából létrejövő, jellegzetes szerkezeti formák; törzsökös
térszerkezeti egységek, többé-kevésbé önálló feladattal (kapcsolódás,
felismerési hely stb.). Nevezik super secondary structuresnek is, utalva
arra, hogy ezek a szerkezetek a másodlagos szerkezeti elemeknek már magasabb
fokú szerveződései, de még nem harmadlagosak. A legegyszerűbbek 2–3 szomszédos
másodlagos szerkezeti elemből formálódnak, a bonyolultabbak pedig ezekből
tevődnek össze. Az ilyen mintázatok gyakran ismétlődnek egy-egy fehérje
valamelyik részében, illetve más fehérjékben is hasonlóan fordulnak elő.
Jellegzetességük, hogy hasonlóságuk ellenére az aminosav-összetételük nagyon
eltérő is lehet. A másodlagos elemekből alakult mintázatok állhatnak
α-elemekből (α-mintázatok); β-elemekből (β-mintázatok), pl. a görög mintázat
(Greek-key motif), amelyet ellentétesen futó β-lemezek és az ezeket
osszekötő β-fordulások alkotnak; legtöbbjükben azonban mindkettő előfordul
(αβ-mintázatok), pl.az αβ-hordók (αβ barrels), amelyek nyolc
α-csavarmenetből és nyolc β-lemezből állnak.
Néhány α-csavarodási alapmintázat:
▪ α-csavarodás–kanyar–α-csavarodás* mintázat
(helix-turn-helix motif, HTH) rövid, visszaforduló kapcsolóval (aminosavakkal)
összekötött két α-csavarodás. Az egyik legyakoribb DNS-hez kapcsolódó mintázat:
a C-végi α-csavarodás illeszkedik a DNS nagygödrébe, az oldalágai pedig
bázisfajlagosan kapcsolatba lépnek a nukleotidokkal. A génműködést szabályozó
fehérjék legtöbbjében megtalálható.
Sokféle változata ismert (dihelical,
trihelical, winged helix-turn-helix motif stb.).
▪ α-csavarodás–hurok–α-csavarodás* (egyszerűen: csavarodás–hurok–csavarodás*)
mintázat (basic helix-loop-helix motif, bHLH) hurokkal lazán összekötött két
α-csavarodás; az egyik rövidebb. Rugalmas mintázat, amely lehetővé teszi, hogy
két ilyen mintázatot hordozó fehérje összekapcsolódjék, kettőst képezzen: a két
rövid α-csavarodás fonódik össze. A hosszabbikon vannak a DNS-sel
kölcsönhatásba lépő törzsaminosavak. Az átírásfehérjék egyik törzsmintázata, a
kettős fehérjék szokásos keletkezési eleme.
Néhány α-csavarodás–hurok–α-csavarodás
mintázat:
▪ cinkujj mintázat* (zinc finger motif, nevezik zinc-finger domainnak is) RNS-hez, DNS-hez
kötődő mintázat; a nukleinsavakhoz kapcsolódó fehérjékben általános. Egy
α-csavarodásból és két ellentétes lefutású β-lemezből áll, amelyeket négy
aminosav (két cisztein, két hisztidin) segítségével cink ion köt össze. Van
olyan is, amelyben négy cisztein van. Ezek a mintázatok ismétlődnek egymás
után, jellegzetes ujjszerű kitüremkedésekkel. Az α-csavarodás aminosavai
kapcsolódnak a DNS-sel a nagygödrében. Ez az egyik leggyakoribb mintázat; a
fehérjeállomány ~3%-át teszi ki,
▪ leucinos zármintázat* (leucine zipper motif) két azonos
α-csavarodásból áll, amely rövid szakaszon fonadékot (coiled coil) képezve
társul, hasonlóan az ollóhoz. Az α-csavarmenet minden hetedik aminosava leucin.
A leucinok a C-végen összerendeződnek, és víztaszító hatással hidrogénkötések
jönnek létre. Az N-vég pozitív töltésű, ez a kötőgomoly, fajlagosan kapcsolódik
a DNS ACGT bázissorával – az indítóhoz kötődve serkenti az átíródást. Az
átírásfehérjék jellegzetes mintázata. Kialakulhat egyetlen polipeptidben, de
két polipeptid között is.
▪ EF-kéz mintázat (EF hand), amelyik Ca2+-t kötő mintázat; a kalmodulin E- és
F-csavarodása és összekötő szakasza alapján kapta a nevét.
fehérjemódosítás* (más néven: átfordításkövető módosítás) post-translational protein modification az eredetfehérje (az átfordítással keletkező vonalas
fehérje) szerkezeti változtatása, aminek következtében megfelelően hajtékolttá
és tevékennyé válik. Ez határozza meg a fehérje helyét a szervezetben és a
feladatát. A működőképes fehérjét kialakító fehérjemódosítás a
sejtcsövecsezetben megy végbe; magában foglalja a hajtékolást, a hatáscsoport,
szénhidrát, lipid stb. kapcsolását, S–S- és más kötések kialakulását,
fehérjehasítást, acetilezést, foszforilezést, metilezést stb. Több mint
százféle módosítás ismert, utalva ennek fontosságára.
fehérjenéhányas proteomer a vírus-fehérjeköpeny pártagú
alegységeinek a neve. (→fehérjeköpeny)
fehérjeszerkezet A
fehérjék szerkezetében négyféle szerkezeti szintet (elsődleges, másodlagos,
harmadlagos és negyedleges) különböztetünk meg. Ez kiegészül a második és a
harmadik szint közötti két másodfeletti elemmel (gomoly, mintázat). Mindegyik
szintet az aminosavak sora határozza meg.
elsődleges szerkezet a peptidkötéssel kapcsolt aminosavmaradék-sor.
Voltaképpen a polipeptid. Az átlagos fehérje 300–400 aminosav-maradékból áll,
tömege: ~40 kDa. Van 50 és 2000 aminosav-maradékból összetevődő is, a fehérjék
aminosav-maradék tartománya tehát: 50–2000 aminosav-maradék.
másodlagos szerkezet az aminosavsor elfordulásaiból keletkező alakzat,
amelyet az egymáshoz közel kerülő atomok közt kialakuló hidrogénkötések
rögzítenek. Hidrogénhíd keletkezik a peptidkötés O- és N-atomja között; ez
könnyen kialakul az oxigén és a nitrogén részleges ellentétes töltése miatt. A
másodlagos kapcsolódások tehát a polipeptid gerincében jönnek létre, az
aminosavak oldalláncai nem vesznek részt benne.
Elfordulás az aminosavak oldalláncainak
különbözősége (kiegyensúlyozatlan állapot) révén következik be, és a
peptidkötés elektroneltolódása miatt csak az α-szénatom kétoldali kötésében
lehetséges, ezek szigma-kötések. Az N–Cα kötés elfordulásának szöge
a φ-szög, Cα–C kötésé a ψ-szög (→peptidkötés). A φ–ψ szögpárok által
létrehozott térhelyzetben az N–Cα–C–N atomsorból szabályosan
ismétlődő szerkezetek jönnek létre; ezek a másodlagos szerkezetek. Kialakulásuk
a szögpárok értékeitől függ; azokat az értékeket, amelyeknél kialakulhatnak, a
Ramachandra-leképezés mutatja. A szögpár nagysága azonban a peptidkötések
atomjai és az oldalláncok helyzete miatt behatárolt; a másodlagos szerkezetek
létrejöttéhez szükséges értékek a polipeptidnek csak egyes részein (elfordulási
sziget) jönnek létre, függően az aminosavsortól: attól, hogy milyen aminosavak
kapcsolódnak egymással.
A legjellegzetesebb másodlagos szerkezeti elemek az
α-csavar, a β-lemez és a β-fordulat.
 ■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.
■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.
Az α-csavarodás a polipeptidnek csak
hosszabb-rövidebb szakaszain alakul ki: egyes helyeken megszakad, mert a
hidrogénhíd nem jön létre. Ennek több oka lehet:
• A prolin gyűrűs szerkezetében a nitrogénatomnál nem
áll rendelkezésre hidrogénatom, és a fordulása is korlátozott; ezért nincs
gyűrűs aminosav az α-csavarvonal szerkezetben.
• Egymást taszító aminosavak között,
például két arginin között (negatív töltésű az oldallánc).
• Túl nagy az oldallánc; a társulás
térben nem lehetséges, ilyen a fenilalanin.
Az α-csavarodás elhelyezkedhet a fehérje bármely
részén; átlagosan 12 aminosav-maradék hosszúságú, az N-vége részpozitív, a
C-vég résznegatív, vagyis kétsarkú (dipole) szerkezet.
■ β-lemez (β sheet). Megnyúltan csavarodó
peptidláncból alakul ki a lánc visszakanyarodásaival (β-fordulás). A peptidlánc
ebben is csavarvonalszerű, de egy kanyarulatban csak két aminosav van, ezért
lapos. A visszakanyarodás következtében néhány aminosavnyi peptidszakasz
(β-redő, β strand) párhuzamosan helyezkedik el – egy irányban vagy ellentétesen
(az egyiknek az N-vége és a másiknak a C-vége van egymás mellett) –, közöttük
pedig hidrogénkötések képződnek, amelyek itt is a peptidkötések karbonil- és
NH-csoportja között (CO…NH) jönnek létre.
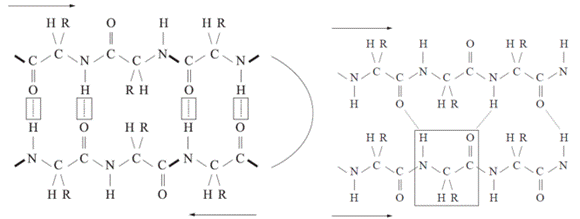 Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.
Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.
A többszörösen egymáshoz kötődött β-szálak alakítják ki
a β-lemezt, amelyből az oldalláncok kilógnak: felettük és alattuk helyezkednek
el. Az egymáshoz kapcsolódó β-szálak származhatnak egyetlen polipeptidből, de
kapcsolódhat hozzájuk másik polipeptid β-szála is (ábra). A β-szálak
különbözősége miatt a β-lemez nem sík, hanem redőzött (pleated β sheet).
Az aminosavak oldalláncai a lemez síkja
felett vagy alatt nyúlnak ki úgy, hogy a sorban egymást követő aminosavak
oldalláncai ellentétes kinyúlásúak, ezért redőszerű, hajtogatott. A párhuzamos
β-redőket hosszabb-rövidebb aminosavszakaszok kapcsolják össze; nemegyszer úgy,
hogy a β-lemez síkja felett/alatt α-csavar szerkezeteket alakítanak ki. Az
ellentétesen futó β-redőket néhány helyen aminosavas visszafordulások kötik
össze; ilyen pl a hajtűfordulás* (hairpin turn), amely két ellentétes irányú
β-szál között keletkezik; összesen két aminosav-maradékból áll. A β-lemez
lapszerű, gyakorta hajtékolt, nagyritkán hengeres formájú, és szokásosan a
fehérje belsejében van: a víztaszító peptidgerinc ugyanis szabadon van.
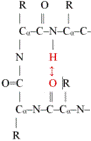 ■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.
■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.
■ Rendezetlen fehérjeszakaszok. Ezek a fenti
mintázatok egyikét sem tartalmazó részei a fehérjéknek, általában a fehérjék
zömét alkotják. A fehérjék alkalmazkodó képességét (kapcsolódás más
molekulával, térszerkezeti változás stb.) biztosítják, lehetővé téve a fehérjék
tevékenységének szabályozását. Talán idevehető a kapocsrész (hinge
region), amely változó hosszúságú hajlékony aminosavmaradék-sor, szokásosan két
gomoly között. Lehetővé teszi, hogy a gomolyok elmozduljanak egymáshoz
viszonyítva feladatuk ellátására. Nincs mindegyik fehérjében. A korábbi
irodalomban találkozunk a Ω-hurok (Ω loop) elnevezéssel, amely
rendszertelen, ismétlődő részek nélküli bonyolult szerkezetű fehérjealakzat.
Megkülönböztetése nem megalapozott.
másodfeletti elemek a →fehérjegomolyok és a →fehérjemintázatok.
harmadlagos szerkezet tertiary protein structure a fehérje (egyetlen polipeptid) háromirányú (3D)
elrendeződése, működőképessé válása; a hatócsoportok a felszínre kerülnek,
lehetővé téve, hogy kapcsolatba lépjenek más molekulákkal. A harmadlagos
szerkezet az egymástól távoli aminosavak közötti kölcsönhatások, alapvetően az
aminosavak oldalláncai között létrejövő kötések (leginkább hidrogénkötések,
ritkábban S–S- és ionos kötések), valamint a víztaszító hatás következménye. A
harmadlagos szerkezetet tehát a peptidkötések mellett kialakuló más elektron-
és nem elektronkötések hozzák létre, tartják fenn. A harmadlagos szerkezet
elsősorban a gombolyagfehérjékben alakul ki, a szálas fehérjékben (→keratin, kollagén, fibroin) kevéssé kifejezett, nem különül el élesen; térszerkezetüket
valamelyik másodlagos szerkezeti elem uralja. A fehérjék a harmadlagos
szerkezeti formában állandók, az energia szempontjából ez a leggazdaságosabb
helyzetük (native state).
A harmadlagos térszerkezetet is
alapvetően az aminosavak sorrendje határozza meg, és önmagától is kialakul. A
dajkafehérjék (chaperonok) elősegítik a harmadlagos szerkezet formálódását:
megakadályozzák, hogy a sejtplazmában állandóan keletkező fehérjék – a
harmadlagos szerkezet lassú formálódása miatt – egymással összekapaszkodjanak
fehérjehalmazokká.
Lényeges, hogy a fehérjék harmadlagos
szerkezete környezeti és más hatásokra (más fehérje társulása, foszforilezés
stb.) felszakadhat, tehát nem állandó. Ennek biológiai jelentősége van, hiszen
a térszerkezet változása, változtatása a fehérjék ki-be kapcsolásának a
leggyakoribb módja, a fehérjeműködés alapvető szabályozója.
negyedleges szerkezet quaternary protein structure két vagy több harmadlagos szerkezetű polipeptid
kapcsolódásából létrejövő nagymolekula (többes fehérje). Az egyes
polipeptideket alegységeknek nevezzük. A negyedleges szerkezet az alegységek
egymáshoz viszonyított térhelyzetét jellemzi. A polipeptidek közötti
kölcsönhatásban ugyanazok a kötések (London-erők, hidrogénkötések, ionkötések
és S–S híd) vesznek részt – vagyis alapvetően gyenge kötések.
A polipeptidek száma szerint
megkülönböztetünk kéttagú (dimer, kettős), háromtagú (trimer, hármas), négytagú
(tetramer, négyes) stb., pártagú (oligomeric proteins) és soktagú (polymer)
fehérjéket. Ezek ekként, tehát kéttagúként, háromtagúként stb. hatásosak.
Kapcsolódhat azonos (homo-…mer) vagy különböző polipeptidlánc (hetero-…mer).
Az összekapcsolódott polipeptidek
szétválhatnak, majd újra egyesülhetnek, függően a működésüktől. A szétválást,
újra egyesülést az teszi lehetővé, hogy azokon a felületeken, ahol a kötődés
létrejön, egymást kiegészítő molekulák vannak – a kiegészítő láncok egymást
felismerik –, és hogy a nem kiegészítő láncok között nem képződik erős
kapcsolódás. A polipeptidek között tehát egy sajátságos kölcsönhatás van, amely
a fehérjék működését is meghatározza, szabályozza – ez a fehérjék önrendelkező
képessége.
Negyedleges szerkezetűnek tartjuk a más
molekulát (hem, szénhidrát, RNS, lipid stb.) tartalmazó fehérjét is.
fehérjeszerkezet-kialakulás A
fehérjék szerkezeti formáinak kialakulása az egyenes polipeptidfonal tekeredésével
jön létre; a tekeredés ugyanis az aminosavak elmozdulásával, közeledésével jár,
aminek következtében kapcsolódnak egymással, hidrogénhidakkal; hajtékolódnak*.
A folyamat szakaszos: először a polipeptidnek csak egyik szakaszán alakul ki
másodlagos szerkezet (köztes állapot A), majd ez kapcsolódik a polipeptid újabb
szakaszával, formálva újabb szerkezeti változását (köztes állapot B) és így
tovább. A polipeptid egyes szakaszai tehát együttműködnek, az egyik változása
váltja ki a következőét – ezt nevezi a nemzetközi irodalom cooperative
nature-nek.
A polipeptid fonal fenntartása energiaigényes, a
tekeredéssel mind kisebb energiával megtartható köztes szerkezetek jönnek
létre, amíg kialakul a fehérjék harmadlagos, a legkevesebb energiát követelő,
biztonságos szerkezete – a fehérjéknek ez a természetes (natív) állapota.
Ahogy egyre több és több fehérje szerkezete
tisztázódik, úgy válik bizonyossá, hogy a természet ugyanazokat a mintázatokat
ismételte a legkülönbözőbb fehérjékben, függetlenül a tevékenységüktől. Oka
könnyen érthető: jóval kevesebb genetikai irányítás és felépítési folyamat
szükséges, mint ha mindegyik fehérje teljesen eltérő szerkezetű lenne. Úgymond:
ez a „leggazdaságosabb módszer”. Ugyanez az elv fedezhető fel a gomolyok
kialakulásában: egy-egy gomoly kialakulását újabbak követték ugyanabban a
fehérjében, ezzel bővült a fehérje működése, így, és nem különállóan
keletkeztek az új fehérjék. Ebből következik, és bizonyítékok is vannak, hogy
bizonyos fehérjék egy-egy „őstől” származnak, családot képeznek, jóllehet a
működésük messzemenően eltérő is lehet.
FMR1 (
fragile
X
messenger
ribonucleoprotein 1) fehérje fragile X messenger
ribonucleoprotein 1 protein, FMRP RNS-t szállító fehérje; az mRNS-hez kötődik; az
mRNS-nek a sejtmagból a ribotestecshez szállításában vesz részt, valamint
gátolja az átfordítást. Leginkább az agyban találhat, lényeges a megfelelő
idegrendszeri és értelmi fejlődéshez, és szerepe van a nők fogamzásában is.
Hiányában fokozott az ingerületátvivők kibocsátása, az idegcsatolódások
telítettek, továbbá visszafogott a GABA- (γ-aminovajsav) rendszer, ezért
fokozott az ingerületátvivés.
GLTSCR1 (
g
lioma
tumor
suppressor
candidate
region
gene 1 protein) fehérje azonos a BICRA fehérjével. (→BICRA)
hártyaátjáró fehérjeLM* transmembrane
protein (→fehérje)
hPB1 (
poly
bromo-1)
fehérje (egyéb nevei: BAF180, polybromo-1D, RSC1/2/4) a pBAF össztes
sajátos, jelzésérzékelő fehérjéje; a sejtburjánzás negatív szabályozója
(daganatgátló fehérje). A PBRM1 (egyéb nevei: BAF180, PB1, SMARCh1, RCC)
gén (3p21.1) kódolja. A gén hibája következtében vesesejtes rák (renal cell
carcinoma, RCC) alakulhat ki.
kapcsolófehérje adaptor protein fehérje–fehérje vagy fehérje–lipid kapcsolódásokat hoz
létre. Olyan fehérjéket vagy fehérjét és lipidet társít, amelyek önmagukban nem
képesek egymáshoz kötődni, de társulásuk elengedhetetlenül szükséges, például valamilyen
sejtfolyamathoz (jelközvetítés) vagy szerkezet rögzítéséhez (az aktinváz
sejthártyához rögzítése).
Több kapcsolófehérje egymáshoz társulva távolságot
hidal át (fehérjehíd), lehetővé téve az egymástól távol lévő molekulák
kölcsönhatását. Esetenként csak egy-egy fehérje között teremt összeköttetést,
máskor több fehérjét is kapcsol, fehérjeössztest alakít ki.
A kapcsolófehérjék szokásosan hordoznak olyan
mintázatokat, kötőgomolyokat (SH2, SH3, PTB, PH gomoly), amelyek lehetővé
teszik, hogy többfélé fehérjével és lipiddel is társuljanak.
A kapcsolófehérje módosulása, hiánya sejtműködési
zavart (betegséget) idézhet elő. A kapcsolófehérje lehet kezelések célpontja
is, például a ráksejtek pusztításánál. (→aktin, arrestin, CRK, CRB2, EMR, gomoly).
növekedésfehérje* growth factor a
sejtek élettani és kóros burjánzását serkentő kis fehérje. Jelvivő, amely
fajlagosan kapcsolódik a jelfogójához (tirozinkinázt gerjesztő sejtfali
jelfogó), kiváltva a sejt növekedését, osztódását és gyakran az elkülönülését
is fokozó jelközvetítést. Részt vesznek jelvitelben, jelátadásban,
jelterjedésben és jelátjutásban is.
Ilyenek pl. az EGF (epidermal growth factor), a PDGF
(platelet-derived growth factor), az FGF (fibroblast growth factor), az IGF
(insulin-like growth factor), a VEGF (vascular endothelial cell growth factor),
a TGF (transforming growth factor), a transferrin stb. Ezek 6–80 kDa nagyságúak,
erősen kötődnek a jelfogóhoz, hatásuk néhány napig tart. Sokféle sejt képez
ilyeneket, de a mirigysejtek nem.
(A growth factor fogalma a nemzetközi
irodalomban nem egységes: sokan a szteroidhormonokat is közéjük sorolják, és
gyakran a citokinekkel azonos fogalomként is használják. A növekedésfehérje
nevezet ezeket kizárja, teljesen egyértelmű.)
nukleinfehérje nucleoprotein
a nukleinsavakkal (DNS-sel, RNS-sel) szerkezetileg kapcsolódó fehérje.
Jellegzetes nukleinferjék a ribotestecsek, a magtestecsek és a vírus burokfehérjék.
Az RNS-sel kapcsolódót ribonukleoproteinnek, a DNS-hez kötődőket
dezoxiribonukleoproteineknek nevezzük (→DNS, nukleoszóma, riboszóma, RNS, vírus)
polybromo-1 fehérje (protein polybromo 1) →hPB1
RAP1 (
Ras-
proximate-1) fehérje kis molekulatömegű GTPáz, jelátviteli fehérje, a RAS-családhoz
tartozik. A sejtplazmában van kétféle állapotban, a tétlen RAP1-GDP és a
hatékony RAP1-GTP formában. Az átalakulást a GEF és a GAP fehérje szabályozza.
▪ A GEF cserélőfehérje a GDP–GTP átalakítást hozza
létre: a GEF kötődik a RAP1-hez, ennek következtében leválik a GDP, a szabadon
maradt kötőhelyhez a plazmában bőven lévő GTP fűződik.
▪ A GAP az RAP1-GTP-hez kapcsolódva serkenti a RAP1
GTPáz működését, leválasztva egy foszfátcsoportot, aminek következtében megáll
a RAP1 működése.
A
RAP1-et két gén, a RAP1A (1-es kromoszóma rövidkarján van; 1p13.3) és a RAP1B
(12q14) gén kódolja, két testvérmás (RAP1A, RAP1B) keletkezik, 95%-os
azonossággal.
RAS- (
Rat
sarcoma) fehérje Ras protein (p21RAS) kis (21 kDa) GTPáz: vízhozzáadással
bontja a GTP-t GDP-re és foszfátra. A RAS (GTPázok) nagycsaládot alkotnak,
amelybe öt család tartozik: ARF, RAN, RAB, RAS, és RHO
család. Négyfajta RAS van, a h- n- és kétfajta kRAS. Szerkezetük és
működésük is hasonló. Ezeket a RAS-gének (hRAS, kRAS, nRAS) képezik. Képesek
kötni GDP-t és GTP-t is, az előbbi a tétlen, a GTP-t hordozó a tevékeny
formájuk. Ezek folyamatosan váltakoznak.
A tétlen RAS-fehérjék a sejtplazmában vannak; jelzésre
(jelvivő–jelfogó kapcsolódás) kapcsolófehérje (GRB2, CRK) köti a jelfogó
foszfotirozinjához, ahol cserélőfehérje segítségével kötnek GTP-t, válnak
tevékennyé. A cserélőfehérje lehasítja a GDP-t a RAS-ról, helyére a
sejtplazmában nagyobb töménységben lévő GTP kötődik.
A RAS-fehérjék gyenge GTPáz hatásuak, ezért GTPáz hatását
fokozó fehérjék (GAP [GTPáz aktivátor protein]) segítségével működnek: a
célfehérjéhez kapcsolódva foszforileznek. A RAS azáltal, hogy képes hasítani a
GTP-t GDP-re, leállítja önmagát is. Részt vesznek a sejtburjánzást, sejtátalakulást,
sejttúlélést szabályozó jelközvetítésekben. (→ARF, RAB, RAN, RHO)
ribonuklein-fehérje (RNP) ribonucleoprotein,
RNP ribonukleinsavból (RNS) és
fehérjéből álló molekula. Az átíródott RNS azonnal kapcsolódik fehérjével,
vagyis a ribonuklein-fehérjék a sejtmagállományban keletkeznek. A tRNS
kivételével mindegyik RNS fehérjével kötődve fordul elő a sejtplazmában. Az
RNS-ekhez általában az RNS-kötő fehérjék (RNA-binding protein, RBP)
kapcsolódnak; ezt az RNS-kötő gomolyok/mintázatok teszik lehetővé. Kiderült azonban,
hogy szép számmal vannak olyan RNS-hez kötődő fehérjék is, amelynek nincs
RNS-kötő gomolya.
A ribonuklein-fehérje lehet viszonylag egyszerű
nagymolekula, de bonyolult szerkezetű, általában több részből (alegységből)
álló is (RNP-képződmény). Az RNP-knek fontos szerepe van számos
sejtfolyamatban: génátírás, átfordítódás (fehérjeképzés), génkifejeződés és az
RNS-anyagcsere. Nagyon sokféle ribonuklein-fehérje ismert.
RNP-hely ribonucleoprotein particle a ribonuklein-fehérjék helye, elkülönült
fehérjeszabályozási helyek a sejtben. (→RNS-kötő gomolyok)
RNP-képződmények a ribonuklein-fehérjéknek más fehérjékkel kialakított
tömörülései. Rendszerint több alegységből állnak. Ilyenek: →ribotestecs
(ribosome), telomeráz vault ribonucleoprotein, RNáz P, hnRNP, snRNPs. Néhány
vírus is csupán RNP-képződmény. (→RNS-vírus)
S6-fehérje ribosomal
protein S6, rpS6 (magyarul:
ribotestecs-S6-fehérje, egyszerűen S6-fehérje) ~34 kDa nagyságú, a ribotestecs
40S egységének alapfehérjéje; a tRNS–mRNS kapcsolódási helyének közelében van.
A C-végi szerinjein foszforileződve válik tevékennyé: elősegíti bizonyos mRNS
kötődését, indítva az átfordítást, a fehérjeképződést. Főleg az S6K1 és az S6K2
foszforilezi; mindkettő szükséges az S6-fehérje megfelelő hatékonyságához.
(→ribotestecs)
SS18L1 fehérje (SS18-like protein 1)
(egyéb nevei: SYT homolog 1; calcium-responsive transactivator [UniProt
javaslat]) az SWI–SNF össztes egyik BAF-fajlagos alegysége. Meghatározó az
idegsejtek kromatinjának módosításában, az idegsejtnyúlványok kalciumfüggő
növekedésében és agyi elágazásában. A CREB-kötő fehérjét (CREBBP; CREB-binding
protein) kapcsolja a magtestecshez.
Az SS18L1 gén (egyébnevei: CREST, KIAA0693) kódolja. A
gén a 20-as kromoszómában van, hibája összefügg az amyotrophic lateral
sclerosis kialakulásával. (→SWI–SNF össztes)
SSXT fehérje (
synovial
sarcoma
translocated
to
X chromosome protein)
a SWI–SNF össztes egyik alegysége. Más néven protein SYT. Az SS18 (egyéb nevei:
SSXT, SYT) gén kódolja, amelyik a 18-as kromoszómában van. Az X és a 18-as
kromoszóma áthelyeződése: t(X;18)(p11.2;q11.2) az ízületi savóshártya
szarkómáinak (synovial sarcoma) ~90%-ban van jelen. Az áthelyeződés
génegyesülést hoz létre; a közös termék az SSXT-SSX1 vagy SSXT-SSX2
valószínűleg kórosan módosítja a kromatint. (→SWI–SNF össztes)
SUMO fehérje (
Small
Ubiquitin-like
Modifier protein) az ubikvitinhez
hasonló szerkezetű, de más összetételű kis fehérje, az ubikvitinszerű fehérjék
(ubiquitin-like proteins) családjának tagja. Az ubikvitinhez hasonlóan kötődik
más fehérje N-végi lizinjének az ε-aminocsoportjával izopeptid kötéssel három
enzim (E1, e2 és E3) segítségével (→ubikvitinezés). Fehérjékhez kötődve, vagy
azoktól elválva befolyásolja az adott fehérje működését. Részt vesz számos
sejtfolyamatban, pl. mag–plazma szállítás, átíródás, sejtvégzet), a
legjelentősebb a fehérjebontás. A fehérjéhez kötődését SUMO-lezésnek
(sumoylation) nevezzük.
UAP56 fehérje (Egyéb
nevek: BAT1, DDX39A) ATP-függő
RNS-helikáz, de ATPáz működése is van; a DExD/H-doboz fehérjék tagja. (→eIF4E) A
DDX39A (DExD-Box Helicase 39B) gén
kódolja, amely a 6-os kromoszómán van.
ATP-kötő,
RNS-helikáz gomolya van és Q-mintázata, az utóbbi a ki-bekapcsolója az ATP
gomolynak, és a helikázt is szabályozza. Lényeges szerepe van a
közteskivágásban, az RNS-szike egyik eleme, az elő-mRNS-t bontja. Alapvető az mRNS-nek
és a gyűrűs RNS-eknek a magból plazmába való szállításában.

 A legkisebb fehérjékben egy gomoly van, a nagyokban
akár száz is lehet. A magasabb rendű szervezetekben a fehérjék rendszerint több
gomolyt tartalmaznak jól elkülönülve; szokásosan más-más feladattal, például az
egyikkel kapcsolódik, a másik a feladatát hajtja végre. (Az ábrán a
háromgomolyos piruvát-kináz látható; forrás: Wikipédia.) Számos gomoly többféle
fehérjében is megtalálható; ezek működése különböző lehet. Vannak több egyforma
gomolyt tartalmazó fehérjék is.
A legkisebb fehérjékben egy gomoly van, a nagyokban
akár száz is lehet. A magasabb rendű szervezetekben a fehérjék rendszerint több
gomolyt tartalmaznak jól elkülönülve; szokásosan más-más feladattal, például az
egyikkel kapcsolódik, a másik a feladatát hajtja végre. (Az ábrán a
háromgomolyos piruvát-kináz látható; forrás: Wikipédia.) Számos gomoly többféle
fehérjében is megtalálható; ezek működése különböző lehet. Vannak több egyforma
gomolyt tartalmazó fehérjék is.
 ■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg.
■ α-csavarodás (α-helix) a
peptidlánc csavarvonalszerű elfordulásával keletkezik. Egy menetben 3,6
aminosav-maradék van. A peptidkötések közötti hidrogénhidak szabályos
távolságonként ismétlődnek – minden negyedik peptidkötést kapcsolják a
karbonil- és az NH-csoport között (CO…NH) –, és a molekula hossztengelyével
csaknem párhuzamosan helyezkednek el; ezért keletkezik a csavarvonal szerkezet.
Az aminosavak oldalláncai a hossztengelyre merőlegesen, a csavarmenet külső
felszínén találhatók, a víztaszító gerinc pedig a belsejében. Az órajárás
irányában haladó elfordulások hozzák létre az α-csavarodást, amely állandósult
szerkezet. Ez az aminosavak L-téralakzatából következik. A csavarodás
végbemehet ellenkező irányban is, de az ilyen szerkezetek ingatagok: az
oldalláncok térben nehezen férnek el, ezért nem is maradnak meg. Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik.
Az első ábrán a két β-szál egymással ellentétes irányú
(antiparallel). A közöttük keletkező hidrogénhíd a szemben lévő peptidkötések
mindegyikében kialakul, éspedig a hossztengelyére merőlegesen, mivel a CO- és
NH-csoportok szemben vannak egymással. Az oldalláncok kívül helyezkednek el. A
második ábrán a megnyúlt polipeptidlánc (β-szál) visszakanyarodik (β-fordulás,
β-turn), és az előző szakaszával azonos irányú (parallel). A hidrogénhidak itt
is keresztezik a hossztengelyt, de nem merőlegesek. Egy aminosav két szemközti
aminosavval kapcsolódik. ■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.
■ β-fordulás* (β-turn, β-reverse turn, β-bend). A polipeptid egyirányú, ezért gömbalakot csak úgy hozhat
létre, hogy visszafordul. Az ilyen visszafordulás a β-fordulás, amely nagyon
rövid szakasz, hajtűszerű. Ezek kapcsolnak össze két α-csavart vagy két
β-szálat. A β-fordulat négy aminosav-maradékból áll. A hidrogénhíd a polipeptid
visszafordulását kezdő és a harmadik aminosavát köti; ezzel rögzíti a
szerkezetet (az ábrán pirossal jelölve; R = oldallánc). I-es és II-es formáját
különböztetik meg. A β-fordulás sokszor a fehérje felszínén van, részt vesz a jelközvetítésekben
kapcsolódási vagy felismerési helyként.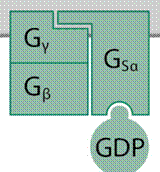
 Az 5’-végi
lebenyben az N (N terminal) és a PAZ (PIWIArgonaute-Zwille) gomoly van;
ezeket az L1 (linker 1) köti össze. A 3’-végi lebeny belső oldalán a MID (middle),
mellette a 3’-véget alkotó PIWI gomoly található. A két lebenyt az L2 kapcsolja
egybe. A MID és a PIWI gomoly között van 5’-végi nukleotidkötő zseb* (5′ nucleotide-binding pocket); ez szorosan köti az RNS
vezetőszálának 5’-végi nukleotidját. A PAZ gomoly a vezetőszál 3’-végét köti. A
PIWI gomoly pedig hasítja a kétszálú RNS-nek a kapcsolódási hellyel szembeni
kiegészítő szálát. Az N gomoly választja szét a két szálat, és irányítja a PIWI
gomolyt. (→
Az 5’-végi
lebenyben az N (N terminal) és a PAZ (PIWIArgonaute-Zwille) gomoly van;
ezeket az L1 (linker 1) köti össze. A 3’-végi lebeny belső oldalán a MID (middle),
mellette a 3’-véget alkotó PIWI gomoly található. A két lebenyt az L2 kapcsolja
egybe. A MID és a PIWI gomoly között van 5’-végi nukleotidkötő zseb* (5′ nucleotide-binding pocket); ez szorosan köti az RNS
vezetőszálának 5’-végi nukleotidját. A PAZ gomoly a vezetőszál 3’-végét köti. A
PIWI gomoly pedig hasítja a kétszálú RNS-nek a kapcsolódási hellyel szembeni
kiegészítő szálát. Az N gomoly választja szét a két szálat, és irányítja a PIWI
gomolyt. (→ A 7TM-fehérjék a külső és belső felszínen hurkokkal
összekapcsolt hét sejthártyán áthaladó α-csavarulattal rögzülnek a
sejthártyában; ezen kívül a polipeptid lánc mindkét vége is hurkot formál - az
N-vég a sejten kívül, míg a C-vég a sejten belül található. A sejthártyán
kívüli rész köti a jelvivőt, a sejtbe nyúló hurkok közül kettő pedig a
háromalegységes G-fehérje α-alegységét; ez utóbbi esemény általában akkor
következik be, amikor a jelfogó gerjesztődik a jelvivő hatására, de az is
előfordul, hogy a G-fehérje a jelfogó tevőtlen állapotában is hozzá kapcsolt..
(Az ábrát Teleki Katalin készítette.)
A 7TM-fehérjék a külső és belső felszínen hurkokkal
összekapcsolt hét sejthártyán áthaladó α-csavarulattal rögzülnek a
sejthártyában; ezen kívül a polipeptid lánc mindkét vége is hurkot formál - az
N-vég a sejten kívül, míg a C-vég a sejten belül található. A sejthártyán
kívüli rész köti a jelvivőt, a sejtbe nyúló hurkok közül kettő pedig a
háromalegységes G-fehérje α-alegységét; ez utóbbi esemény általában akkor
következik be, amikor a jelfogó gerjesztődik a jelvivő hatására, de az is
előfordul, hogy a G-fehérje a jelfogó tevőtlen állapotában is hozzá kapcsolt..
(Az ábrát Teleki Katalin készítette.)