acetilezés acetylation
acetilcsoport hozzáadása a molekulához, pl. a hisztonok acetilezése a
génátíródás egyik meghatározó szabályozója. Az acetiláz, más néven transzacetiláz
végzi. (→acetiláz, acetilcsoport, hiszton)
dezacetilezés deacetylation acetilcsoport elvonása a
molekulából; a deacetiláz végzi. Pl. a hisztonok dezacetilezése tömöríti a
kromatint, gátolja a génátíródást.
állapotjellemző, állapotfüggvény state function, point function
(az állapotjellemzőt állapotjelzőnek, állapothatározónak mondják, de az
állapotjellemző elnevezés pontosabban fejezi ki a fogalmat) az anyagnak/rendszernek
olyan mérhető mutatója, amellyel meghatározható a rendszer sajátossága, és csak
az anyag/rendszer kezdeti és végállapotától függ. Független a rendszer átmeneti
útvonalától, vagyis attól, hogy a rendszer miként jutott a végállapotába.
Vannak egyszerű állapotjellemzők, mint a
hőmérséklet (T), a nyomás (p), a térfogat (V), az anyag mennyisége (n), a tömeg
(m). Ezek között megkülönböztetünk:
▪ Kiegyenlítődő állapotjellemzőt (intenzív
állapotjelző), amely független a rendszertől (kiegyenlítődő mennyiség).
Ilyen a nyomás és a hőmérséklet. Például ha kétféle hőmérsékletű és/vagy
kétféle nyomású folyadékot elegyítünk, azok hőmérséklete és nyomása is
kiegyenlítődik; független a folyadék mennyiségétől.
▪ Összeadódó állapotjellemzőt (extenzív
állapotjelző), amely függ a rendszertől (összeadódó mennyiség), például
térfogat: ha egy edényben lévő folyadékhoz öntünk még folyadékot, nagyobb lesz
a térfogata; annyival, amennyit adunk hozzá.
Vannak az egyszerű állapotjellemzőkből számítással
levezethető függvények, mint a rendezetlenség (S), a belső energia (U), az
energiatartalom (H), a szabad energiatartalom (G). Megkülönböztetésül ezeket állapotfüggvényeknek
nevezzük. A rendszer egyensúlyi állapotát írják le.
Például belső energia csakis a rendszer pillanatnyi
nyomásától, hőmérsékletétől, összetevőitől és anyagtömegétől függ. Ekként
valamely 25 °C-os, 100 kP nyomású, 1 mol NaCl-t és 50 mol vizet tartalmazó
oldat belső energiája azonos bármely más azonos oldat belső energiájával,
függetlenül attól, hogy a NaCl-t vízben oldottuk, sósavval elegyítettük vagy
valamilyen más módon hoztuk létre.
Bármely
állapotjellemző megváltozása együtt jár legalább egy másik állapotjellemző
megváltozásával. (→vegyfolyamat-állapot)
aminosavak tevősödése amino
acid activation (más néven: aminoacylation, tRNA charging) az
aminosav és a tRNS kapcsolódása. (→szállító RNS – aminosav kapcsolódás)
amplifikáció amplification többesedés valamely molekula, DNS elem, például
géntöbbesedés, részecske stb. sokszorozódása (számbeli növekedése). (→génkifejeződés)
androgénérzéketlenség androgen insensitivity
syndrome, AIS; testicular feminization X-kromoszómához kötött, lappangó
öröklődésű nemi szervi fejlődési rendellenesség, amelyben a 46 XY kromoszóma szerkezetű férfinek külső női nemi
szervei vannak. (A régi nevét: testicular feminization syndrome,
magyarul herés nőiesedés*, már nem használjuk.) Egyéb jellegzetességek:
▪ A hüvely vakon végződik; lehet csaknem teljes
hosszúságú, általában rövidebb, és egészen csekély is.
▪
Nincs méh.
▪ A belső nemi szervek férfiasak. A herék
szabályosan kifejlődtek, de a hasüregben, ritkán a lágyékcsatornában vannak.
Előfordulnak a nagyajkakban is. Harminc százalékban rosszindulatúan elfajulnak,
feltehetően, mert a szabályos sejtkörnyezetük nem fejlődött ki.
Nagyon ritka betegség (60 000 szülésre esik
egy). Három formáját különböztetik meg: a teljes érzéketlenségűt (complete AIS,
CAIS), a részleges (partial AIS, PAIS) és enyhe érzéketlenségűt (mild AIS,
MAIS).
▪ A teljes androgénérzéketlenségben, amely
messze a leggyakoribb (ha androgénérzéketlenségről beszélünk, általában ezt
értjük rajta), a külső nemi szervek teljesen nőiesek.
▪ A részlegesben valamelyik (a női vagy a
férfi) külső nemi szerv túlsúlyban van, de lehetnek kettősök is.
▪ Az enyhe formában
inkább férfias, de nagyon fejletlen.
Oka
az androgénjelfogó érzéketlensége a jelvivőjével (tesztoszteron,
dihidrotesztoszeron, DHT) szemben. A jelfogó egyáltalán nem, avagy csak
kismértékben köti a jelfogót. Az androgénjelfogót az X-kromoszóma hosszú
karjának 12-es sávjában (Xq12) lévő gén (AR (androgen
receptor) gén) kódolja, melynek gyakori a másulása, ötszáznál is több ismert.
Hetven százalékukat anyai öröklődésűnek tartják, és csak 30% keletkezik
újonnan. Azok okozzák ezt a betegséget, amelyek akadályozzák az androgén
jelfogót, hogy kötődjön a tesztoszteronnal vagy a dihirotesztoszteronnal. Az ép
herék megfelelően képezik a tesztoszteront és a dihidrotesztoszeron, de a
férfiasodás elmarad, mert a jelfogó nem köti meg őket.
A
Müller-cső kifejlődése hiányos, a herék elnyomják: a Sertolli-sejtekben az AMH
(anti Müller-hormon) szabályosan termelődik, és elfojtja Müller-csövek
kialakulását, azok felszívódnak.
A szérum ösztrogénszintje szabályos, hasonló a nők
ösztrogénszintjéhez. Ösztrogén tehát bőven termelődik az androgének ösztrogénné
alakításának következményeként (aromatization). Hatására az emlők kifejlődnek,
a zsírszövet és minden más külső megjelenés női irányú.
Rendszerint serdülőkorban ismerjük fel elsődleges
havibajhiány, görcsök miatti vizsgálatkor. Ritkán gondos újszülött- vagy gyermekkori
vizsgálat már korában fényt deríthet rá. Ennek nagy a jelentősége, főként a
lelki előkészítés miatt. Gyakori a lágyéki sérv, amely a serdülőkor előtt
egyébként ritka – ez felkeltheti a gyanúját.
A
nemi szervek férfiasodása az ébrényi élet 8–14 hetében zajlik, AIS-ben
tökéletlenül.
antigénfedés* opsonisation (opszonizáció) kórokozók vagy elhalt sejtek antigénjeinek fedése
ellenanyagokkal (IgM, IgG1, IgG3) vagy komplementtöredékekkel (C3b, C3d és C4b)
jelölésre a sejtfaló sejtek számára. Az ellenanyag/komplementtöredék az
antigén-meghatározóhoz (epitope) kötődik, lehetővé téve, hogy kapcsolódjék a
falósejt jelfogójával. Az immunsejtek (falósejtek), az elhalt sejtek és a
kórokozók sejtfelszíne is negatív töltésű, ezért ezek taszítják egymást. Az
antigénfedés ezt a taszítóhatást hidalja át.
áramingerület* action potential (akciós potenciál)
(→töltésingerület)
arány proportion, rate
két szám/mennyiség viszonya, hányadosa, pl. 4 : 2 arányban; a hányados = 2,
vagyis kétszeres arányban.
ARF (ADP-ribosylation factor) 20 kDa nagyságú szabályozó GTPáz. Sokféle van, fehérjecsaládot alkot.
Az ARF fehérjéket az aminosavak sorrendje szerint 3 osztályba soroljuk: az 1-es
osztályba az ARF1 és az ARF3 tartozik – 95%-ban azonos szerkezetűek. A kettesbe
az ARF4 és az ARF5 – 90%-ban azonosak; 80%-ban az 1-es osztályba tartozókkal. A
harmadik csak ARF6-ból áll, ez 50–70%-ban azonos a többivel. Az ARF fehérjék a
hólyagcsás szállításban meghatározók, a burokfehérjéket (coat proteins)
toborozzák a hártyához, de van más szerepük is, pl. részt vesznek a
jelátvitelben.
ASCL1 (achaete-scute family bHLH transcription factor 1) csavarodás-hurok-csavarodás mintázatú (basic
helix-loop-helix, bHLH) átírásfehérje; amely az E-dobozhoz kötődve serkenti az
átíródást. Képződik az agyban, gyomorban és a légutakban is. Az ASCL1 gén
kódolja. A gén a 12-es kromoszómán van; másulása közrejátszik a congenital
central hypoventilation syndrome (CCHS) kialakulásában.
átcserélés* transversion
a genetikában purinbázis helyettesítése pirimidinbázissal és fordítva.
átfordítás translation (transzláció)
az mRNS polipeptiddé alakítása.
átfordítási
olvasáskeret translational reading frame (→olvasáskeret)
átfordításkövető
módosítás post-translational
modification az mRNS átfordításából
keletkezett eredetfehérje módosítása. (→fehérjemódosítás)
átírás transcription (→génátírás)
átírásfehérje* transcription factor (TF) a DNS-hez vagy
RNS-hez kötődő, azok működését szabályozó fehérje.
■ A DNS-hez kapcsolódó átírásfehérje a gének átíródását
irányítja (ki-bekapcsolás, fokozás, gátlás): kapcsolja a polimerázt a DNS-hez,
és kölcsönhatásban áll a szabályozó fehérjékkel. Leginkább az indítóhoz és egy
szabályozó DNS-szakaszhoz, pl. az fokozóhoz fűződik. Egyféle átírásfehérje
több, rendre azonos feladatot ellátó génhez is kapcsolódhat.
Jellegzetessége, hogy legalább egy
sarkalló- (DNA activation domain) és egy DNS-kötő gomolya (DNA-binding domain,
DBD) van. Az utóbbi fajlagosan fűződik a DNS (a szabályozandó gén) 8–20
bázisnyi törzsökös mintázatához (sequence-specific DNA-binding factor), amely
az indítómagban van. A sarkallógomolyok szerkezete viszont egyszerű, ezért
ezeket az aminosavak elosztása szerint jellemzik, megkülönböztetve prolin-,
szerin/treonin, glutamingazdag stb. gomolyokat.
Az átírásfehérjék biztosítják, hogy a
gének átíródása a megfelelő sejtben, időben és mértékben menjen végbe.
Nagyjából 2600-féle ismert; csoportosításuk a DNS-kapcsolódási gomolyuk
szerinti, pl. cinkujj mintázati átírásfehérje. (→gomolyok) Az emberi DNS-ben
~2000 átírásfehérje által irányított gén van. Az átírásfehérjék zöme csak a
célgénhez kapcsolódhat: az indítóhoz általános, a szabályozó
bázissorokhoz sajátos átírásfehérjék társulnak. Azonban van olyan is, amely
képes a magtestecskén lévő DNS-hez kötődni (úttörő átírásfehérje*).
általános átírásfehérje* general transcription factor, GTF (más néven:
alapvető átírásfehérje, basal transcription factor) az indítómag fajlagos
mintázatához kötődő, a polimerázt toborzó és az RNS képzést a megfelelő helyen
indító átírásfehérje. Pl. az RNS-polimeráz-2 általános átírásfehérjéi a TFIIa,
TFIIb, TFIId, TFIIe, TFIIf és a TFIIh.
úttörő átírásfehérje* pioneer factor a magtestecskén lévő
DNS-sel kapcsolódó átírásfehérje. Ezeknek a fehérjéknek sajátos adottsága, hogy
a néma, kromatinba ágyazott génekkel képesek kapcsolódni, és azokat beindítani,
szerkezeti változásokat kiváltva a kromatinban. A törzsfejlődésben, a sejtek
átalakításában van szerepük.
■ Az RNS-hez kapcsolódó átírásfehérje sajátsága az
RNS-kötő gomoly.
Az
átírásfehérjét szokásosan TF-fel jelöljük, ezután római számmal az általa
kapcsolt polimeráz fajtáját írjuk. Például: TFII (a polimeráz-II-t kötő
átírásfehérje [RNAP2; RNA polimerase 2]), TFIII (a polimeráz-III-at kötő
átírásfehérje [RNAP3]). Ezek változatait tartozékbetűkkel azonosítjuk (TFIIb, TFIId, TFIIe, TFIIf,
TFIIh, TFIIIa).
átírásirányítás* epigenetics a gének átírásának olyan
módosítása, amelyik a bázissorrend megváltoztatása (DNS-másulás) nélkül valósul
meg; a kromatin vagy DNS módosításának a következménye. Ilyen módosítások a
DNS/hiszton metilezés, a hisztonok acetilezése, foszforilezése, ubikvitinezése
stb., az RNS módosítása és a nem kódoló RNS-ek (ncRNS-ek) kifejeződése. A
módosításokat sejtenzimek sarkallják, és a társátírók (cofactors) ismerik fel.
A kromatint/DNS-t módosító sejtfolyamatok egy része a sejtek örökletes
tulajdonságai közé tartozik.
állapotszabályozásLM epigenetic
regulation a DNS-működés szabályozása
a kromatin, a DNS és a hozzá kapcsolódó fehérjék állapotán keresztül. Ezek a
szabályozóelemek (molekulák, folyamatok) (trans-acting regulatory elements,
TREs; epigenetic regulators) nem változtatják meg a DNS bázissorát. Ilyenek: a
DNS-metilezés, a hisztonmódosítás, az RNS-módosítás, az ncRNS-képződés.
Az állapotszabályozás a gének
ki-bekapcsolását, az átíródás mértékét irányítja; tágabb értelemben a gének
kifejeződését, amely az egyedségben is megnyilvánul; de mindezt nem az adott
gén szabályozó részének bázissorrendje alapján.
Meghatározó az egyed- és törzsfejlődésben,
a sejtek elkülönülésében, a sejtvégzetben és az X-kromoszóma némításában is,
továbbá a szöveti fajlagosságban: nevezetesen, hogy valamely szövetféleségben
mely gének kapcsolódnak be, illetve ki, melyek szorulnak háttérbe. Az
állapotszabályozást a környezeti hatások (táplálkozás, mozgás, idegállapot,
anyai hatások stb.) is irányíthatják. Ez a szabályozás biztosítja a sejtek
alkalmazkodását a környezeti viszonyokhoz, határozza meg a környezeti hatásokra
adott sejtválaszt. Az ilyen formájú állapotszabályozást nevezhetjük környezeti
szabályozásnak is.
átíráskezdethely transcription
start site, TSS (→indító)
átíráskövető
módosítás, szabályozás post-transcriptional
modification/regulation
átíróegység transcription
unit a gének átíródását végző
fehérjék: átírásfehérjéből és a polimerázból áll. (→génátírás, génátírási folyamat)
átváltás* transition a genetikában purinbázis helyettesítése
purinbázissal, illetőleg pirimidinbázis helyettesítése pirimidinbázissal. A
purin–purin, pirimidin–pirimidin átváltás aminocsoport eltávolításával jön
létre; így keletkezik uracil a citozinból, hipoxantin az adeninből stb. Az
átváltás génhiba.
bázispárcsere* single
nucleotide variation, SNV egyetlen bázispár cserélődése másik illeszkedő
bázispárra a DNS bázissorában. Lehet bázishasonló*, amikor purinbázis
cserélődik purinbázisra, illetőleg pirimidinbázis pirimidinbázisa; és lehet
báziselütő*: purinbázis–pirimidinbázis csere. A cserélődött bázis kiegészül az
illeszkedő párjával. A bázispárcsere a DNS bármely részén előfordul; leginkább
a gének között, de a gének kódoló (1 százalék) és nem kódoló részében is.
Különösen gyakori az ismétletekben. A bázispárcseréből alakult bázissor a bázispárcserés
változat (single nucleotide variant, SNV).
A
kódoló szakaszban lévő bázispárcseréből keletkező fehérje (aminosavsor) formája
szerint háromféle ismert:
azonaminosavas párcsere* synonymous
mutation (nevezik single amino acid samesense change-nek is) olyan
báziscserélődés, amely nem változtatja meg a fehérje aminosavait. Keletkezhet
ugyanis olyan bázishármas, amelyik ugyanazt az aminosavat kódolja, például
GTT>GTC változás; mindkettő valint kódol. Az emberi DNS-ben ugyanis 64
bázishármas kódol 20 aminosavat, azaz egy-egy aminosavat több bázishármas is
képezhet. Ezt a jelenséget a nemzetközi irodalom degeneracy of genetic code-nak
nevezi, magyarul génkódbőségnek* mondhatjuk. A polipeptid képződése vagy
alakulása azonban módosulhat, például változhat az átíródás, átfordítódás
üteme, a közteskivágás stb., ezért az egyedségben valamilyen módon
megnyilvánul.
néma azonaminosavas párcsere* silent mutation
(néma másulás, néma mutáció) olyan aminosav-változást nem okozó egyetlen
bázispár-cserélődés, amely az egyedségben jóformán nem nyilvánul meg. A polipeptidlánc
képződése és további alakulása változatlan.
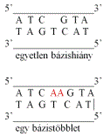
 egy aminosavas párcsere* missense mutation, non-synonymous mutation (más néven single amino acid missense change,
missense mutation) egyetlen aminosavcserét okozó
bázispár-cserélődés: a polipeptidlánc egyik aminosavának helyére másik épül be.
Szabálytalanul (másként) működő vagy nem működő fehérje keletkezik. Az ábrán a
prolint, a glicint és a tirozint kódoló bázishármas látható. A TA bázispár
cserélődik GC-re, aminek következtében nem tirozint, hanem szerint kódoló
bázishármas alakul ki az mRNS-en. A keletkező fehérjében egy tirozin helyett
szerin lesz. A polipeptid további képződése változatlanul folytatódik.
Összetételében más fehérje keletkezik, de az aminosavsor és a fehérje hossza
sem változik. A létrejövő fehérje működése megváltozhat, változhat a szerkezete
is. Ez elsősorban attól függ, hogy milyen aminosav cserélődik: ha lényegesen
más tulajdonságú épül be, mint az eredeti, nagyobb zavar keletkezhet a fehérje
működésében.
egy aminosavas párcsere* missense mutation, non-synonymous mutation (más néven single amino acid missense change,
missense mutation) egyetlen aminosavcserét okozó
bázispár-cserélődés: a polipeptidlánc egyik aminosavának helyére másik épül be.
Szabálytalanul (másként) működő vagy nem működő fehérje keletkezik. Az ábrán a
prolint, a glicint és a tirozint kódoló bázishármas látható. A TA bázispár
cserélődik GC-re, aminek következtében nem tirozint, hanem szerint kódoló
bázishármas alakul ki az mRNS-en. A keletkező fehérjében egy tirozin helyett
szerin lesz. A polipeptid további képződése változatlanul folytatódik.
Összetételében más fehérje keletkezik, de az aminosavsor és a fehérje hossza
sem változik. A létrejövő fehérje működése megváltozhat, változhat a szerkezete
is. Ez elsősorban attól függ, hogy milyen aminosav cserélődik: ha lényegesen
más tulajdonságú épül be, mint az eredeti, nagyobb zavar keletkezhet a fehérje
működésében.
 záróhármashiba* nonsense mutation záró bázishármas* (stop
codon) kialakulásához vezető egyetlen bázispár cserélődése, amelynek
következtében csonkfehérje* (truncated protein) keletkezik. A fehérje egy része
hiányzik, és általában nem működik. Szerkezete attól függ, hogy a báziscsere
következtében melyik bázishármas alakul záróvá. Az ábrán a prolint, a glicint
és a tirozint kódoló bázishármas látható. A GC bázispár csrélődik CG-re, aminek
következtében nem tirozint kódoló hármas, hanem záróhármas (UAG) keletkezik az
mRNS-en, és az átfordítódás idő előtt befejeződik, hiányos fehérje jön létre.
záróhármashiba* nonsense mutation záró bázishármas* (stop
codon) kialakulásához vezető egyetlen bázispár cserélődése, amelynek
következtében csonkfehérje* (truncated protein) keletkezik. A fehérje egy része
hiányzik, és általában nem működik. Szerkezete attól függ, hogy a báziscsere
következtében melyik bázishármas alakul záróvá. Az ábrán a prolint, a glicint
és a tirozint kódoló bázishármas látható. A GC bázispár csrélődik CG-re, aminek
következtében nem tirozint kódoló hármas, hanem záróhármas (UAG) keletkezik az
mRNS-en, és az átfordítódás idő előtt befejeződik, hiányos fehérje jön létre.
A nem kódoló DNS-szakaszon lévő
bázispácsere szintén befolyásolhatja a fehérjeképződést: hatással lehet a
mRNS-re, a nem kódoló RNS-re, az átírásfehérje kapcsolódására, az átfordításra
és a közteskivágásra is.
Az egy aminosavas párcserét és a záróhármashibát közös néven másaminosavas párcserének (nonsynonymous SNV) nevezzük.
bázistöbblet*, bázisvesztés* insertion, deletion. Általános
értelmezésben a bázistöbblet* egy vagy több bázis (pontosabban nukleotid)
beékelődése, a bázisvesztés* egy vagy több bázis (nukleotid) törlődése.
Előfordulhat a DNS bármely részén; gyakori az ismétletekben.
Ha beékelődik vagy törlődik egy vagy több bázis (nukleotid), a DNS-szál hurokszerűen
kiboltosodik; ezt nevezzük beékelődési/törlődési huroknak* (insertion–deletion loop,
IDL).
A bázistöbbletnek/bázisvesztésnek három formája ismert: a kereteltolódás, az INDEL
(bázistöbblet/bázisvesztés*) és a szakaszkettőződés.
 ▪ Kereteltolódás*
(frameshift mutation) az
olvasáskeretnek egyetlen bázis beékelődése vagy kiesése miatti olyan másulása,
amelyben megváltozik az aminosavat kódoló bázishármasok sorrendje. Teljesen más
fehérje keletkezik, amely nyilvánvalóan nem alkalmas az eredeti fehérje
feladatának ellátására. Az ábra felső részén öt CAT bázishármas látható; öt
hisztidin keletkezik, és képződik tovább a polipeptid. Az alsó bázissorban a
második hármas után beékelődik egy adenin (A), és teljesen átalakul az
olvasáskeret: megváltoznak a bázishármasok. A harmadik hármas treonint, a
negyedik és ötödik szerint képez és így tovább. A képződő fehérje szerkezete
tehát egészen más lesz.
▪ Kereteltolódás*
(frameshift mutation) az
olvasáskeretnek egyetlen bázis beékelődése vagy kiesése miatti olyan másulása,
amelyben megváltozik az aminosavat kódoló bázishármasok sorrendje. Teljesen más
fehérje keletkezik, amely nyilvánvalóan nem alkalmas az eredeti fehérje
feladatának ellátására. Az ábra felső részén öt CAT bázishármas látható; öt
hisztidin keletkezik, és képződik tovább a polipeptid. Az alsó bázissorban a
második hármas után beékelődik egy adenin (A), és teljesen átalakul az
olvasáskeret: megváltoznak a bázishármasok. A harmadik hármas treonint, a
negyedik és ötödik szerint képez és így tovább. A képződő fehérje szerkezete
tehát egészen más lesz.
 ▪ INDEL (
in = insertion,
del
= deletion) magyarul bázistöbblet/bázisvesztés*, de egységesség kedvéért
az INDEL szóösszevonást alkalmazzuk. Megegyezés szerint az INDEL legtöbb 1 kb
hosszúságú (1–1000 bázispár) bázistöbblet/bázisvesztés. Helytelen rövid/hosszú
többletről/vesztésről (small/large indel) beszélni, mert a fogalom jelentése
szerzők szerint nagyon is eltérő. Ha szükséges, pontosítani kell a
törlődött/beékelődött bázisok számát. Az egyetlen bázispár
beékelődése/törlődése pontmásulás. Egyik formája a kereteltolódás. A bázisok
százait tartalmazó beékelődéseket/törlődéseket, például kromoszómaáthelyeződés/kromoszómamegfordulás,
szintén INDEL-nek nevezzük, mert nem külön másulási forma.
▪ INDEL (
in = insertion,
del
= deletion) magyarul bázistöbblet/bázisvesztés*, de egységesség kedvéért
az INDEL szóösszevonást alkalmazzuk. Megegyezés szerint az INDEL legtöbb 1 kb
hosszúságú (1–1000 bázispár) bázistöbblet/bázisvesztés. Helytelen rövid/hosszú
többletről/vesztésről (small/large indel) beszélni, mert a fogalom jelentése
szerzők szerint nagyon is eltérő. Ha szükséges, pontosítani kell a
törlődött/beékelődött bázisok számát. Az egyetlen bázispár
beékelődése/törlődése pontmásulás. Egyik formája a kereteltolódás. A bázisok
százait tartalmazó beékelődéseket/törlődéseket, például kromoszómaáthelyeződés/kromoszómamegfordulás,
szintén INDEL-nek nevezzük, mert nem külön másulási forma.
Bázistöbblet/bázisvesztés előfordul az olvasáskeretben
az olvasáskeret eltolódása nélkül is. Ezt a nemzetközi irodalom in frame
insertion/deletion nevezettel illeti. Magyarul: keretmegtartó
többlet/vesztés* Három vagy hárommal osztható bázisok többletével vagy
törlődésével jön létre. Például: három bázis kiesése egy aminosav vesztésével
jár, a további kódoló hármasok azonban változatlanul megmaradnak, nem tolódik
el az olvasáskeret.
INDEL többféleképpen
keletkezhet: lehet DNS-károsodás (sugárhatás stb.) következménye, de
kialakulhat a DNS-polimeráz hibájából (szálcsúszás), avagy téves, nem megfelelő
DNS-javítás miatt.
▪ Szakaszkettőződés* általában 1–200 kb nagyságú DNS-rész egynél többszöri előfordulása a
DNS-ben; a DNS bármely elemét tartalmazhatja. Az eredeti és az ismétlődő
szakasz szerkezete >90 százalékban azonos. A szakaszkettőződés az emberi DNS
~5 százalékában fordul elő. A kettőződött szakaszok hajlamosak újabb
ismétlődésekre, szerkezeti átalakulásokat eredményezve, amelyek a kromoszómákon
sokszor jól felismerhetők, sőt jelentősen megnyújthatják a kromoszómát. Ha az
ismétlődő részben gén is van, két, több egyazon génje is lehet az egyébként
egészséges embernek. Ám ha a gén tevékenysége fokozódik (gene dosage imbalance)
a gének többlete miatt (mennyiségérzékeny gén), betegség keletkezhet.
~60 000-féle szakaszkettőződés ismert. Nagyságrendje miatt a
szakaszkettőződés a DNS-nek méretesebb eltérése, mint az egynukleotidos
sokalakúság összessége.
A szakaszismétlődés a génkifejlődés, új gének
keletkezésének alapja, például a törzsfejlődésben vagy a környezeti
alkalmazkodás folyamataiban. A kettőződés következtében rendelkezésre áll
bázissor, amelyből új gén keletkezhet, például úgy, hogy szabályozó részek is
másolódhatnak, és alakíthatják a bázissort, vagy a nem válzati kereszteződések
(non-allelic homologous recombination) folyamatában. A bázissor átalakulása
szakaszos, az új gén több ismétlődésben jön létre. Nemrégiben felismert
szakaszismétlődésből keletkezett új gén az ARHGAP11B és a SRGAP2C; ezeknek az
agykéreg és a gerincvelői idegek fejlődésében van szerepük.
A kettőződött, többszöröződött szakaszok egymás után
ismétlődnek, ezért az ismétletek közé is sorolják őket (low copy repeats). Az
ismétletektől azonban lényegileg különböznek, szoros értelemben nem tartoznak
közéjük.
A bázistöbblet/bázisvesztés vizsgálata nemcsak a laboratóriumi
módszerekben jelentős, hanem az orvosi gyakorlatban is: örökletes vagy szerzett
betegség megkülönböztetésében, avagy egyes betegségek kórismézésében, például
háromnukleotidos ismétlettöbblet bántalom (trinucleotide repeat expansion
diseases), valamint kezelésben, kórjóslatban, például Lynch-kór.
BCR fehérje breakpoint cluster
region protein, BCR, más néven: renal
carcinoma antigen NY-REN-26szerin-tirozin-kináz; a BCR gén kódolja.
A BCR gén a 9-es kromoszóma hosszú karján van (9q34); egyike a BCR-ABL1 felemás
génnek, amely a Philadrlphia-kromoszómán van. Tevékenysége részben ismert; a
GTPázokrho-családjának (rhoA) guanin-nukleotid cserélő tényezője.
beékelődés–vesztés hurok* insertion–deletion loop, IDL a leány (másolódó) DNS-szál
rövid (<20 bázisnyi) hurokszerű kiboltosulása hibás DNS-másolódásban. Az 1–3 bázispárnyi beékelődésekor vagy kilökődéskor
keletkező hurkot kis, a 4-nél több bázispárnyinál keletkezőt nagy beékelődés–vesztés
huroknak nevezzük. Oka a polimeráz kisiklása, pl. ismétlet miatt, aminek
következtében 1–3 bázis (pontosabban nukleotid)
beékelődik vagy kilökődik. A megváltozott kötésviszonyok miatt a szemben lévő
DNS-szál rövid szakasza is előtüremkedik. Hibafelismerő
hely, a párhibajavító fehérjék (MSH2–MSH6, illetve MSH2–MSH3) ennek alapján
veszik észre a téves másolódást. (→bázis/bázistöbblet)
belső magzatburok amnion a magzat egészét körbevevő
hártya. Először érintkezik a magzat testével, később telődik vízzel. A
várandósság 7–8 hónapjáig a magzatvíz mennyiség szaporodik, az üreg tágul,
igazodva a magzat növekedéséhez. Az utolsó 1- 2 hónapban fogy a mennyisége.
Legfontosabb feladata a magzat védelme, de a magzat anyagcseréjében is van
szerepe. Szabad mozgást enged a magzatnak. Szorosan hozzáfekszik a külső
magzatburokhoz.
A belső
magzatburok először az ébrényben jelenik meg az ébrény hólyagcsírás
állapotában. Az ébrénycsomó felsőbb sejtjei hozzák létre az egysoros
ébrényhámot (amnionsejtek), amely bensőségesen hozzátapad a tápsejtek
belső felszínéhez. Az ébrényhám vizet termel, ezzel alakítja ki az ébrényüreget
(amnionüreg), és azt részben határolja.
bionomy (bionomia) az élet törvényszerűségeinek tudománya.
-bionta valamilyen
módon élő lény. (→szimbionta)
BRCA-másulás visszafordulása* BRCA mutation reversion olyan génmásulás a BRCA1/2 géneken,
amely megszünteti a csírasejtes BRCA-másulás, illetve a BRCAság okozta
HR-hiányos sejteket. Az örökletes BRCA-másulás vagy a szórványos daganatokban
kialakuló BRCAság gátolja a kétszálú DNS-törés helyreállítást, ezért a platina-
és PARP-gátló kezelés igen hatásos a BRCA-függő daganatok gyógyításában; a
platina kettős DNS-törést okoz, a PARP-gátlók pedig az összeadódó sejthalál
következtében. Megfigyelték, hogy ezekben a daganatokban sejtmérgező és/vagy
PARP-gátló kezelés után a BRCA géneken újabb másulások keletkezhetnek több
helyen is. Ezek között van olyan, amely visszaállítja a BRCA fehérjék DNS-hibát
kijavító képességét. Az ilyen másulást nevezzük a BRCA-másulás
visszafordulásának.
burjánzás* proliferation
sokszorozódás hasonló formában (burjánzó proliferative).
kötőszövetes burjánzás fibroplastic proliferation a kötőszövet túlburjánzása szervekben. Különböző
kötőszöveti betegségekben (scleroderma, lupus…) fordul elő.
sejtburjánzás* többé-kevésbé egyforma sejtek növekedésével és
osztódásával végbemenő szöveti gyarapodás.
CDC25 (cell division cycle 25) kettős hatású, tirozin-foszfatáz; a CDK2 tirozin
oldalláncról von el foszfátcsoportot, aminek következtében a CDK2 hatékonnyá
válik (→CDK). Az ATM/ATR, valamint a CHK1 és a CHK2 foszforilezi a szerin
oldalláncain, ami bekapcsolja az ubiquitin fehérjebontást, és a CDC25 lebomlik.
Az E2F fokozza a CDC25 képződését.
CD28 (
clusters of
differentiation 28)
sejtfelszíni jelfogócsalád, hasonló
szerkezetű sejtfelszíni fehérjék. Három gomolyuk (sejtkívüli, sejthártyai,
sejtbeli) van. Jellemző az immunglobulinszerű változó sejtkívüli gomoly sajátos
mintázata; a sejtbeli gomolyban tirozin van. A CD28 a fehérjecsalád alapító
tagja. Egyéb tagjai: ICOS, CTLA4, PD1, PD1H, TIGIT, and BTLA. A B7 fehérjékkel
kapcsolódnak.
CD28 fehérje a T-sejtek felszínén lévő jelfogó; a CD4 T-sejtek ~80,
a CD8 T-sejtek ~50%-án van jelen állandóan. A kifejeződése a korral csökken. Az
alapszintű folyamatos jelenlétük teszi lehetővé a Treg-sejtek állandó
működését, az autoimmunitás kivédését.
A CD28 az éretlen
T-sejtek legfontosabb érője. Az érett T-sejteken meghatározó az IL2 és más
citokinek, továbbá kemokinek képzésében és a T-sejt megmaradásában
(túlélésjelek, BCLxL). Befolyásolja a T-sejt anyagcseréjét, sajátosan
foszforilez, serkenti számos gén átírását, és módosítja az aktinsejtvázat is.
Végeredményben hatása rendkívül szerteágazó.
A B71/2-vel
kötődik a pMHC–TCR társulás hatására, de kapcsolódik a B7H2-vel is. A
sejtplazmai mintázataihoz sokféle fehérje kapcsolódhat (SHIP1, SLP76, GRAP,
CBL, ITK, PI3K, GRB2, GADS, CSK, STS1, PTPN11, VAV3, CIN85, LCK, FLNA, CD2AP),
lehetővé téve számos jelközvetítést.
A CD28 megjelenik a
csontvelősejteken, a neutrofil és az eozinofil fehérvérsejteken, valamint a
plazmasejteken, elősegítve az ellenanyag képződését.
CTLA4 (cytotoxic T-lymphocyte-antigen 4)
fehérje (egyéb elnevezései: cytotoxic
T-lymphocyte-associated protein 4, CD152 fehérje) jelfogógátló fehérje a T-,
B-, NK, NKT, DC sejtekben. Immunellenőrző pontként viselkedik: gátolja a
sejtosztódást és az IL2 képződését, továbbá befolyásolja az eredeti CD4+-T-sejtek
elkülönülését, de szabályozza a T-sejtek végrehajtó tevékenységét is, pl. a
B-sejtekre gyakorolt hatást.
Ha a CTLA4
gátolt/hibás, felszaporodnak a TH2-sejtek, kivált a TH17-sejtek. A CTLA4 a szabályozó
T-sejteken (Treg) állandóan jelen van, egyéb T-sejtekben a mag körüli Golgi-hálózatban,
a beltestecsben és az emésztőtestecsekben található; folyamatosan áramlik a
sejtfelszínre, de csak foszforilezett állapotban marad ott. Az antigénbemutató
sejtek B71/2 és a B7H2 fehérjéjével kötődik.
A CTLA4 gén
(2q33.2) négyféle CTLA4-et kódol, és gyakori a sokalakúság is; ezek különböző
módon hatnak, és különböző, elsősorban autoimmun betegségekkel függnek össze.
PD1 (
programmed
death-1) fehérje (egyéb
neve: PDCD1) gátló jelfogó a CD4- és a CD8-T-sejtekben,
az NK, NKT és B-sejtekben, a nagyfalókban és néhány DC-sejtben. A T-sejtekben gátolja
a jelközvetítéseket (PI3K, RAS–MAK), a citokinek és a végrehajtó működéséhez
szükséges átírásfehérjék képződését, csökkenti a T-sejtek mozgását,
kapcsolódását más sejtekkel és a sejtpusztító hatását; a sejtvégzeti molekulák
felszaporodásához vezet.
A PD1 jelzés hatására jelenik meg a sejt
felszínén tevősítéskor vagy
idült gyulladásnál; egyébként a sejtplazmában van. A T-sejteken a pMHC–TRC
kapcsolódás, továbbá IL2, IL7, IL15, IL21 és I-es formájú IFN hatására
fejeződik ki. Sejtfelszíni megjelenését még a sejt anyagcseréje is
befolyásolja: glükozbontáskor csökken, ösztrogén hatására viszont fokozódik.
Átmenetileg az eredeti T-sejtek felszínén is jelen van.
Ha a serkentés folyamatos
(idült gyulladás), a PD1 folyvást kerül a sejt felszínére, aminek következtében
a T-sejt működése zavarttá válik – ezt nevezzük T-sejt-kimerülésnek (T cell
exhaustion).
A PD1 a PDL1 (programmed
death-1 ligand) és a PDL2 (programmed death-2
ligand) jelvivőkkel kapcsolódik.
A PD1 gén (2q37.3) négyféle PD1-t képes
kódolni, köztük vízoldékony változatot. Gyakori a sokalakúság is. Ezek is
különbözök, és összefüggnek autoimmun betegségekkel. (→PD1)
ICOS (
inducible
costimulator) serkentő T-sejt felszíni jelfogó; a TCR kapcsolódására
fejeződik ki. Főleg a Th2-, kevésbé a Th1-sejteket serkenti, elősegíti az IL10
képződését a szabályozó T-sejtek fenntartásához.
CD40 (
clusters of
differentiation 40) a TNF-családba tartozik. A B-sejtek, a nagyfalók és a
tüszői nyúlványos sejtek (FDC) felszínén kifejeződő fehérje; összekötődik a
T-sejtek CD40L-jével. A kapcsolódás folytán az fenti antigén-bemutató sejtek
képeznek IL12-t, ez pedig fokozza a CD4Th1m a CD8, az NK-sejtek és a B-sejtek
működését, továbbá a B-sejtek átalakulását plazmasejtekké, illetőleg emlékező
B-sejtekké.
cell adhesion molecules, CAM →tapadófehérjék
CMMRD (constitutional mismatch
repair deficiency) →kétválzatos
párhibajavítás-hiány
coding region microsatellites, cMS génbeli
mikroismétlet (→mikroismétlet)
constitutional mismatch repair deficiency →kétválzatos
párhibajavítás-hiány
DC-SIGN (
dendritic
cell-
specific
intercellular adhesion molecule-3-
grabbing
non-integrin), más néven CD209. C-formájú lektinjelfogó a nagyfalókon
(macrophages) és a nyúlványos sejteken; felismer és köt mannózmintázatokat,
elindítva a sejtfalást. A nyúlványos sejtek DC-SIGN-jelfogója összeköttetést teremt
az érhámsejtekkel, gerjeszti a CD4+ T-sejteket, és felismeri a
kórokozók fél-antigénjeit.
DGCR8 (DiGeorge syndrome critical region 8) (egyéb nevei: Microprocessor
Complex Subunit DGCR8; PASHA – partner of DROSHA) kétszálú RNS-hez kötődő
fehérje, DROSHA-együttes tagja. A DGCR8 gén (22q11.21) kódolja. Az miRNS
érési folyamatában és a DNS-hiba kijavításában (nukleotidkivágás) vesz részt. A
DGCR8 gén hibája a velocardiofaciális tünetcsoporttal, illetve a
DiGeorge-kórral társulhat. (→DROSHA, DROSHA-együttes, miRNS)
dimerization
domain kettősödési gomolyok bizonyos fehérjék azonos fehérjék való összekötődését
elősegítő gomoly. (→fehérjegomoly)
DNS-átrendeződés DNA recombination (homologous
recombination) a kettős DNS-szál egy darabjának az eredetihez hasonló, majdnem
azonos másik DNS-szállal való helyettesítése. Pontosan nem egyezik a kettő, de
az eltérés nem befolyásolja a DNS működését.
DNS-kettőződés DNA replication
a DNS egészének lemásolása a sejt osztódása előtt, azért, hogy a számtartó
sejtosztódásban mindkét utódsejtbe teljes DNS állomány kerüljön. A kettőződés
csupán néhány órát vesz igénybe, melynek végeztével – átmenetileg – egy olyan
sejt keletkezik, amelyben kétszer annyi DNS van, mint a megkettőződést
megelőzően (4n, azaz négykészletes sejt). A 4n DNS állomány fele adódik át az
osztódásban keletkező két leánysejt mindegyikébe, így a szülő- és leánysejtek –
elviekben – genetikailag azonosak lesznek. A DNS-kettőződés meglehetősen
pontos: 109 nukleotid lemásolására esik 1 hiba.
DNS-kettőződési ártmány (kettőződési ártmány)* DNA replication stress a DNS kettőződését
nehezítő külső vagy belső károsító hatás. Ilyen ártóhatás a szabálytalan
nukleotidbeépülés, a rendellenes DNS-szerkezet, a törékenyhely, a
kromatineltérés, a daganatgéntúlzás, a kettőződési fehérjék zavara, valamint
külső károsító hatások. A kettőződési ártmány kialakulásának egyik
kulcsszereplője a FHIT gén, amelyik a FRA3b gyakori törékenyhelyen (CFS FRA3B)
van. Működéskiesése önmagában megzavarja a kettőződési szálágazást.
A kettőződési ártmány olyan sejtállapotot hoz létre,
amelyet a kettőződési szálágazás lassulása jellemez, aminek következtében
megtorpanhat a DNS-szál kettéválása (fork pausing), egyenlőtlenné válhatnak a
testvérágak (sister fork asymmetry), vagy ingataggá válhat a folyamat (increased
fork instability). Ha a kettőződési ártmány kifejezett, avagy a DNS törékeny
(törékenyhelyek), megállhat a szálágazás (fork stalling), és ha az ATM és ATR
nem állítja helyre, a szálágazat összeesik (fork collapse), DNS-hiba keletkezik.
A DNS-kettőződési ármány egyik legsúlyosabb következménye a DNS-ingatagság.
DNS-metilezés DNA methylation metilcsoport
(CH3) elektronkötése a DNS citozinjának 5-ös szénatomához –
5-metil-citozin keletkezik. A metilcsoportot a DNS-metil-transzferáz csatolja
az S-adenozil-metioninról. A metilcsoport majdnem mindig ahhoz a citozinhoz
kapcsolódik, amelyet guanin követ; ezt nevezzük CpG-helynek (→CpG-sziget) –
írják mCG (methylation of cytosine followed by guanin) formában is. A CpG
nukleotidkettősök az emberi nukleotidlánc 1%-át teszik ki; 70–80%-uk
metilezett.
A citozin metilezése a génműködés szabályozásának
törzsökös formája, meghatározóan befolyásolja a génátíródást. Mivel a génen
kívülről szabályozódik, epigenetikai szabályozásnak nevezzük. Jelentősen
változik az egyedfejlődés idején, majd állandósul. Fontos szerepe van a
sejtnövekedés, a sejtelkülönülés, az érképződés, a
DNS-hiba javításának irányításában, az X-kromoszóma némításában (X chromosome
inactivation), a genomlenyomatban (genomic imprinting), az embrionális szövetek
kialakulásában stb.
Az indító (promoter) környéki metilezés gátolja a génátíródást, a gén némává válik – ez a
terület gazdag CpG-szigetekben és más átírásfehérje-kötőhelyekben. A génen
belüli metilezés (gene body methylation) serkenti az átíródást, és gátolja az
átíródás meghibásodását. A fokozó (enhancer) metilezésének jelentősége
bonyolultabb, valószínűleg nemcsak az átírásfehérje kapcsolódásával függ össze.
Az olyan citozin metilezését, amelyet adenin (A),
citozin (C) vagy timin (T) követ (tehát nem guanin), nem CpG-metilezésnek
nevezzük, szokásosan CpH vagy mCH formában írjuk (H = A, C vagy T). Ez az
őssejtekben (ébrényi sejtekben) és az idegsejtekben (neuronokban) fordul elő.
A DNS metilezését a TET1, TET2, TET3 (ten-eleven
translocation) enzim ellensúlyozza: ezek az enzimek oxidálják az
5-metil-citozint. A metilezéses szabályozáshoz tartoznak még az „olvasó”
fehérjék (reader proteins), amelyek a metilezett DNS-hez kapcsolódnak, és
kromatint alakító fehérjéket és fehérjeösszleteket toboroznak. Ilyenek a
methyl-CpG binding domain fehérjék (MBD fehérjék) és bizonyos átírásfehérjék.
A DNS metilezés kétféleképpen befolyásolhatja a gén
működését: meggátolja, hogy az átírásfehérje kapcsolódjék hozzá, de talán még
fontosabb az MBD-fehérjék kötése: az MBD-fehérjék ugyanis további fehérjéket,
mint hiszton-deacetiláz és más kromatinformáló fehérjét kapcsolnak, amelyek
befolyásolják a hisztonokat, és tespedt kromatinok (heterokromatinok)
keletkeznek.
A CpG kettősök csökkent metilezettsége
(hypomethylation) a folyamatos génátíródáshoz vezet (géntúlműködés), fokozott
metilezettsége (hypermethylation) pedig alulműködéssel jár.
A DNS metilezési zavarai összefüggnek sokféle betegséggel,
reumás és idegbetegségekkel, valamint a rákokkal is. A rákoknál összességében
csökken a metilezés a genomban (általános alulmetilezés), egyes szabályozó
gének területén viszont fokozott (túlmetilezés).
Mivel a ráksejtek és az ép sejtek metilezése eltér, a
metilezés formája lehet daganatjelző, pl. a SEPT9 gén fokozott metilezése
jellemző a vastagbélrákokra. Az emberi sejtekben jóformán csak a citozin
metileződik, nagyritkán azonban az adenin is: N6-metil-adenin keletkezik. Ez is
gátolja a génkifejeződést, főleg az X kromoszómákhoz kapcsolt géneknél. Fontos
szerepet tulajdonítanak neki az ébrényi és a magzati fejlődésben.
DP (
dimerization
partner) fehérjék transcription factor DP fehérjecsalád, átírásfehérjék. Az E2F fehérjékhez
kötődnek, kettőst képezve (innen kapták a nevüket) tevékenyek. Az emberi
sejtekben háromféle fordul elő: a DP1, a DP2 és a nem régen felfedezett DP3. A
DP1 és DP2 serkentő: az E2F–DP1/2 kettősként kapcsolódnak a célgének
indítójához, és fokozzák a gének átíródását. A DP3 gátló hatású. A sejtkör és a
sejtvégzet szabályozásában vesznek részt.
ébrényen kívüli középső csíralemez extraembryionic mesoderm középső csíralemez formájú (azaz kötőszöveti) sejtek, melyek a csíralemez
területén kívül találhatók: az ébrényhámon kívül vagy a tápláló sejtek belső
oldalán. A tápláló sejtek és a belső oldalukra vándorolt kötőszöveti sejtek
összessége a külső magzatburok.
ébrényhám (amnionhám) az
ébrénycsomó tetején kialakuló, a tápsejtek belső felszínéhez fekvő egyetlen
sajátos hámsejtsor. Vizet termelnek (ébrényvíz), ez üreget alakít ki az
ébrénycsomó felsősejtjei között; ez az ébrényüreg. Az ébrényhámot a felsőbb
sejtek hozzák létre.
ébrényüreg (amnionüreg) az
ébrénycsomó felső részében, az ébrényhám által kialakított üreg. Folyadékkal
(ébrényvíz) telt.
egyesülésfehérje* fusion protein
olyan fehérje, amelyet két vagy több
egyesült gén kódol. Ezek a gének eredetileg külön fehérjéket képeztek. Az
egyesülésfehérjék tulajdonságai eltérnek az egyenként kódolt fehérjék
tulajdonságaitól, többnyire ebből is, abból is megőriznek valamit.
Tevékenységük ezért más és más. A fertőződések során keletkező
egyesülésfehérjék új tulajdonságokat adnak a vírusnak, nem ismert helyzetek
keletkezhetnek, például nem várt betegség.
Az egyesülésfehérjék mesterségesen is létrehozhatók a
gének átrendeződésével; ezeket átrendeződési egyesülésfehérjéknek (recombinant fusion proteins) nevezik.
egymásba
alakítás* dismutation olyan
vegyfolyamat, amelyben két azonos molekula elektron átadás-átvétellel átalakul;
az egyik felveszi, a másik leadja az elektront. Ezt a folyamatot sarkallják a
diszmutázok.
elektromágneses sugárzás (hullám) electromagnetic
radiation valamely forrásból közvetítő
közeg nélkül terjedő, az elektromos és mágneses terek folytonos váltákozásából
álló energiafolyam, amely a fény sebességével terjed minden irányban. Körzserű
fizikában az elektromágneses sugárzás a foton.
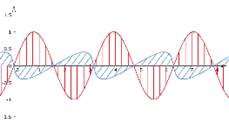 A forrás rezgő töltés, amelyben a pozitív és a negetív töltés váltakozva
felfelé és lefelé mozdul el folyamatosan. Minden töltés körül elektromos tér
keletkezik. A töltés le-fel mozgása miatt az elektromos tér is mozog hullám
formájában. Amikor a pozítív töltés felfelé mozdul, a hullám emelkedik, amikor
lefelé, a hullám süllyed. A mozgó elektromos tér mágneses teret gerjeszt,
iránya az elektromos tér irányának változását követi. A mozgó mágneses tér
elektromos teret hoz létre, vagyis folyamatosan keletkezik elektromos és
mágneses tér, ezt nevezzük elektromomágneses térnek. Az energiafolyam pedig nem
más, mint az elektromágneses tereknek haránthullámok szerinti terjedése a
térben – azaz maga a tér terjed a haránthullámok tulajdonságaival. A kétféle tér
egymással hegyes szöget zár be, a terjedés iránya pedig merőleges a hullámokra.
Az ábrán az elektromos teret piros, a mágnesest a kék szín jelöli; ez maga az
elektromágneses hullám, illetve sugárzás. (Az ábrát Teleki Katalin készítette.)
Jellemzői a hullámhossz és a hullámgyakoriság (v).
A forrás rezgő töltés, amelyben a pozitív és a negetív töltés váltakozva
felfelé és lefelé mozdul el folyamatosan. Minden töltés körül elektromos tér
keletkezik. A töltés le-fel mozgása miatt az elektromos tér is mozog hullám
formájában. Amikor a pozítív töltés felfelé mozdul, a hullám emelkedik, amikor
lefelé, a hullám süllyed. A mozgó elektromos tér mágneses teret gerjeszt,
iránya az elektromos tér irányának változását követi. A mozgó mágneses tér
elektromos teret hoz létre, vagyis folyamatosan keletkezik elektromos és
mágneses tér, ezt nevezzük elektromomágneses térnek. Az energiafolyam pedig nem
más, mint az elektromágneses tereknek haránthullámok szerinti terjedése a
térben – azaz maga a tér terjed a haránthullámok tulajdonságaival. A kétféle tér
egymással hegyes szöget zár be, a terjedés iránya pedig merőleges a hullámokra.
Az ábrán az elektromos teret piros, a mágnesest a kék szín jelöli; ez maga az
elektromágneses hullám, illetve sugárzás. (Az ábrát Teleki Katalin készítette.)
Jellemzői a hullámhossz és a hullámgyakoriság (v).
Az elektromágneses sugárzás elemi energiaimennyisége az
energiarészecs (energy quantum), amely egyenesen arányos a felvett vagy leadott
sugárzás hullámgyakoriságával (v). Az elektromágneses sugárzás energiájára
érvényes: E = h ∙ v (h = 6,626 ∙ 10-34 J ∙ s; ez a Planck-állandó – dimenziója
J ∙ s)
Háromféle elektromágneses sugárzást ismerünk: a
radiosugárzást, a fényt és a gammasugárzást.
elektronátmenet
oxidation-reduction [redox]
reaction, oxidoreduction (oxidoredukció,
redoxifolyamat, redoxireakció) egy vagy több elektron átadása,
átvétele egyetlen vegyfolyamatban; elektronáramlás megy végbe. Az egyik
molekula elektront ad le (oxidation) (elektronátadó molekula), a másik
elektront vesz fel (reduction) (elektronfelvevő molekula) ; a kettő az
elektronátmenet-pár.
Az elektronátadó atomnak pozitív (pozion), az
elektronfelvevő negatív (negion) töltésűvé válik. Pl. magnézium és oxigén
vegyülésekor magnézium-oxid keletkezik (MgO), amely Mg2+ és O2-
ionokból álló ionvegyület. A Mg ad át két elektront (oxidation), amelyet az
oxigén felvesz (reduction), majd a keletkezett ionok rácshálózatba rendeződve rögzült
ionvegyületet formálnak.
Az elektronáramlással járó biológia folyamatok
létezésünk alapjai, a sejtműködéshez szükséges energia ezekkel képződik. A
biológiai elektronátmeneti folyamatok rendszerint többlépcsősek, a molekulák
változása rendkívül gyors egymásutánban megy végbe, és összetett. Miután az elektron legtöbbször nem önmagában, hanem proton kíséretében, azaz H atom formájában adódik át, ezért
általában nincs lényeges töltésváltozás, pl. mikor a glükóz bontásában
elektronok H atom formájában adódnak át a NAD-nak, nem lesz a „maradék” szénhidrát töltött.
elektronátmenetség oxidation reduction potential, ORP az elektronleadó/elektronfelvevő
képesség mértéke, amelyet voltban (V) adunk meg, és ORP-vel jelölünk.
Értéke mindig csak más rendszer elektronátmenetségéhez viszonyítva
értelmezhető. Az eletronátmenet egyensúlyáról tájékoztat. A pozitívabb
elektronátmenetségű a rendszer ad át elektront a negatívabbnak. Minél
pozitívabb a rendszer vagy szer ORP-értéke, annál kifejezettebben ad át
elektront. (NAD,
elektronburok electron
configuration az elektronok elhelyezkedése
az atomban vagy ionban; az elektronhéjak, elektronalhéjak és elektronhelyek
rendszere. Ebben helyezkednek el az atom elektronjai. Ez határozza meg az elem
vegytulajdonságát és részvételét a kötésekben.
elektronhéj shell az atommagtól az elektron energiaszintje szerinti távolságban lévő energiatartomány*.
Az atomban az elektron energiaszintjétől függően csak meghatározott távolságra
helyezkedhet el az atommagtól. A kisebb energiájú elektronok közelebb vannak a
maghoz. Vagyis minél távolabbi elektronhéjon van az elektron, annál nagyobb az
energiája. Az elektron az elektronhéjon belül több helyen is lehet, ezért
mondjuk az elektronhéjat energiatartománynak, nem pedig elektronpályának.
Egy atomnak legfeljebb
7 elektronhéja lehet. A magtól távolodva
növekszik az elektronhéjak energiatartományának az energiaszintje; a legkülső
elektronhéj energiaszintje a legnagyobb. Az elektronhéjakat háromféleképpen jelölhetjük:
▪ Betűkkel: K, L, M, N, O, P, Q;
a K van a maghoz legközelebb, a továbbiak a magtól elfelé haladva jelzik az
elektronhéjakat.
▪ A főrészecsszámmal (n). A maghoz legközelebbi elektronhéj az 1-es vagy K-héj; főmrészecsszáma
n = 1. A következő a 2-es vagy L-héj; főmrészecsszáma n = 2. A 3-as héj az M-héj (n = 3), a 4-es héj
az N-héj (n = 4), az 5-ös az O-héj (n = 5), a 6-os a P-héj (n = 6), a 7-es
pedig a Q-héj (n = 7).
▪ Egyszerűen számokkal: 1., 2.
stb. elektronhéj; az 1. a maghoz legközelebbi.
Az egyes elektronhéjakon lehetséges
legtöbb elektron meghatározott; a 2 ∙ n2 képlettel fejezhető ki (n a
főmértékszám): az 1-es héjon (n = 1) legtöbb két elektron lehet, a 2-es héjon legtöbb
nyolc (n = 2 [n2 = 4, 2 ∙ 4 = 8]), a 3-as héjon 18 stb.
Mivel minél távolabb
van az elektron a magtól, energiája annál nagyobb, ha egy elektron egy külső
héjról egy belsőre kerül, energia szabadul fel, és fordítva, belsőn lévő
elektron energiát igényel ahhoz, hogy külsőbb héjra kerüljön. A leadott vagy
felvett energia egyenlő a két elektronhéj közti energiakülönbséggel. A
megfelelő elektronhéjakon tartózkodó elektronok nem sugároznak energiát.
Az atom legkülső
elektronhéját vegyértékhéjnak* nevezzük; ezen vannak a
vegyértékelektronok. Legfeljebb 8 vegyértékelektron lehet, kivéve a hidrogént
és a héliumot, amelyeknek egyetlen elektronhéja van, legfeljebb 2 elektronnal.
(→vegyértékelektron)
elektronalhéj subshell az elektronhéjon belüli
energiatartomány. Négy elektronalhéj van; ezeket s, p, d, f betűkkel
jelöljük, utalva a bennük lévő elektronhely (orbital) formájára, pl. az s (spherical)
gömbölyű formájú elektronhely.
Az 1-es elektronhéjnak egyetlen
alhéja van (1s), a 2-es elektronhéjnak kettő (2s, 2p),
a 3-asnak 3 (3s 3p 3d), a 4-esnek négy (4s 4p 4d 4f) –
az alapállapotban lévő atomoknak egy elektronhéjon belül nincs négynél több
alhéja. A további alhéjak a gerjesztett atomokban jönnek létre. Az s-alhéjon,
bármely energiaszinten legfeljebb két, a p-alhéjon legfeljebb hat,
a d alhéjon legfeljebb 10, az f-alhéjon pedig
legfeljebb 14 elektron lehet.
elektronhely* atomic orbital, electron orbital az elektronok mozgásának térbeli helye és
viselkedése (pl. hullámtulajdonsága) az alhéjakon belül; az elektronburoknak az
a része, amelyben az elektronok tartózkodási valószínűsége 0 és 1 között van.
Az s-alhéjnak 1 elektronhelye van, a p-alhéjnak
három, a d-nek öt, az f-nek pedig 7. Egy elektronhelyen legfeljebb 2 elektron
lehet.
Az elektronhelyet a
hazai szakirodalomban elektronpályának is mondják. A pálya szó
útvonalfélére, valamilyen síkbeli haladás vonalára utal, nem pedig térbeli
elhelyezkedésre. Ezért az elektronhely elnevezés kifejezőbb.
Az elektron nem kering úgy a mag körül, miként a Föld a
Nap körül. Az atommag és az elektron töltésvonzása hat egymásra; a gyengébb (az
utóbbi) felveszi az erősebb (az atommag) irányultságát. Vagyis az elektronok
tényleges mozgási helyét az elektron energiája, a mag tényleges vonzásereje és
az atom mágnestere szabja meg. Az elektronhely
ekként az n, l és az ml elméletszámokkal
jellemezhető. Egy elektronhelyen – a
Pauli-elvből adódóan – legfeljebb 2 elektron lehetséges. (→elektron-elméletszámok, Pauli-elv)
Az elektron elhelyezkedése az
eletronhelyen belül, hogy hol van, és hol lesz a következő pillanatban, nem
mondható meg pontoson – ez a Heisenberg-féle határozatlansági elv. Csupán az
elektron helyének valószínűségi eloszlását tudjuk meghatározni.
Az elektron legvalószínűbb helyét a részecselmélet szellemében
az elektron állapotfüggvényével határozzák meg; ez az elektronnak a hely
szerinti valószínűségi eloszlását fejezi ki. Jele: ψ. Az állapotfüggvényt a
Schrödinger-egyenlettel számolják ki.
elektronfelvétel* reduction atom, molekula vagy ion által egy/több elektron
felvétele, aminek következtében elektrontöbbletű atom/ion/molekula keletkezik.
Az elektronátvétel az elektronleadás ellentéte, de annak folyománya: valamely atom,
molekula vagy ion egy/több leadott elektronjának az átvétele.
elektronleadás* (elektronvesztés) oxidation (oxidáció) atom, molekula vagy ion egy/több
elektronjának leadása; az elektront leadó atom pozitív ionná válik; növekszik
az elektronátmenet-száma . Vegyfolyamatban a leadott elektront másik atom,
molekula, ion veszi fel; a folyamat csak így mehet végbe, vagyis
elektronátmenet formájában. Az atom stb. egyébként az elektront magas
hőmérséklet vagy egyéb energiaforrás, pl. foton hatására is leadhatja, és ionná válhat.
biológiai elektronleadás (biológiai
elektronvesztés) biological oxidation
az szervezetben végbemenő elektronleadás, a sejtek energiaátalakításának
folyamatai, pl. →sejtlégzés.
elektronsági szám* oxidation
number, oxidation state (oxidációs állapot, oxidációs szám)
azoknak az elektronoknak a száma, melyeket egy atom lead vagy felvesz ahhoz,
hogy egy másik atomhoz kötődjék, elektronkötést hozzon létre. Azt fejezi ki,
hogy az atom hány elektron leadására, cseréjére vagy felvételére képes az adott
molekulában. Pl. a Mg atom elektronátadási száma majdnem mindig +2, mert Mg2+
ion formájában két elektront vehet fel a kötés kialakítására; 2 elektron hiánya
van. hasonlóan, az O atom elektronátadási száma általában i-2, mert vegyületeiben
legtöbbször két elektront adhat le. Az elektronsági számból tehát könnyen
felismerhető, hogy az adott atom elektronátadóként vagy elektronfelvevőként
vesz részt elektronátadási folyamatban.
Az ion elektronsági száma a töltésszáma. Az elem
elektronsági száma = 0. A molekula és az ionvegyület elektronsági száma egyenlő
az atomjai, illetve ionjai elektronsági számának összegével, pl. a Mg2+
és az O2- egymással alkotott vegyületében az elektronsági
számok összege: +2 és -2 = 0; azaz a vegyület elektronsemleges. Hasonlóan a
magnézium-hidroxid (MgOH) ionvegyület esetében: Mg2+ (O2-H+)2
= +2 és -1 kétszer = 0. Az összetett ionok összesített elektronsági száma a
töltésszámuk.
ellentett átíródás
reverse transcription az átírásnak, vagyis a DNS-ről való RNS képződésének a
fordítottja: az RNS átírása DNS-sé. A visszugrálatokban és a retrovírusokban
megy végbe a fordított transzkriptáz hatására. (→retrovírus, ugrálat)
előrejelzés prediction
valaminek (betegségnek, kimenetelnek, jó- vagy rosszindulatúságnak stb.)
valószínűsítése különböző jelekből, számításokból stb.
előrejelzési érték predictive value, PV valamilyen
vizsgálat/szűrés eredménye alapján számszerűsített valószínűség: a
számszerűsített érték milyen valószínűséggel tükrözi a valós állapotot.
pozitív előrejelzési érték positive predictive value, PPV annak
valószínűsége, hogy a pozitív vizsgálat/szűrés eredménye valóban betegséget
tükröz, pl. pozitív szűrési eredmény a betegséget. Más elnevezés: positive
posttest probability.
negatív előrejelzési érték negative predictive value, NPV annak
valószínűsége, hogy a negatív vizsgálat/szűrés eredménye mögött valóban nincs
betegség, pl. a negatív szűrési eredményű személy nem beteg. Más elnevezés: negative
posttest probability.
előrejelzési mutató predictive index több tényező valamilyen
számítása szerint kapott, valamit valószínűsítő szám/százalék (→RIMI, ROMA…)
előrejelzési valószínűség predictive probability, PP az előrejelzési
mutató alapján számolt valószínűsítés.
EMSY
(BRCA2-interacting transcriptional repressor EMSY) Átírást szabályozó
fehérje; az EMSY gén (11q13-11q14) kódolja. Kisagyban, tüdőben, emlőben,
petefészekben, méhben és bőrben képződik. A kromatinalakító együttesben*
(chromatin remodeling complex) gátolja, a H3- (hiszton-3-) fajlagos
metil-transzferáz együttesben fokozza a génátírást. A BRCA2 átíródásának
gátlásával nehezíti a DNS-hiba kijavításában. Szerepe van a gyulladásokban is:
az AKT1 (fehérje-kináz) szabályozza az interferonválaszt az EMSY foszforilezésével.
end-replication problem →végmásolási nehézség
energiaság* potention valamiben rejlő energia nagysága. Származtatott (egyenlettel meghatározott, közvetlenül nem mérhető) érték. Például
→elektromos energiaság, →vegyi energiaság.
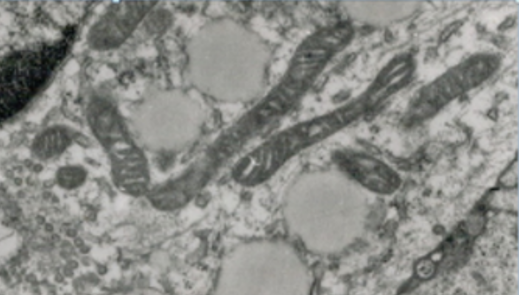
energiatermecs
* mitochondrion (mitokondrium) néhány
μm hosszú és ~0,5 μm vastagságú, fonálszerű szervecske; a sejt legfontosabb
energiatermelője, ATP-képzője. A felső elektronmikrosztópos ábrán négy
hosszúkás energiatermecs és semleges világos lipidcseppek láthatók. Az alsó
energiatermecsek átmetszeti képei. Jól kivehető a kettős hártya. (Oláh Imre
felvételei.) Az energiatermecs kettős hártyával határolt. A kis molekulákat
áteresztő külső hártya sima; ez választja el az energiatermecset a
sejtplazmától, egyes sajátos részei kapcsolódnak a plazmahálózathoz. A belső
hártya viszont jóval zártabb: csak fehérjeszállítók segítségével juthatnak át
rajta a vízoldékony anyagok. Sokszorosan begyűrődik az alapállományba,
lemezszerű kettőzeteket (cristae), egyes sejtekben csőszerű képleteket képez,
hatványozva a hártyafelszínt, a sejtlégzés felületét. A két hártya között rés
van (hártyaközi tér*, intermembrane space), amely egy-egy ponton megszűnik,
mert a hártyák érintkeznek egymással (érintkezési helyek).
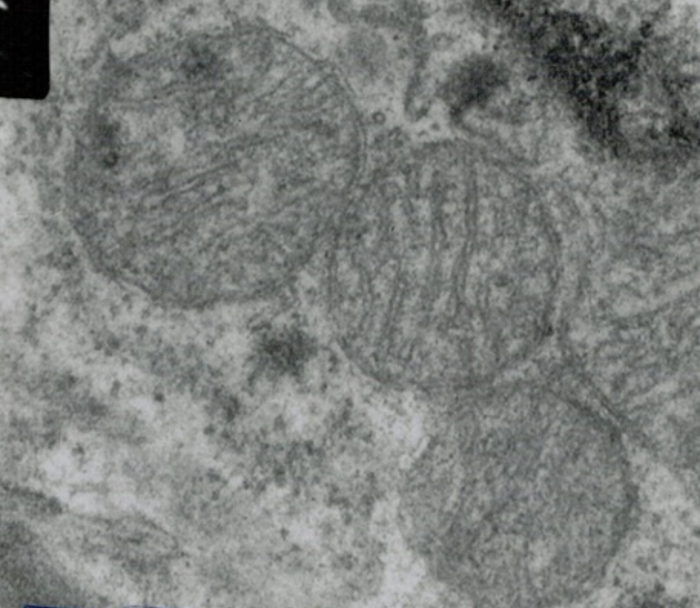 A belhártyán belül van az alapállomány (mitochondrial
matrix), amely fehérjében igen gazdag; ~1500-féle van, ezek zömét már
azonosították. 13-féle fehérjét az energiatermecs DNS-e képez, a többit – más
fehérjék közreműködésével – a TOM–TIM együttes (outer and inner mitochondrial
membrane translocation proteins) szállítja át a belső hártyán. Szép számmal
találhatók enzimek: a citrát-kör, a hemképződés, a zsírsavak lebontásában
szerepet játszó β-elektronleadási rendszer, a piruvát-dehidrogenáz-össztes
fehérjéi stb., valamint mRNS-ek, tRNS-ek, fehérjetermecsek, miRNS-ek, és ebben
találhatók az energiatermecs DNS-ei is. Az ATP képződéshez szükséges
foszforilező enzimössztes a belső hártya begyűrődéseiben van. A hártyaközi tér*
fehérjékben szegényebb, citokróm-C-t, sejtvégzeti enzimeket, antioxidánsokat,
elektron átadó-átvevő enzimeket tartalmaz.
A belhártyán belül van az alapállomány (mitochondrial
matrix), amely fehérjében igen gazdag; ~1500-féle van, ezek zömét már
azonosították. 13-féle fehérjét az energiatermecs DNS-e képez, a többit – más
fehérjék közreműködésével – a TOM–TIM együttes (outer and inner mitochondrial
membrane translocation proteins) szállítja át a belső hártyán. Szép számmal
találhatók enzimek: a citrát-kör, a hemképződés, a zsírsavak lebontásában
szerepet játszó β-elektronleadási rendszer, a piruvát-dehidrogenáz-össztes
fehérjéi stb., valamint mRNS-ek, tRNS-ek, fehérjetermecsek, miRNS-ek, és ebben
találhatók az energiatermecs DNS-ei is. Az ATP képződéshez szükséges
foszforilező enzimössztes a belső hártya begyűrődéseiben van. A hártyaközi tér*
fehérjékben szegényebb, citokróm-C-t, sejtvégzeti enzimeket, antioxidánsokat,
elektron átadó-átvevő enzimeket tartalmaz.
Az energiatermecs alapvető feladata a sejtlégzés (cellular
respiration), vagyis az a folyamat, amelyben elektronok több lépésben történő
továbbítása során energia szabadul fel, és ez raktározódik ATP formájában;
vagyis elektronátadás és ATP-képződés megy végbe. (→sejtlégzés). Meghatározó
továbbá a sejtvégzetben, a fertőzésekre adott sejtválaszban.
Az energiatermecsek száma, formája és
elhelyezkedése sejtfajtáként lényegesen eltér. A sok energiát használó
sejtekben, például
a gyomor fedősejtjeiben sok ezer van. Leginkább
szétszórtan helyezkednek el, de vannak olyan sejtek is, amelyekben
meghatározott helyen találhatók. Gyakran hasadnak és fűződnek le, lehetővé téve
helyük változtatását a sejt igényei szerint. Ha feleslegben vannak, sajátos
önfalás során (mitophagy) bontódnak le.
A sejtplazmából nem jut tRNS az energiatermecsbe. Saját
tRNS-eivel, mRNS-eivel képez fehérjéket. Saját fehérjehajtogató és fehérjebontó
fehérjéi vannak.
energiatermecsi DNS-osztódás mitochondrial DNA replication (mitokondrium-DNS) A folyamat másolja a sejtkört, annak része, és a szabályozása is
egyezik. A DNS-kettőződést a DNS-polomeráz-γ enzimegyüttes végzi. Ez egy 140
kDa tömegű, sarkalló DNS-polimerázból, a POLG gén kódolja, és két 55 kDA
járulékos alegységből áll, ezeket a POLG2 gén kódolja. A kettőződési testecs,
amelybe a DNS-polimeráz, egy helikáz (TWINKLE) és az energiatestecsi SSB
fehérjékből áll.
enzimgátlók enzyme inhibitors az enzimek működését megakadályozó vagy felfüggesztő
molekulák. Többféle gátlást különböztetünk meg:
visszafordíthatatlan gátlás irreversible inhibition a
gátló molekula nagyon erősen kapcsolódik az enzimhez, leginkább kovalens
kötéssel, de lehet másféle kötéssel is. Enzim–gátlómolekula páros keletkezik,
amelynek szétválása jóformán valószínűtlen. Pl.: így kapcsolódnak az ideggázok
az acetilkolin-észterázhoz, megbénítva az idegjelek átadását, vagy a penicillin
a kórokozók fali enziméhez.
visszafordítható gátlás reversible inhibition a gátló molekula gyengén kötődik az enzimhez, és attól
a körülmények változásával elválhat. Három formáját ismerjük.
▪ Versengő gátlás (competitive inhibition) a vegylettel majdnem azonos, vagy hozzá nagyon
hasonló molekula gátlási módja. A molekula a vegylet helyére kötődik,
megakadályozva a vegylet kapcsolódását és ezáltal az enzimfolyamatot (Vmax
változatlan, a Km növekszik). (→enzimvegymozgás) Az enzim ugyanis
csak a vegyletet képes átalakítani. A gátló molekulának nagyobb a vegyvonzalma
az enzimhez, ezért kapcsolódik nagyobb eséllyel. A nem kötődött vegyletek
azonban felszaporodnak, és mert a kapcsolódásuk arányosan növekszik a vegylet
töménységével, bizonyos szint elérése után a hatáshelyre ismét a vegylet fog
kötődni, és az enzimfolyamat újra bekövetkezik. (Pl. →metotrexát)
Leghatásosabban a vegylet átmeneti formáihoz hasonló molekulák (tranziton
analogs) akadályozzák az enzimműködést.
▪ Átalakulásos gátlás (uncompetitive inhibition) a gátló a vegylet–enzim társulásával
kialakuló térkötő helyhez kapcsolódik. Előfordul, hogy a vegylet kapcsolódásra
az enzim térszerkezete úgy változik, hogy új térkötő hely keletkezik, gyakorta
a hatáshely környékén, és a gátló molekula ide kötődik. Enzim–vegylet–gátlómolekula
hármas jön létre, amelyben az enzimfolyamat nem megy végbe (Vmax és
a Km is csökken). Ez a gátlás a vegylet töménységének növelésével
nem másítható, hiszen a vegylet kötődik, csak az átalakulás akadályozott.
▪ Nem versengő gátlás (non-competitive
inhibition) térkötőhelyes enzimek gátlási módja. A gátlómolekula az enzim
hatáshelyén kívüli térkötőhelyhez kapcsolódik, de nem változtatja meg a kötőhelyet,
a vegylet kapcsolódik. Az enzim–vegylet–gátlómolekula hármasbaan azonban az
enzimfolyamat fékeződik (Vmax és az átvitelszám csökken, a Km
válozatlan). A gátlásnak ez a formája sem függeszthető fel a vegylet
mennyiségének növelésével.
▪ Kevert gátlás
(mixed inhibition) a gátló molekula csökkenti a vegylet vegyvonzását, kötődését
a hatáshelyhez, valamint az átvitelszámot.
érzékelés sensation az inger megragadása az érzékszervekkel – eljuttatása
az idegrendszerhez; a felfogás második szakasza.
érzékcsalódás téves észrevevés; külső (vagy belső) inger nélküli
észrevevés és érzékelés. Idesorolják a képzelődést is.
érzékel az érzékszervekkel megragad.
érzéklet az (érzékszervekkel történő) érzékelés eredménye.
érzékeny sensitive 1. képes ingerek/hatások észlelésére, 2. csökkent
ingereket is felfogó; hatásokra fokozottan fogékony (lisztérzékeny,
fényérzékeny stb.).
túlérzékeny hypersensitive 1. kórosan fokozott érzőképességű, 2. felfokozott
(allergiás) válaszadó olyan ingerre, amelyik szokványos érzékenységű emberben
nem vált ki választ.
alulérzékeny hyposensitive 1. csökkent érzőképességű, 2. ingerekre a szokásosnál
mérsékeltebben válaszoló.
érzékenyített sensitized érzékennyé
tett személy/rendszer, →immunizált.
érzékenyítés sensitization érzékennyé,
érzékenyebbé tevése valakinek, valamilyen rendszernek, például →immunizáció.
érzékenyítő sensitizer az
inger észlelését, hatását fokozó, →allergén.
érzékenység csökkentése desensitization az
érzőképesség csökkentése.
érzékenyülés érzékennyé válás,
→allergizálódás.
érzelem emotion lelki érzés; tükröződik benne az egyén viszonyulása a
valósághoz: bánat, boldogság, félelem, gyűlölet, hangulat, harag, indulat,
izgalom, kétségbeesés, szomorúság, szerelem, szeretet.
érzelemértelem az egyén képessége, hogy uralkodjon saját érzelmein,
felismerje mások érzelmeit, és így megfelelően tudjon együttműködni.
érzelemértetlenség alexithymia az
érzelmek felismerésének, tudatosulásának képtelensége.
érzelemhiány (apathy) közömbösség a lelki érzésekkel szemben.
érzelemszabályozás az
érzelmi élmények nagyságának vagy időtartamának változtatására alkalmazott
módszerek.
érzelemszabályozatlanság (emotional
incontinence) az érzelmi igénybevehetőség fokozott, a beteg nem tud uralkodni
érzelmein (pl. indokolatlan sírás, nevetés, kényszersírás). Szellemi leépülés
jele.
érzelemsivárság a lelki érzés elmebetegség miatti csökkenése –
szellemi leépülés jele.
érzelmi beszűkültség a tudat és a gondolkodás egyfelé irányulása heves
érzelmek/indulatok (szerelem, düh, előítélet) hatására.
érzelmi elhanyagoltság emotional neglect a gyermek lelki érzésének elégtelen gondozása.
érzelmi
felindultság módosult tudatállapot,
amelyben kizökkent a tudat; csökken az ingerek, behatások feldolgozásának
rendezettsége.
érzelemi ingatagság emotional lability gyors hangulatváltozásokra való hajlam; amelyek nincsenek arányban a
kiváltó hatással.
észlelés apperception az inger tudatossá (képzetté, fogalommá) válása; az
inger feldolgozása az elmével; több részből tevődik össze. Ez a felfogás
harmadik szakasza.
észlel
tudatosulva érzékel.
észlelet az észlelés eredménye.
észlelhető felfoghatóan érzékelhető.
Fc-kapcsolt fehérjék Fc-fusion proteins az immunglobulinok Fc-részével (Fc-töredék)
genetikailag összekapcsolt fehérjék (enzimek, peptidek, jelvivők, jelfogók
sejtkívüli részei). Az FC-rész az immunglobulin nehéz láncának a CH2,
CH3 gömbegységeit és a kapocsrészt tartalmazza. Az Fc-töredék
kapcsolása a fehérjéhez egyéb hatásokkal ruházza fel a fehérjét, például
megnöveli az élettartamát.
fehérje–fehérje kölcsönhatások protein–protein interactions, PPI két vagy több fehérje társulása; a sejtfolyanatok
mindegyikében bekövetkezik. Három alapformájuk ismert:
▪ felszíni
illeszkedés* surface–surface interaction a két fehérje felszini
domborzata illeszkedik egymásba, mint a kulcs a zárba. Rendkívül fajlagos,
viszonylag erős kapcsolódás.
▪ csavarmenetes illeszkedés*
helix–helix interaction a társuló fehérjék egy-egy csavarmenete
illeszkedik egymásba, fonadékot (coiled coil) képezve. Erős kapcsolódás;
jellemző a génműködést szabályozó fehérjék kötődésére. (→fehérjealakzatok)
▪ hurokágyazódás*
surface–string interaction az egyik fehérje kiálló hurka (aminosavlánca)
belefekszik a másik fehérje felszíni vájatába. Általában a foszforilezendő
gomolyok megnyúlt aminosavlánca kötődik így, pl. SH2 gomoly tirozonsora a
foszforilező fehérje vájatába.
fehérjemódosítás* (más néven: átfordításkövető módosítás) post-translational protein modification az eredetfehérje (az átfordítással keletkező vonalas
fehérje) szerkezeti változtatása, aminek következtében megfelelően hajtékolttá
és tevékennyé válik. Ez határozza meg a fehérje helyét a szervezetben és a
feladatát. A működőképes fehérjét kialakító fehérjemódosítás a
sejtcsövecsezetben megy végbe; magában foglalja a hajtékolást, a hatáscsoport,
szénhidrát, lipid stb. kapcsolását, S–S- és más kötések kialakulását,
fehérjehasítást, acetilezést, foszforilezést, metilezést stb. Több mint
százféle módosítás ismert, utalva ennek fontosságára.
felfogásSP perception az
észrevevés, az érzékelés és az észlelés együttese. A felfogás tevékeny
folyamat: az inger érzékszervi és agyi feldolgozása; az utóbbiban korábbi
ismeretek, nyelvi sajátságok és beállítódások vesznek részt. (→érzékelés, észlelés, észrevevés)
fordítódás inversion a biológiában valamely biológiai elem (bázis, ismétlet
stb.) megfordulása úgy, hogy fordított sorrendben látszódjék. (→bázismásulás)
forgás rotation a
hagyományos fizikában valamely test tengelye vagy középpontja körüli mozgása, a
forgatónyomaték hatására jön létre. A test minden pontja a forgástengely
(középpont) körül mozog. A forgás nem egyenes irányú, hanem a tengellyel szöget
(ω) bezáró mozgás.
Háromféle fizikai forgást különböztethetünk meg:
▪ A tengely körüli forgás a testnek a rögzített tengelye körüli körbeforgása; a test
minden pontja a tengelye (forgástengely) körüli körpályán mozog. A
forgástengely irányát a jobb kéz hüvelykujja mutatja, ha az ujjakat a forgás
irányába állítjuk, a hüvelykujjat 90°-ban kinyújtjuk a kézfej többi részéhez
képest. A tengely irányát nyíllal jelöljük, a nyíl annál hosszabb, minél
gyorsabb a forgás.
▪ A pontszerű forgás a középponthoz
(forgáspont) rögzített test körbeforgása. Például a középponthoz zsinórral
erősített labda körforgása. Ez is tengely körüli forgás, csak a tengely időben
változik
▪ A pörgettyű a test egy pontján
rögzített forgómozgás.
A
forgásirányt a jobb kéz szabállyal állapíthatjuk meg: ha ujjainkat a forgás
irányába hajlítjuk, a hüvelykujj mutatja az irányt.
forgásmennyiség (perdület) a forgó
test forgásának mennyisége, a test forgásállapotát jellemző iránymennyiség. A
tehetetlenségi nyomaték és a szögsebesség szorzata. Jele: N, mértéke: θ × ω. Mértékegysége: kg × m2
× 1/s.
Zárt tér összes perdülete állandó, azaz a
perdület csak külső erő hatására változik meg. Ez a perdület megmaradásának
törvénye.
forgássebesség a fordulatidővel és a fordulatszámmal
fejezzük ki. Egy teljes kör megtétele a fordulat (revolution). Egy fordulat
megtételéhez szükséges idő a fordulatidő (periódusidő); jele: T. Az
időegység alatti fordulatok száma a fordulatszám; jele: f; szokásosan a
percenkénti fordulatszámot adjuk meg.
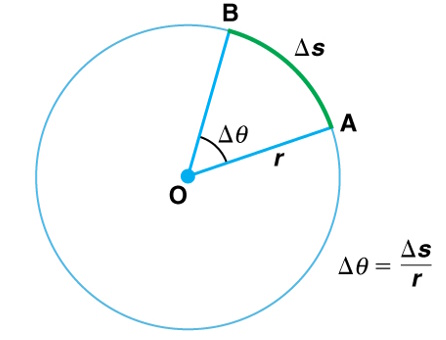 forgásszög rotational angle az elfordulás nagysága, amely megfelel a forgó test
által megtett szögfordulásnak. Jele: Δθ; egyenlő Δs
/ r (a Δs az ívhossz [a forgó test által megtett körívnek a hossza], az r
a kör sugara [radius]). (Az ábrát Teleki Katalin készítette.) (→kör)
forgásszög rotational angle az elfordulás nagysága, amely megfelel a forgó test
által megtett szögfordulásnak. Jele: Δθ; egyenlő Δs
/ r (a Δs az ívhossz [a forgó test által megtett körívnek a hossza], az r
a kör sugara [radius]). (Az ábrát Teleki Katalin készítette.) (→kör)
szöggyorsulás angular acceleration a szögsebesség időbeli változásának a gyorsasága. Jele: β, mértéke: Dω
/ Dt (a Dω a szögsebesség megváltozása, a Dt a
megváltozás időtartama. Mértékegysége: 1/s2.
szögsebesség angular/rotational velocity a szögelfordulás időbeli változási sebessége. Jele: ω;
mértéke: Δθ / Δt (a Δθ a forgásszög változása, a Dt a változás időtartama). Mértékegysége: 1/s.
forgástengely (tengely) a forgó testnek a mozdulatlanul maradó
vonala; a test ekörül forog.
foszforilezés phosphorylation foszforilcsoport (PO32−,
foszfátion) átvitele egyik molekuláról a másikra, szokásosan fehérjékre. A
foszforilezést a fehérje-kinázok (foszforilázok) végzik külső vagy sejten
belüli jelzésre. Az enzim az ATP γ-helyzetű foszfátcsoportját köti meg, és
kapcsolja a célfehérje oldalláncának az aminosavak sorrendje alapján
meghatározott OH-csoportjához, észterkötéssel. Más OH-csoportok nem
foszforileződnek. Az ATP bontásakor nagy energia (∼30 kJ/mol) szabadul fel, ez segíti a
foszfát kötődését. A foszforilezés
hatására változik a fehérje töltésállapota, térszerkezete (új kapcsolódási
mintázat keletkezhet), megváltoztatva a fehérje tevékenységét. (→enzimek)
Előadódik, hogy a foszforilezési mintázat nem elég hangsúlyos, és az enzimnek
más része foszforileződik, ezért nem következik be a kívánt hatás, vagy éppen
más irányú lesz.
A foszforilezés a fehérjék működésének egyik
leggyakoribb és rugalmas szabályozója; a foszforilezett fehérjék többsége
tevősödik, de tétlenné is válhat. Visszafordítható folyamat (a foszforilcsoport
könnyen eltávolítódik a foszfatázok segítségével), lehetővé téve rugalmas
szabályozást (defoszforilezés). Az emberi szervezetben kilencféle aminosav
(aszpartát, glutamát, cisztein, arginin, lizin, hisztidin, szerin, treonin,
tirozin) foszforileződhet, de ezek közül csak a szerin, treonin és a lizin
marad állandó (csak az O–P észterkötés tartós), a többiben a kötés gyorsan
felbomlik.
Fontos szerepe van a foszforilezésben az enzim
kötőhelyének; ez ismeri fel és kapcsolja a célfehérjét, teszi lehetővé, hogy a
sarkallógomoly a foszforilezési mintázatnak megfelelően adja át a
foszforilcsoportot. A kötőhely lehet a sarkallógomolyban, de az enzim más
részén is. Egy-egy fehérje több kötőhelyéhez is kapcsolhatja a célfehérjét. Pl.
az ERK2, amelynek két kötőhelye van: az egyik a
sarkallógomoly mögött (általános kötőhely), a másik közvetlenül alatta. Az
általános kötőhelyet a lizin, az arginin és még legalább két semleges aminosav
észleli. Kapcsolódik hozzá az ERK2-t foszforilező (a láncfolyamatban előtte
lévő) fehérje, valamint a jelközvetítésben utána lévő fehérje, amelyet az ERK2
foszforilez. Ide kapcsolódik még az MKP3 is; ez defoszforilezi, bénítja az
ERK2-t. A célfehérjék közé tartozik az ELK1,
amelyet az ERK2 a sejtmagban foszforilez. A másik kötőhelyet a KSR1 nevű
állványfehérje és két átírásfehérje (cFOS,
ELK1) ismeri meg, ezek a sejtplazmában vannak. A kötőhelyekhez tehát többféle
fehérje is fűződhet; ezek versengnek egymással. Hogy végül melyik kötődik
(merre megy a láncfolyamat), függ az ERK2 helyzetétől (a sejtplazmában vagy a
sejtmagban van-e), bizonyítva, hogy a kötőhely is meghatározó a
láncfolyamatban. Előfordul, hogy a kötőhely nem a
megfelelő fehérjét kapcsolja, pl. ugyanazt a mintázatot hordozó enzimcsalád
másik tagját, ami megváltoztathatja a jelközvetítést.
autofoszforilezés a fehérje saját magát foszforilezi. Például a kettős
ATM-fehérje egyike kapcsolódik NSB1-hez, megváltozik a szerkezete, és
foszforilezi saját magát, aminek hatására a másik elválik.
defoszforilezés a foszforilcsoport eltávolítása, például az ATP-nek
ADP-vé és foszfátionná (PO43-) alakítása.. A foszfatáz
(foszfoprotein-foszfatáz) enzim végzi: a szerin-/teonin-/tirozin-PO4 észterkötést
bontja vízfelvétellel, szerin-/teonin-/tirozin-OH + PO4 keletkezik.
foszforilezési hely phosphorylation
site a fehérjének az a törzsökös
aminosavsora, amelyen foszforileződik, lehetővé téve, hogy a fehérje be- vagy
kikapcsolódjék. A foszforilezési hely tehát a fehérjének szabályozó része. A
foszforileződő aminosavat foszforilezési mintázat* veszi körül, amely
vonalas aminosavsor (linear motif; nevezik phosphosite-nak is); a
fehérje-tirozin-kinázok rendre ezt ismerik fel, ennek megfelelően
foszforileznek. A vonalas mintázatok szokásosan rövidek (short linear motif,
SLiM), 5–10 aminosav-maradékból állnak. A SLiM, magyarul rövid vonalmintázat*,
törzsökös aminosavsor, amely közvetítő a fehérjekapcsolatokban, a
sejtfolyamatok szabályozásában és a sejt elhelyezkedésében. A foszforilezési
hely hibája (pl. a SLiM megváltozása miatt) lehetetlenné teszi a fehérje
foszforileződését, a szabályozást, ezért sejtkárosításhoz, betegségek
kialakulásához vezet.
functional ■ functional group →hatócsoport ■
functional (group) isomerism →szerkezeti azonmásság
gén-alulátírás
dowregulation, underexpression a
gén szükségesnél ritkább átírása.
gén-alulkifejeződés, géncsendesítés gene underexpression, gene silencing kevesebb géntermék keletkezése. Lehet gén-alulműködés
vagy az RNS-ek tevékenységi zavarának (például a gátlófehérjék fokozott hatásának) következménye. A csökkent kifejeződés szintén sejtműködési
zavarokat, betegséget okozhat. (→génkifejeződés)
génátírás transcription a DNS génszakaszának átírása RNS-sé; az RNS
bázissorának kialakítása az adott DNS-szakasz bázissora szerint. Azonos a
génműködés fogalmával. A fehérjét képező gének átíródásából elő-mRNS, a
fehérjét nem kódolókból nem fehérjeképező RNS-ek (noncoding RNAs) keletkeznek.
Az RNS bázissora mindig az adott DNS-szakasz (gén)
kettős szálának egyikéről másolódik. Azt a DNS-szálat, amely átíródik,
mintafelületnek (template) nevezzük. Mivel csak kiegészítő bázisok
kapcsolódhatnak egymással, az RNS bázissorrendje teljesen azonos lesz az adott
gén másik DNS-szálának bázissorrendjével, azzal a különbséggel, hogy a timin
helyett az RNS-be mindig uracil épül be. Megegyezés alapján azt a DNS-szálat,
amelynek bázissorrendje megegyezik az RNS bázissorrendjével, kódoló vagy
pozitív (sense, értelmes) szálnak, a mintául szolgáló pedig negatív (antisense,
értelmetlen) szálnak mondjuk. Egy gén bázissorrendjének leírásakor a kódoló
DNS-szál bázissorrendjét adjuk meg (5’–3’ irányban), mivel ez határozza meg a
fehérjeképződést.
Egyes gének kódoló szála a DNS-lánc egyik szálán, más
géneké a DNS-lánc másik szálán van, attól függően, hogy a gén a DNS-ben milyen
irányultságú. Egy-egy génben azonban mindig ugyanaz a szál íródik át; nem
fordul elő, hogy egyazon génnek egyszer az egyik DNS-szála a kódoló, másszor a
másik.
A génátíráskor a polimeráz folyamatosan írja át a gént
újra és újra a sejt szükséglete szerint. Ezt irányító rendszerek (erősítők,
csendesítők stb.) szabályozzák
génkifejeződés gene
expression az a folyamat, amelyben a gén genetikai üzenete önálló működő
termékké (product), mint például fehérjévé, szabályozó RNS-sé válik. A
génkifejeződés vegyi folyamatok sorozata, amelyben a génátírásból keletkezett
molekula, a génátirat (transcript), további folyamatokkal válik termékké,
például az elő-mRNS érett mRNS-sé, majd átfordítással polipeptiddé, további
módosulással fehérjévé. Ezért nevezzük a génátírás „közvetlen termékét”, az
elsődleges RNS-t, átiratnak, nem pedig terméknek. Az átiratból (transcript)
mindig kisebb-nagyobb módosulással lesz a termék.
A génkifejeződésnek több eleme
van: a kromatinmódosulás, génátírás, átíráskövető változások (post-transcriptional
modifications); fehérjeképződésnél az átfordítódás, az átfordítást követő
módosítások (post-translational modifications) és az mRNS lebontása. A
génkifejeződés szabályozása végtelenül pontos, a legkisebb hiba a sejtműködés
zavarához, a sejt halálához vezet. Vonatkozó nevezetek: (→gén-alulkifejeződés, géntermék, géntöbbesedés, gén-túlkifejeződés)
génmásulás*
gene mutation, gene variant DNS kódoló szakaszában
bekövetkező másulás. Lehet:
■ A gén szerkezete szerint lehet:
▪ A bázissor változásának a
következménye. (→pontmásulás)
▪ Ismétlettöbblet, a génben lévő rövid ismétletek többesedése, mert megváltoztathatja
a keletkező RNS-t, fehérjét.
■ A génmásulás következményei szerint háromféle lehet:
▪ Géneltérés,
amely betegséget, fejlődési rendellenességet nem okozó génmásulás. Az általa
kódolt RNS, fehérje képes megfelelően ellátni az azonos törzsgén által képzett
RNS, fehérje feladatát. Lehet előnyös is, ha a törzsfejlődés, a környezethez
való alkalmazkodás következtében jön létre, és állandósul az egyén megmaradása
érdekében.
-
Alapító géneltérés (founder
mutation); valamely népességben jellegzetes géneltérés.
▪ Génhiba,
amelynek kifejeződése fejlődési rendellenességet vagy más betegséget okoz. Az
általa kódolt RNS, fehérje nem képes megfelelően ellátni az eredeti RNS,
fehérje feladatát.
-
Alapító génhiba (founder
mutation) valamely népességben jellegzetes, betegséget okozó génmásulás.
- Géntömeghiba (ultramutation); valamely ráksejtben a különböző génhibák halmozott előfordulása (ultramutated
cells, géntömeghibás sejtek). Ilyenek például a POLE-hibás sejtek. A nemzetközi
irodalomban találkozunk a hypermutated jelzővel, magyarul: fokozottan
génhibás; ilyen például a HR-hiányos ráksejt. A hyper- és ultramutated
jelzők megkülönböztetését azonban nem számszerűsítették. (→méhtestrák)
- Rákképződésre hajlamosító másulás
olyan csirasejtes génhiba, amely, ha megnyilvánul, rák kialakulásához
vezethet. Például a BRCA gén hibái emlő- és/vagy petefészekrákhoz.
■ Keletkezési helye szerint lehet:
▪ Örökletes (csírasejtes) génmásulás* (germline [hereditary] mutation) a csírasejtekben lévő
géneltérés/génhiba. A pete- vagy az ondósejttel, esetleg mindkettővel
öröklődik, és jelen van az utód mindegyik sejtjében.
A génhiba az anyai
vagy apai testi kromoszómákkal öröklődik: az érintett szülőből véletlenszerűen
adódik tovább az utódba a kóros vagy az ép gén, vagyis 50% valószínűsége van
annak, hogy valaki a kóros vagy az ép gént örökölje.
Az öröklődött kóros
gén lappangó: az ép párja ellensúlyozza; arról képződik az ép fehérje, ezért a
szervezetben nem okoz eltérést – „észrevehetetlen”. Megnyilvánulásához „második
behatás” (second hit [Knudson-féle two-hit elv]) is szükséges; nevezetesen,
hogy a sejtben a gén válzata (ép párja) elvesszen (válzatvesztés) vagy
hatástalanná váljék (működésvesztés). Szemben a BRCA-hiányos szórványos
daganatokkal, amelyekben az indító metilezése (a gén elnémítása) csaknem
mindig előfordul, az örökletes változatoknál ez nagyon ritka, leggyakoribb a
válzatvesztés.
▪ Szerzett (testi) génmásulás* (acquired [somatic] mutation) a fogamzás után
keletkező génmásulás; a sejtosztódással átadódhat a leánysejtekbe. Létrejöhet
környezeti hatásokra, osztódási zavarként stb.
■ A másult gének száma
szerint lehet:
▪ Egygénes másulás; egyetlen gén másulásából adódó
elváltozás, betegséghajlam, betegség (egygénes betegség).
▪ Többgénes másulás; több gén másulásából adódó elváltozás,
betegséghajlam, betegség (többgénes betegség). A rosszindulatú daganatok mind
ilyenek.
▪ Túlmásulás (hypermutation), olyan sokgénes másulás,
amelyben a másulások száma 11–100 megabázisonként. Ráksejtekben fordul elő.
▪ Halmozott másulás (ultramutation), olyan sokgénes másulás,
amelyben a másulások száma >100 megabázisonként. Ilyenek például a
POLE-hibás sejtek; általában a HR-hiányos ráksejt.
▪ Másulásteher (tumor mutational burden, TMB) a daganatsejtekben előforduló
DNS-másulások teljes száma. (→másulásteher)
■ Ismeretlen
jelentőségű génváltozás* (variant of unknown significance;
VUS) a törzsgéntől való olyan eltérés, amelynek jelentősége még nem tisztázott.
géntöbbesedés gene
amplification valamely gén
sokszorozódása (számbeli növekedése); ugyanabból a génből egy kétszerelvényű
sejtben három vagy több van. Szokásosan több termék keletkezik; ez a genetikai
bizonytalanság egyik formája, ráksejt kialakulásához vezethet. A daganatokban,
rákokban igen elterjedt, de kialakulhat ép sejtben is. A proto-onkogén
többesedésekor szintén ez a helyzet.
Keletkezhet
géntöbbesedés a fokozó túlműködése vagy éppen a csendesítők gátoltsága,
illetőleg átírásirányítási hatások, például fokozott metilezés,
hisztonacetilezés stb.) következményeként.
gén-túlátírás
upregulation, overexpression a
gén szükségesnél gyakoribb átírása.
gén-túlkifejeződés gene
overexpression a géntermék túlzott
képződése. Lehet géntöbbesedés, a szabályozó molekulák (például több fokozó,
kevesebb csendesítő/gátló (silencer) molekula) vagy átírásirányítási hatások (például
fokozott metilezés, hisztonacetilezés) következménye. Kóros mennyiségű
géntermék sejtműködési zavart, betegséget okozhat, ráksejt is keletkezhet.
glikozid glycoside
olyan egyszerű szénhidrát, amelyik az anomer szénatomján alkohollal vagy
fenollal kapcsolódik össze – az alkohol másik egyszerű szénhidrát is lehet. A
másik molekula a cukor glikozidos OH-csoportját helyettesíti. A nem szénhidrát
összetevőt aglikonnak nevezzük; a glikozid tehát cukor + aglikon). A glikozidok
nevei -id végződésűek: az egyszerű cukor nevéhez illesztjük a végződést:
glükóz – glükozid; galaktóz – galaktozid.
glikozidos kötés glycosidic bond gyűrűs szénhidrátot kapcsoló
elektronkötés. A gyűrűs szénhidrát OH-csoportja kötődik vízkilépés mellett egy
másik vegyülethez. Két szénhidrát társulásakor az egyik 1’-szénatomja a másik
4’ – ritkábban a 6’– szénatomjának hidrogénjével társul (C–OH + H-C → –C–C–); a
6’-szénatommal társuláskor elágazik a cukorlánc. Két OH-csoport kapcsolódásakor
O-glikozidok keletkeznek (C–OH + OH–C → –C–O–C–). Az N-glikozidokban az
OH-csoport aminocsoporttal/iminocsoporttal kötődik (C–N kötődés). A glikozidos
OH-csoport térhelyzete szerint megkülönböztetünk α-, és β-glikozidkötést, pl. a
ribóz az RNS-ben vagy a dezoxiribóz a DNS-ben a bázissal β-N-glikozidos
kötéssel kapcsolódik.
glikozidos OH csoport A szénhidrátgyűrűnek a glikozidkötésben résztvevő
OH-csoportja; vegyileg másként viselkedik, mint a többi. A ribóz és
dezoxiribózban az 1’-szénatomon lévő OH-csoport a glikozidos hidroxilcsoport.
glikozil glycosyl a glikozid cukorösszetevőjének
OH-csoport elvonásával keletkezett gyöke. Ha a cukor glükóz, a gyök glükozil.
glikozilezés glycosylation
szénhidrát kapcsolása másik (nem
szénhidrát) molekulához, leginkább a másik molekula OH-csoportjához, de
kötődhet más, pl. aminocsoportjához is. A biológiában legtöbbször azt az
enzimfolyamatot jelöli, amelyben glikán kapcsolódik fehérjéhez. A szénhidráttal
kapcsolt vegyület a glikozidos (glycosylated) vegyület; ellentéte a nem
glikozidos (nonglycosylated) vegyület. (→glikán, szénhidrát)
GLTSCR1 (
g
lioma
tumor
suppressor
candidate
region
gene 1 protein) fehérje azonos a BICRA fehérjével. (→BICRA)
gyógyszerbesugárzás*
chemoradiation (kemoradiáció) olyan sugárkezelés, amellyel egyidejűleg gyógyszert
is adunk. A gyógyszer főleg a besugárzás hatékonyságát fokozza, de önmagában is
pusztítja a ráksejteket. A kettő együttes hatása többletes (synergic, szinergikus).
Nagyon sokféle daganat kezelésére alkalmazzák. A társított gyógyszer is
többféle, leginkább heti 40 mg/m2 ciszplatin adását javasolják. Ez
hatásosabban fokozza a sugárhatást, mint a 3 hetente adott ciszplatin. A
javasolt sugármennyiség legalább 55 Gy 25 részletben. Adható bevezető
kezelésként előrehaladt daganat eltávolíthatóvá tételére (neoadjuvant chemoradiation),
de alapkezelésként is.
gyorsulás acceleration a sebességváltozás aránya: mennyire változik a
sebesség bizonyos idő alatt, pl. másodpercenként. Egyenlő a sebességváltozás (Dt)
és az idő hányadosával. Jele: a = Δv / t (Δv = vf – vi;
f végső [final], i kezdeti [initial] sebesség; t időszak). SI-egysége: m/s (m =
méter; s másodperc [secundum]).
szöggyorsulás angular
acceleration egységnyi idő alatt végbemenő szögsebesség-változás.
gyulladásállapot* low grade systemic inflammation a
szervezet olyan állapota, amelyben a gyulladáskor keletkező molekulák (IL6,
IL1β, IL18, CRP- [high-sensitivity C-reactive protein] TNFα stb.) és sejtek
(fehérvérsejtek, egymagúak, nagyfalósejtek stb.) felszaporodnak, de a
gyulladásra jellemző panaszok, tünetek és szövetelváltozások (fájdalom,
duzzadás, pír, láz) nem alakulnak ki; ezért nem nevezzük gyulladásnak. A
keringéssel szállított gyulladásmolekulák befolyásolják más sejtek működését,
és előbb-utóbb kóros elváltozásokhoz, betegséghez vezetnek (→szív- és érbetegségek). Jellemzi a gyulladásállapotot a szabadgyökök képződése és az
immunfelügyelet csökkenése is; mindkettő elősegíti a rákképződést.
Gyulladásállapotot okoz a zsírtöbblet, a rosszindulatú daganatok, a
szövetelhalások, az idült fertőzöttség, az állandósult allergia, de ide sorolják
az öregséget is.
A gyulladásállapot klinikailag nem vehető észre;
szokásosan laboratóriumi vizsgálatokkal, a szérumban lévő gyulladásjelzőkkel
kórismézzük. Ezek közül a CRP a legjelentősebb, amelyet az FVS
(fehérvérsejtszám) jól kiegészít. Közéjük tartoznak még az IL6 és a TNFα, és a
szabaddá vált adhéziós molekulák (VCAM1, ICAM1, E-szelektin) mérése is.
Jellemző a gyulladásállapotra még a csökkent HDL-koleszterin-szint.
Hagen–Poiseuille-törvények Hagen–Poiseuille-egyenlet,
Poiseuille’s equation (→folyadékáramlás)
halmozott
másulás ultramutation (→génmásulás)
hatócsoport functional group (funkciós csoport) a szerves
molekuláknak az a legkisebb része, amely meghatározza a molekulák részvételi
módját a vegyi folyamatokban – egyfajta hatócsoport jóformán mindig ugyanúgy
hat. A hatócsoport kizárólag elektronkötéssel fűződik a molekulához. Azt a
szénatomot, amelyhez kötődik, 1-es vagy α-szénatomnak nevezzük. Egyes kisebb
hatócsoportok részei lehetnek a nagyobbaknak, pl. a karboxilcsoport (COOH) a
karbonil (C=O) és a hidroxilcsoport (OH) együttese. A gyakoribb hatócsoportok a
szénatomhoz kapcsolt atomok/molekulák és a kötések száma szerint:
| Csak szénatomot tartalmazók |
alkil (R1–C–C–R2), alkenil (R–C═C), alkinil (R–C≡C) |
| Csak szénatomot és hidrogént tartalmazók |
metil (R–CH3), etil (R–CH2–CH3), fenil (fenilgyűrű) (R–C6–H5) |
| Szénatomot és halogént tartalmazók |
halogenid (R–C–F, R–C–Cl stb.) |
| Szénatomot és oxigént tartalmazók |
|
| ▸ szén–oxigén egyszeres kötés |
hidroxil (alkoholos) (R–C–OH), éter (alkoxil) (R1–C–O–C–R2) |
| ▸ szén–oxigén kettőskötés (oxocsoport) |
formil (H–C═O), karbonil (aldehid)  , karbonil
(keton) , karbonil
(keton)  |
| ▸ szén–oxigén egyszeres és kettőskötés |
karboxil  , észter , észter 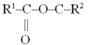 , foszforil , foszforil 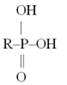 |
| ▸ anhidridek |
karbonsavanhidrid 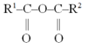 , vegyes savanhidrid , vegyes savanhidrid 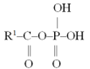 (pl. karbonsav, foszforsav, acil-foszfát) foszforsavanhidrid (pl. karbonsav, foszforsav, acil-foszfát) foszforsavanhidrid 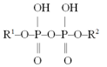 |
| Szénatomot, oxigént
és nitrogént tartalmazók | amido 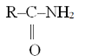 |
| Szén- és nitrogénatomot tartalmazók |
amino (R–C–NH2), imino (R–C=NH), nitril (cianid) (R–C≡N) guanidino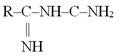 , imidazol , imidazol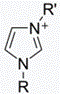 |
| Szénatomot és ként tartalmazók |
szulfhidril
(R–C–SH), tioéter (szulfid) (R–C–S–C ), tioészter 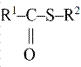 , szulfonsav (R–C–SO3H),
diszulfid (R1–S–S–R2) , szulfonsav (R–C–SO3H),
diszulfid (R1–S–S–R2) |
Ezeknek a hozzájuk kapcsolódó oldalláncok
szerint nagyon sokféle származéka fordul elő, melyeknek a megnevezését a
hatócsoport és az alapszénhidrogén elnevezésének összekapcsolásával alakították
ki. A biológiai hatású vegyületeknek többféle hatócsoportja is lehet, sőt
felfoghatók a hatócsoportok együtteseként is, pl. hisztidin: 2-amino-3-(1H-imidazol-4-il)
propánsav, amelyben amino, imidazol és karboxil hatócsoport van. A szerves
vegyületek végtelen sokaságát a hatócsoportok szerint rendezzük osztályokba.
havibaj menstruation (havi vérzés,
menstruáció)
a méhnyálkahártya szakaszos, többé-kevésbé havonkénti lelökődése vérzés
kíséretében. Oka a hormonok (progeszteron) képződésének csökkenése a sárgatest
visszafejlődésének következtében. Jelzi, hogy nem történt fogamzás. Két havibaj
közti idő a vérzésköz* (ciklus).
hisztonkötött DNS dyad position a hisztonmag körüli DNS;
ellentétben van a magtestecskék közötti összekötő DNS-sel.
inclusion
cyst (inklúziós ciszta) →zártömlő
indítóössztes preinitiation
complex, PIC (preiniciációs
komplex) az indítómagon kialakuló hat
általános átírásfehérje (TFIId, TFIIa, TFIIb, TFIIf,
TFIIe és TFIIh; TF = transcription factor) és a polimeráz-II együttese,
amely a fehérjekódoló gének átíródásához szükséges. Ez helyezi a polimeráz-II-t
az átírási kezdőhelyre, nyitja meg az indítómag kettős DNS-szálát, és helyezi a
mintafelületet a polimeráz-II átíró részéhez, elkezdve az átíródást. (→indító)
▪ TFIId (átírásfehérje-IId). A TBP-t (TATA
box-binding protein) és 13 TBP-társult fehérjét (TBP-associated factor, TAF), a
TAF1–13-t tartalmazza. A TAF4, TAF5, TAF6, TAF9,TAF10
és TAF12 fehérjéből kettő van, ekként egy 20 alegységes összlet jön létre;
molekulatömege 1,3 MDa. A polimeráz-II általi génátírásban vesz részt.
TBP (TATA box-binding protein, TATA binding protein) a
TFIId törzsökös alegysége. Két ismétletből áll, amely nyeregszerű szerkezetet
létrehozva kötődnek a TATA-dobozhoz, pontosabban annak két végén lévő TFIIb-t
felismerő elemhez (BREu és BREd). A kötődéssel megnyílik a DNS-szál, mert TBP
aminosavainak oldalláncai benyomulnak a bázispárok közé. A TBA (TFIId) azonban
a TATA-doboz nélküli indítómagokhoz is kapcsolódik az indítómag felső részéhez,
amelyet TBP-kötő helynek (TBP binding site) nevezünk. Továbbá a TBA
nemcsak a polimeráz-II, hanem a polimeráz-I és polimeráz-III általi átírásban
is részt vesz.
TAF (TBP associated factor) a TBP-vel
kötődő fehérje. 13 ismert, ezek állékony összletet, a TFIId-t hozzák létre.
Törzsökös fehérjék; a magsejtes fajokban őrződtek meg.
Az indítóössztes kialakuláskor a TFIId és a TFIIb
kapcsolódik egymással, és kötődik az indítómaghoz, toborozva a TFIIa-t. A TFIId
állványfehérjeként vesz részt a TFIIb és a TFIIa rögzíti az indító maghoz. Alapjában
a TFIId BPA alegysége kötődik a TATA-doboz szélein lévő BREu-hoz és BREd-hez. A
TBA önmagában azonban nem elegendő az átírás indításához. A TATA-doboz nélküli
inditómagban a TBP (TFIId) a TBP-kötő helyhez fűződik. A TFIId alsó széle a DPE
elemmel társul; így hídalja át az átírási kezdőhelyet. A TFIId–TFIIb–TFIIA köti
a polimeráz-II-t és a THIIf-et, majd a TFIIe és TFIIh kötődik hozzájuk.
insertion–deletion loop (IDL) beékelődés-elvesztés
hurok (→bázismásulás)
International
Ovarian Tumour Analysis (IOTA) a
függelékképletek jó- vagy rosszindulatú voltának megállapítására szolgáló ultrahangvizsgálati
módszer. A képlet ultrahanggal látható jellegzetességeit elemzik. Ezek a
következők:
◾ Képlet:
egyosztatú, tömött egyosztatú,
többosztatú, tömött többosztatú, tömött.
◾ Tartalom: hangárnyékmentes,
hangárnyékszegény, egynemű, közepesen echogén, bevérzéses vagy kevert.
◾ Szerkezet: tömött
anyag, szemölcsös szerkezet vagy fali egyenetlenség (jelenléte és mérete).
◾ Tömött összetevő: olyan
hangárnyékoltságú képlet, amely szövet benyomását kelti. A kásadaganat (dermoid)
fehér tömött képlete nem tömött szövet, miként a véralvadék és a nyákos szövet
sem.
◾ Fal: a
3 mm-nél nagyobb kiemelkedés a szemölcsös növedék; ha a kinövés kisebb, mint 3
mm, fali egyenetlenségnek mondjuk.
◾ Szabálytalanság: lehet
szabálytalan a belső fal vagy egy tömött képlet körvonala.
◾ Hasvíz: olyan
kóros mennyiségű szabad folyadék, amely a kismedence fölé ér.
◾ Erezettség
pontozása: nincs erezettség = 1, csekély erezettség = 2,
közepes erezettség = 3, teljes erezettség = 4
◾ Színkódolt
áramlás vizsgálat: nincs áramlás = 1, csekély áramlás = 2, közepes áramlás
= 3, erős áramlás = 4
Az értékelést szabályok
szerint végzik, megkülönböztetve M-szabályokat, B-szabályokat és egyszerű
szabályokat.
Az
IOTA szabályai
(4):
■
M-szabályok (rosszindulatú [malignant] elváltozásra utaló jellegzetességek; M-jellegzetességek):
•
szabálytalan szerkezetű tömött daganat,
• legalább
négy szemölcsös növedék,
• hasvíz,
•
szabálytalan többosztatú tömött részeket tartalmazó daganat, melynek legnagyobb
átmérője legalább 100 mm,
• nagy
sűrűségű színtartalom színkódolt keringésvizsgálatnál.
■ B-szabályok (jóindulatú [benign]) elváltozásra utaló jellegzetességek; B-jellegzetességek):
• egyosztatú
tömlő,
• amennyiben
tömött rész fordul elő, annak legnagyobb átmérője nem nagyobb 7 mm-nél,
• hangárnyék
jelenléte,
• sima
felszínű többosztatú daganat, amelynek átmérője nem nagyobb 100 mm-nél,
• nincs
számottevő keringés színkódolt keringésvizsgálattal.
■
Egyszerű szabályok
• Első szabály. Amennyiben egy vagy több
M-jellegzetesség van jelen és B-jellegzetesség nem található, a daganatot
rosszindulatúnak ítéljük.
• Második szabály. Amennyiben egy vagy
több B-jellegzetesség van jelen és nincs M-jellegzetesség, a daganatot
jóindulatúnak ítéljük.
• Harmadik szabály. Amennyiben M- és
B-tulajdonságok is előfordulnak, a vizsgálat bizonytalanul értékelhető; második
vonalbeli képalkotó vizsgálat javasolt.
A
módszer hatékonyságát előre tekintő
vizsgálatsorozatban bizonyították, ami azt
jelenti,
hogy az ultrahangvizsgálat kellő gyakorlat birtokában képes elkülöníteni a
rosszindulatú függelékképletet a
jóindulatútól. (→függelékképlet)
IOTA
(International Ovarian Tumour Analysis) hüvelyi
ultrahangvizsgálatkor alkalmazott rendszer a függelékképlet jó- vagy
rosszindulatú voltának megkülönböztetésére (érzékenység 93, fajlagosság 80%,
negatív előrejelző érték 0,99).
Az IOTA
alapvető ultrahangvizsgálati elemeket rendszerez:
Képlet: egyosztatú,
tömött egyosztatú, többosztatú, tömött többosztatú, tömött.
Tartalom: echomentes,
echoszegény, egynemű, közepesen echogén, bevérzéses vagy kevert.
Szerkezet: tömött
anyag, szemölcsös szerkezet vagy fali egyenetlenség (jelenléte és mérete).
Tömött
összetevő: olyan echogenitású képlet, mely szövet benyomását kelti. A kásadaganat
(dermoid) fehér tömött képlete nem tömött szövet, miként a véralvadék és a
nyákos szövet sem.
Fal: a
3 mm-nél nagyobb kiemelkedés a szemölcsös növedék; ha a kinövés kisebb, mint 3
mm, fali egyenetlenségnek mondjuk.
Szabálytalanság: lehet
szabálytalan a belső fal vagy egy tömött képlet körvonala.
Hasvíz: olyan
kóros mennyiségű szabad folyadék, mely a kismedence fölé ér.
Erezettség pontozása:
nincs erezettség = 1, csekély erezettség = 2, közepes erezettség = 3, teljes
erezettség = 4
Színkódolt
áramlás vizsgálat: nincs áramlás = 1, csekély áramlás = 2, közepes áramlás
= 3, erős áramlás = 4
Megkülönböztetek
M- és B-jellegzetességeket:
M-jellegzetességek (ezek rosszindulatúságra utalnak):
• szabálytalan szerkezetű tömött daganat,
• legalább négy szemölcsös növedék,
• hasvíz,
•
szabálytalan többosztatú tömött részeket tartalmazó daganat, melynek legnagyobb
átmérője legalább 100 mm,
• nagy sűrűségű színtartalom színkódolt keringésvizsgálatnál.
B-jellegzetességek (jóindulatú elváltozásra utalnak):
• egyosztatú tömlő,
• amennyiben tömött rész fordul elő, annak legnagyobb
átmérője nem nagyobb 7 mm-nél,
• hangárnyék jelenléte,
• sima felszínű többosztatú daganat, amelynek átmérője nem
nagyobb 100 mm-nél,
• nincs számottevő keringés színkódolt keringésvizsgálattal.
A lelet értékelését egyszerű
szabályok segítik:
• Első szabály. Amennyiben egy
vagy több M-jellegzetesség van jelen és B-jellegzetesség nem található, a
daganatot rosszindulatúnak ítéljük.
• Második szabály. Amennyiben
egy vagy több B-jellegzetesség van jelen és nincs M-jellegzetesség, a daganatot
jóindulatúnak ítéljük.
• Harmadik szabály. Amennyiben
M- és B-tulajdonságok is előfordulnak, a vizsgálat bizonytalanul értékelhető;
második vonalbeli képalkotó vizsgálat javasolt.
Az IOTA vizsgálati módszer
hatékonysága egyszerűségében és egységességében rejlik: a különböző vizsgálók
értékelései összehasonlíthatók, és az ultrahangos értékelési módokban kevésbé
jártasak is könnyen eligazodnak.
Ha a nem képzett vizsgáló M-
és B-jellegzetességeket is lát (bizonytalanul értékelhető vizsgálat), szakértő
ultrahangos bevonása szükséges – az ultrahangos szakember ugyanis számos
alkalommal képes volt ilyen esetben is a megfelelő döntésre.
ismétletbő válzat* permutation allele olyan válzat,
amelyben az ismétletek száma valamely génben vagy gén közelben több mint a
szokványos válzatban. Az ilyen válzat, ha öröklődik, betegséget okozhat. Pl.
az FMR1 gén ismétletbő válzata. (→FMR1)
ismétletbővülés*
repeat expansion az ismétletek rendellenes többszöröződése, a DNS-másulás egyik
formája, betegséget okozhat. Leggyakoribb a hármas ismétletek bővülése, de a
négyes, ötös ismétletek (mikroismétletek), sőt hosszabb ismétletek rendellenes
sokasodása szintén ismert. A bővülés megbonthatja a DNS állékonyságát, a
bDNS-től eltérő szerkezetek alakulhatnak ki, mint hajtűhurok, kereszteződések,
guaninnégyes és -hármas alakzatok. A DNS szerkezeti rendellenességeit okozó
ismétleteket szerkezetmódosító ismetléteknek* (structure forming
repeats) nevezik. Ezek a rendellenes szerkezetek gátolhatják a DNS-kettőződést,
a DNS-javításokat, és DNS-hibás sejtek jöhetnek létre. A génekben előforduló
ismétletbővülés zavart kelthet a gén működésében: megszűnhet az átíródás (loss
of function), vagy nem megfelelő fehérje képződik. Lehet a képzőben, köztesben
és az UTR-ekben is. Ismétletbővülés leginkább DNS-kettőződéskor keletkezik.
hárombázisú ismétletbővülés* trinucleotide
repeat (TNR) expansion a bázishármasok
számának növekedése a génekben, aminek következtében több aminosavat tartalmazó
kóros fehérjék és betegségek keletkezhetnek (TNR disease). Pl. a CAG, CTG, GAA, CCG és a CGG hármasok többszöröződése
elfajulásos idegrendszeri betegségeket okozhat.
ismétletsor* repeating region az ismétlet ismétlődései által
kialakított bázissor; törzsökös szegélyező bázisok fogják közre, ezek alapján
azonosítható. Jellemzésére négy ismérvet alkalmazunk: az ismétletet, az ismétletsorhosszt*
(összbázisszám, összesen hány bázis van az ismétletsorban), az ismétletmintázatot*
(az ismétletek egymáshoz viszonyított jellege) és az ismétletszámot*,
amely azt jelöli, hogy az ismétlet az ismétletsorban hányszor ismétlődik. Az
ísmétleteket a következők szerint írjuk: az ismétlet zárójelben adjuk meg, és
utána írjuk az ismétletszámot alsó kitevőben. Pl. (CATTCGATTC )33;
ez azt jelenti, hogy a CATTCGATTC ismétlet 33-szor ismétlődik az adott
ismétletsorban. Ha pedig az ismétlet pontos helyét akarjuk megadni, akkor
pl. g.123_191CAG[23]; ez azt
jelenti, hogy a DNS 123. nukleotidjától a 191. nukleotidig tart az ismétlet,
ahol a CAG 23x ismétlődik.
Az
ismétletsor hossza (az összbázisszám) szerint megkülönböztetünk:
▪ Átlaghosszú ismétletsorokat*, amelyek kilobázis nagyságrendűek, de lehetnek jóval rövidebbek
is.
▪ Óriás ismétletsorokat (satellite DNA), amelyek több megabázis nagyságúak. (→óriás ismétletsorok)
Az
ismétletszám szerint vannak:
▪ Azonos számú ismétletsorok. Ezek
válzataiban az ismétletek száma azonos. Az ismétletek zöme ilyen, minden
emberben egyforma.
▪ Különböző számú ismétletsorok azok,
amelyeknek válzataiban eltérhet az ismétletek száma. Az ilyen ismétletsort változószámú
ismétletnek nevezzük (variable number of tandem repeat, VNTR).
(→változószámú ismétlet)
Miként
az ismétletek, az ismétletsorok is a Mendel-szabályok szerint öröklődnek, egyedjellegzetesek,
hajlamosok másulásra és összefügghetnek betegségek kialakulásával.
javallat indication
javaslat valamely beavatkozás, kezelés, teendő elvégzésére (műtéti javallat, a
gyógyszer adásának javallata).
ellenjavallat contraindication olyan
feltétel, amely meggátol, nem tesz kívánatossá valamilyen beavatkozást,
kezelést, teendőt.
feltételes javallat relative indication valamely beavatkozás,
teendő stb. végzése célszerű, de nem feltétlenül szükséges.
feltétlen javallat absolute indication
javaslat valamely beavatkozás, kezelés feltétlen alkalmazására.
jelátvitel*
signal transduction a vérkeringéssel vagy a sejtközi állományban érkező jel (vízoldékony
jelvivő) fogadása a sejten található jelfogó fehérje által. A jelvivő és a
sejtfelszíni jelfogó kapcsolódásával jön létre; a jelfogó viszi át a
jelzést a sejthártyán.
Korábban úgy véltük, hogy egyazon jelvivő ugyanolyan
jelfogóhoz kapcsolódva csak egyfajta jelátvitelt vált ki. Tehát nemcsak a
jelvivő–jelfogó kapcsolódása fajlagos, hanem a jelátvitel is. Az elmúlt
évtizedekben körvonalazódott, és vált elfogadottá a válaszállapot* (functional
selectivity) elmélete; más néven: biased agonism, biased efficacy, signalling
bias. Veleje: egyazon jelfogóhoz kapcsolódó egyazon jelvivő különféle
jelközvetítéseket válthat ki, valószínűleg a jelfogó állapotától függően.
(→jelvivő–jelfogó kapcsolódás) Vagyis nem tartható az a korábbi elmélet, amely
szerint azonos jelfogó által átvitt más-más jelközvetítéshez más-más jelvivő
szükséges. A jelenséget először a mesterségesen előállított jelvivőknél,
például gyógyszereknél figyelték meg, de kiderült, hogy a szervezetben
keletkezőknél sem kivételes.
jelviteli kötőhely az a hely, ahol a jelvivő kötődik a jelfogóhoz.
Leginkább a sejt felszínén van, de lehet a sejtplazmában, sőt a sejtmagban is.
(→jelfogó)
kereteltolódás frameshift mutation (→bázistöbblet és bázisvesztés)
keretmegtartó
többlet/vesztés* in-frame insertion/deletion
(→bázistöbblet és bázisvesztés)
kétszereződés duplication a genetikában olyan másulás (mutation), amelyben egy
gének vagy kromoszómarésznek egy vagy több másolata keletkezik. A
kromoszómahármas nem kétszereződés, hanem egy többlet kromoszóma.
kettős ■ kettős kötés (→elektronkötés)
■ kettősödés dimerization (dimerizáció)
két azonos molekula összekapcsolódása egy vegyületté. ■ kettős vak vizsgálat double blind study (→klinikai vizsgálat)
kétválzatos
párhibajavítás-hiány constitutional mismatch repair deficiency, CMMRD ritka örökletes rákhajlamosító betegség; sokféle
gyermekkori daganat kialakulása (agydaganat [glioma, glioblastoma],
vérképzőszervi [fehérvérűség, lymphoma], gyomor-bél daganatok jellemzik, de
kialakulhatnak ébrényi daganatok és mások is. A rákok 18 éves kor előtt
megjelennek, és rendszerint második is keletkezik a későbbi életben. Sok a
jóindulatú növedék is, például mirigydaganatok, polipok. Sokszor fordulnak elő
az 1-es formájú neurofibromatosisban látható jellegzetességek (a bőrön
tejeskávé-foltok, vagy éppen pigmenthiányos területek, Lisch-csomó). Az ismert
esetek fele rokonházasságokban fordult elő.
Leginkább
az MSH2 és az MLH1 gén másulása okozza. Az érintett mindkét szülőtől kóros
válzatot örököl. Ellentétben a Lynch-kórral, a mikroismétletek hibái ritkák. A
kórisme, a kettős hiba megállapítása az MSH2, MLH1, PMS2, MSH6 gének
vizsgálatával lehetséges.
A kétválzatos
hiba az olvasáskeretet változtatja meg, és a szervezet számára idegen fehérje
(újantigén) képződik, ezért immunválasz keletkezik. Az immunválasz a
sejtkör-ellenőrzőpontot gátlókkal visszaszorítható, de az újantigén-alapú oltás
is ígéretes.
kezelés therapy, treatment az
orvostudományban betegség leküzdésére alkalmazott gyógymód; gyógykezelés.
bevezető kezelés neoadjuvant therapy általában daganatgyógyászati fogalom: valamelyik kiegészítő kezelés
(gyógyszeres kezelés és/vagy sugárkezelés) adása az elsődleges kezelés előtt,
pl. a daganat zsugorítására a szóródások mérséklésére stb.
első kezelés primary therapy, primary treatment,
induction therapy, first-line therapy időben,
sorrendben a legelső, pl. a műtét az első/elsőleges kezelés; a gyógyszert utána
adjuk.
elsődleges (fő) kezelés first-line therapy, main therapy, primary
therapy/treatment, induction therapy (első
vonal kezelés, első vonalbeli kezelés)
elfogadottan a legjobb kezelés. Ha nem hatásos, vagy súlyos mellékhatásai
vannak, kiegészíthető vagy helyettesíthető mással. Utal időbeliségre is, a
fontosság hangsúlyozásával, pl. a vérzéscsillapítás az elsődleges teendő –
nemcsak a legfontosabb, de a legelső is.
kiegészítő kezelés adjuvant therapy az elsődleges kezeléshez
hozzáadott kezelés, szokásosan az elsődleges kezelés után alkalmazzuk.
második kezelés időben,
sorrendben az elsőt követi. Pl. a második kezelés a gyógyszeres; a műtéttel
kezdünk.
másodlagos kezelés second-line
therapy (második vonal kezelés, második vonalbeli kezelés) az
elsődleges kezelés eredménytelensége (nem hatásos vagy nem elviselhető volta)
esetén alkalmazott kezelés.
támogató kezelés palliative therapy (palliatív kezelés) a
beteg életminőségét javító kezelés. Az ilyen kezelésnek nem a beteg
meggyógyítása a célja; legtöbbször azért, mert erre jóformán nincs esély.
kiterjedés (fizikai) dimension of
physical quantity (dimension, dim) a
mértékegységekre vonatkozik; azt mutatja, hogy hányféle mértékegység szükséges
valamely fizikai mennyiségnek a meghatározásához. Többféle értelemben
alkalmazzuk:
▪ Hétköznapi értelemben a test térbeli kiterjedése; nagyságfajtáinak
(szélesség, hosszúság, magasság; x, y, z) összefoglaló
elnevezése. A fizikai test tehát háromkiterjedésű. A sík tárgy (például
papírlap) vastagsága elhanyagolható, ezért kétkiterjedésű, az x és az y
számértékével leírható. Az egyenes vonalnak csak hosszúsága (x) van:
egykiterjedésű.
▪ A fizikai tér kiterjedése azon változók száma,
amelyekkel a tér állapota vagy egy esemény a térben meghatározható.
Hagyományosan azt mondjuk, hogy a tér négykiterjedésű, a negyedik az idő. A tér
egy adott pontjából három irányba (fel/le, balra/jobbra és előre/hátra) el
lehet mozdulni; ezek az egyenes vonalú elmozdulások. Az idő azonban csak egykiterjedésű:
az a pillanat, amikor meghatározzuk a teret, illetve valamely helyet a térben.
A mozgást a térben tehát szokásosan az egyenes vonalú elmozdulásokkal (x, y, z)
és az esemény bekövetkezésének pillanatával, az idővel (t) írjuk le, de van más
lehetőség is, például r, teta, fi, gömbi irányokkal.
▪ A mértékegység kiterjedése valamely mértékegység
(mennyiség) és az alapmértékegységek (alapmennyiségek) közötti kapcsolat. Azt
adja meg, hogy az adott mértékegység (mennyiség) hány alapmértékegységgel
(alapmennyiséggel) határozható meg. Az alapmértékegységeket az
SI-egységrendszer tartalmazza. Hét SI-alapmennyiség van: hosszúság (L), idő
(T), tömeg (M), elektromos áramerősség (A), anyagmennyiség (mol), hőmérséklet
(K) és fényerősség (cd); ezért csak hétféle alapegységgel számolunk. Bármely
fizikai mennyiség kiterjedése kiszámítható a hét alapmennyiség kiterjedésével.
Például a sebesség a távolság és az idő hányadosa, vagyis kétkiterjedésű: két
alapmértékegységgel (távolság és idő) határozható meg.
Általános fogalmazásban a
mértékegységviszonyt a kiterjedésegyenlettel* fejezzük ki. Például ha
tetszőleges „Q” mennyiséget (jele: dim Q) a hosszúsági (L), időbeli (T) és a
tömegi (M) kiterjedés határozza meg, a dim Q = Lα × Tβ ×
Mγ.
Az α, β, γ kiterjedéskitevő*;
értéke a mennyiségegyenlet szerinti, például a mozgási energiát kifejező
mennyiségegyenlet: W =1/2m × v2 (m tömeg, v sebesség
[m/s]); kiterjedésegyenlettel kifejezve: dim W = L2 × M × T-2.
Azt a fizikai mennyiséget, amelynek
mindegyik kiterjedéskitevője 0, a kiterjedése tehát 1, például dim Q = L0
× M0 = 1, kiterjedéstelen mennyiségnek (dimensionless
physical quantity) nevezzük. Minden kiterjedéstelen mennyiség SI-mértékegysége
az 1, de ez nem írjuk ki, ezért a mennyiséget pusztán egy számérték jelöli, például
darabszám (fehérvérsejtszám: 6000). (→mennyiség)
kiterjedéstelen mennyiség dimensionless quantity (→kiterjedés, mennyiség)
klón clone a
biológiában egyetlen egyénből, sejtből létrehozott azonos utódsor, illetve egy
élőlény egyetlen sejtjéből létrehozott utód.. A hazai szakirodalom klónnak
nevezi. Lehet valami monoklónáris és poliklónáris:
▪ A monoklonáris azt
jelenti, hogy egyetlen sejt klónozott, szaporított sejtvonalából keletkező
valami, például ellenanyag. Ezek tehát tökéletesen azonosak. Mindig és
kizárólag ugyanazon antigénhez, az antigénnek ugyazon meghatározójához
(antigénmeghatározó) kötődnek, tehát egykötődésűek, például a monoklonáris ellenanyagok egykötődésű ellenanyagok*.
▪ A poliklonáris több antigénmeghatározót is felismerő,
például ellenanyag. A poliklonáris kötődésű ellenanyagok többkötődésű
ellenanyagok.
klonális sejtfelszaporodás* clonal expansion. Pl. a TP53-hibás sejtek felszaporodása.
korai
TP53-hibás burjánzatok* benign-appearing
early serous proliferations(ESPs) with TP53 mutations hámbeli sejtek, amelyekben nem alakulnak ki a hámbeli
rákosodás sejtjellemzői, vagy szinte észrevehetetlen mértékben, de hordozzák a
TP53 hibát. A hámszövet szerkezetét nem változtatják
meg; a génhiba immunfestési módszerével mutathatók ki.
Jelentőségüket az adja, hogy
leválhatnak és szóródhatnak a petefészekbe és/vagy a hasüregbe. Ahol
megtapadnak, rák keletkezhet belőlük.
külső magzatburok chorion a tápsejtek és az ébrényen kívüli középső csíralemez
kivándorolt sejtjei hozzák létre. Szorosan tapad a belső magzatburokkal, és
hasonlóan körbeveszi az egész magzatot. Bensőségesen fekszik a
méhnyálkahártyához, és azzal együtt alakítja ki a méhlepényt.
lélegzés respiration gázcsere a tüdőkben: az oxigénbő
levegő (21% oxigén, 0,04% széndioxid) belégzése a tüdőkbe, benntartása rövid
ideig, majd a levegő kilégzése, amely 16% oxigént és 0,4% széndioxidot
tartalmaz. A tüdőhólyagocskákban megy végbe a gázcsere, mintegy 140 m2
felületen. Ez biztosítja az oxigént a szénvegyületek égetéséhez, vízzé és
széndioxiddá alakításához, miközben energia keletkezik, és használódik fel a
sejtek működésében. A keletkezett széndioxid pedig ekként távozik.
linear phosphorylation
motif vonalas foszforilezési mintázat (→fehérjemintázat)
Lugol-oldat Lugol’s iodine solution kálium-jodidos
jódoldat. (Általában úgy viselkedik, mintha a jód vizes
oldata volna. A kálium-jodid vizes oldatából a bróm vagy a klór elemi jódot
tesz szabaddá. Erősen savas közegben klór hatására kálium-kloriddá és
jód-monokloriddá alakul). A jódos oldatot előszeretettel a glikogén köti.
 A Lugol-oldattal a hámszövet jódfestődését figyeljük,
amely mahagóni- (sötét-) barnától a halványsárgáig (jódnegatív) változhat, és
lehet egyöntetű vagy foltos, de az is előfordul, hogy jóformán még a nagyon
halványsárga elszíneződés sem jön létre. Az érett többrétegű laphám mahagóni-
(sötét) barnára festődik. Oka a közbenső sejtek széles rétege; a közbenső
sejtekben ugyanis sok a glikogén. A sorvadó, kóros, sérült többrétegű hám
világosan, sárgásan festődik. Az ábrán jól látható mahagónibarnára festődő ép többrétegű
laphám (kis
nyilak); élesen elüt
a jóddal nem festődő,
halványsárga kóros
elváltozástól,
amelyet jódnegatívságnak mondunk (vastag nyíl).
A Lugol-oldattal a hámszövet jódfestődését figyeljük,
amely mahagóni- (sötét-) barnától a halványsárgáig (jódnegatív) változhat, és
lehet egyöntetű vagy foltos, de az is előfordul, hogy jóformán még a nagyon
halványsárga elszíneződés sem jön létre. Az érett többrétegű laphám mahagóni-
(sötét) barnára festődik. Oka a közbenső sejtek széles rétege; a közbenső
sejtekben ugyanis sok a glikogén. A sorvadó, kóros, sérült többrétegű hám
világosan, sárgásan festődik. Az ábrán jól látható mahagónibarnára festődő ép többrétegű
laphám (kis
nyilak); élesen elüt
a jóddal nem festődő,
halványsárga kóros
elváltozástól,
amelyet jódnegatívságnak mondunk (vastag nyíl).
A jódfestődés rendszerint tartós, tovább megmarad, mint
az →ecetsavfehérség. A jódoldat kellemetlen, csípős érzést okozhat, kiváltképp
érzékeny helyeken, például a hüvelybemenet környékén. Ez általában néhány perc
alatt elmúlik. Jódérzékenyeknél a Lugol-oldat nem alkalmazható.
magsapkaválasz acrosome reaction a magsapka viselkedése a
petesejtbe jutáskor. Lényege: az ondósejt fején, amikor az ondósejt eléri a
fénylő burkot, a magsapka hártyája és a felette lévő sejthártya összeolvad, és
kiürülnek a fehérjebontó enzimek. Ezek nyílást emésztenek a fénylő burkon, hogy
az ondósejt átjusson.
mikrocsövecske szervezési központ microtubule organization center, MNOT a mikrocsövecskék képződési helye a sejtközpontbn.
Rendszerint finom rostfonalas, tubulint tartalmazó és sokféle (többnyire
ismeretlen) fehérjéből felépülő állományban található. Két feladata van: az
ostorok és a csillók, valamint az osztódási orsó képzése.
mintavétel sejtek vagy szövetdarab kivétele a
szervezetből rendszerint sejttani, szövettani kórismézésre vagy valaminek
(sejtrész, molekula stb.) a meghatározására.
folyadék-mintavétel liquid biopsy testfolyadékból
(pl. vérből, agyvízből, vizeletből) készített minta, mely lehet sejt (keringő
daganatsejt), DNS (keringő daganat-DNS [ctDNS]), RNS (daganati RNS, hólyagcsa-RNS),
fehérje, lipid stb. Előnye a szöveti mintavétellel szemben: kimutat
daganatmásságot, bármikor ismételhető, és felfedhet rákkiújuláshoz vezető
parányi maradékdaganatot (minimal residual disease, MRD), azaz maradék
ráksejteket, mikroáttétet. Egyre gyakrabban alkalmazott mintavételi lehetőség,
különösen a daganatgyógyászatban.
hengeres (vastagtű) mintavétel core biopsy, core needle biopsy, Tru-Cut biopsy (TCB) vastag tűvel végzett szövetkiszívás. A kivett minta a
tű üregének megfelelően hengeres formájú: hengeres szövetminta (core
biopsy specimen), amelyet terimék szövetszerkezetének megállapítására
alkalmazunk. A képletet leginkább képalkotó eljárás, elsősorban ultrahang
vezérlésével szúrjuk meg.
rendelői mintavétel* office sampling nem műtői körülmények között,
szokásosan a vizsgálóhelyiségben végzett mintavétel.
szívócsöves mintavétel* a végén nyitott, néhány mm-es, dugattyúval ellátott
műanyagcsővel végzett mintavétel. Üreges szervekből, szokásosan a méhből való
szövet nyerésére használjuk. A csövecskét a nyakcsatornán át, általában tágítás
nélkül bevezetjük a méhüregbe, a dugattyú visszahúzásával létesítünk
szívóhatást, aminek következtében méhnyálkahártya-részek kerülnek a csőbe. A
csövet kihúzzuk.
vékonytű mintavétel fine-needle aspiration (FNA) vékony tűvel kiszívott sejthalmaz, amelyet tárgylemezen
terítve mikroszkóppal vizsgálunk. A minta neve: vékonytű sejtminta (fine-needle
aspiration specimen). Felszíni szövetből (bőr, pajzsmirigy stb.) egyszerű
szúrással, mélyebb szövetekből képalkotó vezérlésével végezhetjük.
mintázatfelismerő jelfogók
pattern recognition receptors,
PRR a kórokozók törzsökös mintázatait (pathogen-associated molecular
patterns, PAMPs) és a pusztuló, károsodott sejteken megjelenő mintázatokat, a sérülésmintázatokat*
(demage-associated molecular patterns, DAMPs) érzékelik. Leginkább a falósejtek,
kevésbé a hámsejtek, májsejtek stb. felszínén fordulnak elő, de vannak keringő
(pl. mannózkötő lektin, MBL) és sejten belüliek is.
MIT–TFe (microphthalmia/transcription factor E,
MIT/TFE) átírásfehérje-család a MYC-nagycsalád tagja. Jellemző rájuk a 10
bázispárnyi (a hagyományos E-dobozra emlékeztető), CLEAR (coordinated lysosomal
expression and regulation) elemnek nevezett mintázatot (GTCACGTGAC) felismerő
képesség. Ez a mintázat a savas hidrolázokat, az emésztőtestecs hártyai
szállító és társfehérjéket kódoló emésztőtestecs-gének indítójában van; a MIT–TFe
átírásfehérjék (MITf, TFeb, TFe3 és TFec) ezt felismerve kapcsolódnak a génhez.
Hasonlóan kötődnek az önfalás folyamatát irányító (autophagy) génekhez is. Mint
a legtöbb átírásfehérje, általában kettőst képezve hatékonyak, mindegyikben
megtalálható a kettős képezéséhez szükséges gomoly, és DNS-kötő gomoly is.
Működésük szigorúan szabályozott: pl. a
tápanyaggazdag sejtben a TFeb és a TFe3 átírásfehérjét az emésztőtestecs
hártyájában lévő RAG-GTPáz toborozza, és a tevékeny mTORC1 foszforilezi. A
foszforilezett TFeb és TFe3 tétlen, mert a 14-3-3 fehérjéhez kötődik, és fogva
marad a sejtplazmában. Tápanyaghiányos sejtben a RAG-GTPáz és az mTORC1 is
tevőtlen, a TFes és a TFe3 defoszforileződik a foszfatáz calcineurin által,
elválik a 14-3-3-tól, beszállítódik a sejtmagba és kötődik a DNS-hez. Ha helyreáll
a tápláltsági állapot, a RAG-GTPáz tevősíti az mTORC1-et, ez utóbbi újra
foszforilezi a sejtplazmában lévő TFEB-t és TFE3-at, megakadályozva, hogy újabb
átírásfehérjék kapcsolódjanak a célgénekhez.
A MIT–TFe átírásfehérjék tevékenységét –
kapcsolódásukat a DNS-hez – a foszforilezés mellett az acetilezés, SUMO-ilezés,
elektronleadás, ubikvitinjelölés, továbbá kóros sejthelyzetek (sejtártmány,
energiatestecs-, DNS-hiba, gyulladásállapotok, rák stb.) szintén befolyásolják.
Foszforilezéssel hatnak rájuk a növekedést szabályozó kinázok (MEK/ERK),
valamint a GSK3 (glycogen synthase kinase 3) is. Ezek együttesen irányítják az
emésztőtestecs-önfalási gének tevékenységét.
MPF (maturation promoting factor)
(mitosis-promoting factor, M-Phase-promoting factor) a ciklinA/B–CDK1 külön neve. A G2-ből vezérli a
sejtet az M-szakaszba olyan fehérjék foszforilezésével, amelyekre szükség van
az M-szakaszban. Az MPF a G2-ben gátolt (foszforilezett) állapotban van;
foszfatáz tevősíti a foszfátcsoport elvonásával.
MRE11
(meiotic recombination
11) (→MRN-össztes)
mutáció mutation a
hazai szóhasználat általánoson használt idegen szakkifejezése. Meg sem
kísérelték magyarítani. Valamiféle, az örökítőanyagra vonatkozó módosulást,
változást, átalakulást, mássá válást jelent. Ezek általános szóhasználatúak, és
a mutáció gondolata nélkül is alkalmazzuk őket. Például: ha a DNS módosult, az
egyáltalán nem jelenti azt, hogy mutálódott. Olyan szó szükséges, mely
kizárólag a mutációt jelenti. Ez a szó a másul*, másulás*.
Szakmai
meghatározása a hazai és a nemzetközi irodalomban is sokféle, és átfedő. Csak
sejtetik, hogy miről van szó. A biológiában helyes tisztázni, hogy minek a
mutációjáról, másulásáról van szó, és annak alapján meghatározni. A biológiában
DNS-másulásról beszélünk. A DNS-másuláson belül megkülönböztetjük a
DNS-elemeinek másulását (génmásulás, ismétletmásulás, pontmásulás stb.). A
nevezettárban ezeket külön részleteztük.
működésvesztés loss
of function a biológiában valamely
biológiai elem tevékenységének megszűnése. Az elem megmarad, csak nem működik.
Ilyen például az indító némítása metilezéssel. (→loss of heterozygosity)
népesség population 1.
valamely területen (földrajzi terület, ország, város, közösségek stb.) lévő
élőlények (emberek, állatok, növények, baktériumok stb.) összessége. 2.
valamely vizsgálat tárgyát képező meghatározott elemek (személyek, állatok,
intézmények, események stb.) összessége.
népességátalakulás valamely élőlényközösség számának (nagyfokú halálozás
[járvány, háború], sok utód) vagy összetételének (bevándorlás, elvándorlás)
megváltozása.
népességrobbanás hirtelen nagyarányú népességátalakulás.
népességvizsgálat population study, population based study valamilyen csoport (pl. bennszülöttek, magyarok)
vizsgálata; olyan személyeket vizsgál, akiknek fő jellegzetességei (kor, nem,
betegség stb.) egyeznek. A jellegzetességek összegyűjtésével állapít meg
irányvonalakat azonos állandó vagy változó mennyiségek szerint.
kiterjedt népességvizsgálat large scale population based study népességvizsgálat; valamely népesség
zömét/egészét felölelő vizsgálat.
visszatekintő kiterjedt népességvizsgálat retrospective large scale population based
study megtörtént adatok feldolgozásával a népesség zömében/egészében
végzett vizsgálódás.
környezetvizsgálat ecological study
(geographic study, correlation study) környezeti tényezőket vizsgál
feltételezések bizonyítására, például a méhtestrák előfordulását veti össze a
népesség táplálkozási szokásaival, keresve a kettő közötti összefüggést.
népességcsoport-vizsgálat population-based cohort study népességi
csoportokat vizsgál; a személyeket együtt, nem pedig külön-külön.
visszatekintő
népességcsoport-vizsgálat population-based
retrospective cohort study már meglévő adatok népességi csoportok szerinti
elemzése visszamenőleg.
szemléléses vizsgálat observational study (non interventional
observational study) valamely népességben valamilyen módon kiválasztott
személyeket tanulmányoz anélkül, hogy beavatkozna a sorsukba, például kezelné
őket. Kiválaszt és megfigyel bizonyos betegségben szenvedőket, ez a
betegségcsoport, és olyanokat, akiknek nincs az a betegségük. Az utóbbi az
ellenőrző csoport, az ún. „egészségesek” csoportja. Több formája van:
elemző tanulmány analytic study a megfigyelés egyedekre terjed
ki, a kiválasztott egyedek körülményeit tanulmányozza, például a kórok,
kockázati tényezők stb. szempontjából.
esetsorozat
vizsgálat case series study érdekes, különleges esetek tanulmányozása,
számösszevetési értékelés nélkül.
keresztmetszeti vizsgálat cross sectional study egyfajta betegségben szenvedők különböző csoportjait
vizsgálja a jelen helyzet szerint, például akiknél a betegség kezdődik vagy 5,
10 stb. éve fennáll.
leíró tanulmány descriptrive study a megfigyelés összesített
adatokra (aggregated data) épül, például időskori méhtestrákok előfordulása. A
vizsgálat népességi szintről tájékoztat, például összeveti a német és az angol
népességben előforduló időskori méhtestrák eseteit.
valóhelyzet-vizsgálat real word study valamely készítmény, kezelés stb. vizsgálata válogatás nélküli
népességben.
next
generation sequencing, NGS újnemzedékes
bázispásztázás (→bázispásztázás)
oldat solution két vagy több anyag
egynemű folyékony keveréke (mixture). A folyékony oldószerből (solvent) és az
ebben feloldandó szilárd, folyékony vagy gáz halmazállapotú anyagból (solute)
áll, amelyből oldott anyag lesz, amely mindig folyékony. Az oldásban az oldószer
és az oldandó anyag részecskéi elkeverednek, az oldószer részecskéi körbeveszik
az oldott anyagot, pl. vízben az oldott anyag körül vízburok keletkezik. A
részecskék szabad szemmel nem láthatók, a fényt nem törik, szűréssel nem
választhatók el.
olvasáskereti
beékelődés in-frame insertion ■ olvasáskereti törlődés in-frame deletion (→bázissormásulás)
osztódásidőzítés* replication timing a
DNS-kettőződés időbeli szabályozása. Törzsökös folyamat, szabályozatlansága
betegséghez vezet. Elsősorban a kromatin állapota irányítja. (→sejtosztódás)
összlet* polymer
soktagú egység, sok ismétlődő tagból álló nagymolekula, ekként hatásos; avagy
azonos feladatott ellátó fehérjéket kódoló gének csoportja.
összletesedés* polymerization sokassá válás: egytagú molekulák ismétlődő egyesülése gyenge vagy erős kötésekkel.
permutation allele →ismétletbőválzat
Philadelphia-kromoszóma Philadelphia chromosome, Philadelphia translocation (Ph) átcserélődés
következtében kialakult sajátosan rövid 22-es kromoszóma, amelyen jelen van a
ABL-BCR egyesült gén. Az átcserélődés a 22-es és a 9-es kromoszóma között jön
létre: a 9-es kromoszóma hosszú karjának alsó része (q34) cserélődik a 22-es
kromoszóma q11-es részével t(9q34;22q11). A származék 9-es kromoszóma
(derivative chomosome 9, der9) hosszabb, a 22-es pedig lényegesen rövidebb,
csonka (trancated chromosome 22, 22q-, the Philadelphia chromosome). A
töréspontnál a 9-es kromoszómán (q34.1) van az ABL gén, a 22-esen (q11.2) a BCR
gén. Az átcserélődés következtében ezek egyesülnek, és kialakul a felemás
ABL-BCR gén: az ABL génnek 3’-végi, a BCR gén 5’-végi részéből keletkezik. A ABL-BCR
gén az ABL-BCR fehérjét képezi, amely tirozin-kináz, és folyvást bekapcsolt
állapotban van. Ennek következtében a sejt megállás nélkül osztódik,
sokasodik.
A Philadelphia-kromoszóma jelenléte a fehérvérűség
egyes formáinak jellemzője: csaknem mindig jelen van az idült mieloid
fehérvérűségben (CML), ritkában a heveny nyiroksejtes (ALL) és még ritkábban a
heveny mieloid (AML) fehérvérűségben.
polimeráz polymerase nukleinsavat (RNS-t vagy DNS-t) képező enzim,
nukleotidokat kapcsol össze foszfodiészter-kötéssel. A polimerázok több
alegységből álló fehérjék; alegységeik fajtánként némileg eltérnek. Általános
értelemben a polimeráz soktagú molekulát (polymer) képező enzim. Sokféle
polimeráz ismert; két nagy csoportjuk a mintafelülettől függő (DNS-,
RNS-polimeráz) és független polimeráz (pl. Poli-A-polimeráz). A DNS-polimeráz
DNS-t másol a DNS-ről, az RNS-polimerázok pedig különböző RNS-t készítenek a
DNS-szálról, vagy RNS-t másolnak. (→DNS-polimeráz, RNS-polimeráz)
polimeráz-láncfolyamat (PCR) polymerase chain reaction, PCR
laboratóriumi módszer valamely DNS-szakasz sokszorosítására. Veleje: a kétszálú
DNS-szakasz szétválasztása, a cél DNS-szakasz kijelölése rövid indítószálakkal
(primerek), és DNS-képzés az egyszálú kijelölt DNS-szakasz polimerázzal való
másolásával. A folyamat nagyon gyors, és sokszorosan ismétlődik, másolatok
sokasága keletkezik.
POT1 (
protection
of
telomeres
protein 1) a kromoszómák
végrészének egyszálú DNS-éhez kötődő fehérje, a védlet (shelterin) tagja. Négy
gomolya van: az OB1, OB2, OB3 (OB-fold domain) és a HJRD (Holliday junction resolvase domain). Az N-végi két OB
gomollyal (OB1, OB2) kötődik az egyszálú DNS-hez. A C-végi OB3 és HJR gomoly
kapcsolja a TPP1-hez, amellyel kettőst képez, tevékenységét így fejti ki. A POT1
gén (7q31.33) kódolja.
A POT1 sajátosan kötődik az egyszálú nukleotidsorhoz, a
DNS-hez kifejezettebben, mint az RNS-hez. Ezt a kötődést a TPP1 fokozza. A POT1
megakadályozza, hogy az ATM-függő hibajavítás molekulái kapcsolódjanak a
végrészhez, és megakadályozza a végrész másolódását is. (→végrész)
PPI (protein-protein
interactions) →fehérje–fehérje kölcsönhatások
protein →fehérje ■ protein-protein
interactions (PPI) →fehérje–fehérje kölcsönhatások
protein
interaction domains, protein–protein interaction domain fehérjekapcsolati gomolyok fehérjékkel kacsolódó gomolyok, köztük
kölcsönhatásokat hoznak létre.
PRR (
pattern
recognition
receptors) →mintázatfelismerő jelfogók
redox oxidation–reduction (→vegyfolyamat) ■ redoxpár
elektronátmenet-pár (→elektronátmenet)
rendezetlenségszám*
entropy (S) (entrópia) állapotfüggvény, valamely rendszer rendezetlenségének
a mértéke. Másként: a hőenergia és az egységnyi hőmérséklet hányadosával
meghatározható mennyiség. Azt fejezi ki, hogy a belső energia mennyire terjed
szét, vagyis a rendszer atomjainak, ionjainak, molekuláinak rendezetlenségét
jelöli. Állandó körülmények között a rendezetlenségszám is állandó (ez a
rendezetlenség megmaradásának törvénye).
A rendezetlenségszám jele: S, egyenlő joule (energia) /
kelvin (egységnyi hőmérséklet). Mértékegysége J/K vagy J × mol−1 × K−1.
A bonyolult (rendezett) szerkezetek S-értéke kicsi, az egyszerű (rendezetlen)
szerkezeteké nagy.
A rendezetlenség mértékét két tényező határozza mag: az
atomok/molekulák mozgása és tömege. Minél szabadabban mozognak az
atomok/molekulák, illetve minél nagyobb a tömegük, annál kifejezettebb a
rendezetlenség, nagyobb a rendezetlenségszám, az S-érték.
A rendezetlenségszám változásának jele a DS;
ha a rendezetlenség fokozódik, a ∆S >0, ha csökken, a ∆S <0. Minden
természetes (fizikai, vegyi, biológiai) folyamatban a rendszer és környezetének
rendezetlensége növekszik (∆S >0). ∆S = ∆Sr (rendszer) + ∆Sk
(környezet). Ebből következik, hogy a rendszer rendezetlensége csak akkor
csökkenhet, ha a környezetének rendezetlensége nagyobb mértékben növekszik; ez
az energia eloszlásának (rendezetlenségének) a törvénye.
A rendezetlenség(szám) változása
önmagában – a többi állapotjellemző módosulása nélkül is – befolyásolhatja a
belső energia mennyiségét, munkavégzését, például hőhatásra (Q). A belső energiának
a hőhatásra végzett munkáját (W) a Wterm = Q = T × DS
egyenlet fejezi ki; a Wterm a belső energiának a hőhatásra
bekövetkező energiacsere változása, amely tehát egyenlő a hőmérséklet (T) és a
rendezetlenségszám változásának (DS) szorzatával.
(→belső energia, hőhatás)
Rudolf
Clasius (1822–1888) vezette be a rendszeren belüli energia átalakulás fogalmára
a görög entropé szóból.
szerkezeti rendezetlenségszám configurational entropy a rendszer
atomjainak/molekuláinak a helyzetéből, nem a mozgásából adódó rendezetlenség
mértéke. Az ebből származó energiaátadás (munka) nem változtatja meg a
hőmérsékletet. Vagyis a rendezetlenség mértékének ez a változása állandó
hőmérsékleten megy végbe; DSkonfig formájában jelöljük.
restriction enzyme →DNS-hasító enzim
RFC (replication factor C) DNS-szálhoz
kapcsolódó, öt alegységes (RFC1–5) fehérje, DNS-polimeráz-járulékfehérje,
DNS-függő ATPáz. A DNS 3’-véghez kötődik, kapcsolódik a PCNA fehérjével, melyet
ATP felhasználásával felhasít. Az ATP bontásával az RFC leválik, a felhasított
PCNA pedig körbefogja a DNS-t. Ezért nevezik bilincsfelhelyezőnek*
(clamp loading). Számos
DNS-folyamatban (DNS-hibajavítás, kettőződés, kromatin-összeállás) működik
közre. Az RFC gén kódolja.
RICTOR (
rapamycin
insensitive companion
of m
TOR) az mTORC2-együttes
tagja. Gátolja az mTOR2-t ás az AKT1-et, aminek következtében fékeződik az
mTORC1-jelközvetítés. (→mTOR)
RNS-felismerő mintázat*
RNA Recognition Motif, RRM (→RNS-kötő gomolyok)
rokonmás átrendeződés homologous recombination a kereszteződés eredménye: kromoszómarészek
kicserélődése rokonmás kromoszómapárok között. Ennek következtében a kromoszóma
szerkezete átrendeződik. (→kereszteződés)
rokonmás átrendeződéses hibajavítás* homologous recombination repair, HRR (nevezik csupán homologous recombinationnek,
HR-nek is) a kétszálas DNS-törésnek a DNS épségét is helyreállító
egyesítése; a törés következtében leszakadt bázispárok maradéktalanul
kiegészülnek, szabályos, az eredetivel csaknem teljesen azonos DNS keletkezik.
Megvalósulásához a hiányzó bázisok másolódása szükséges a kiegészítő
testvérkromatidról.
A rokonmás átrendeződést az
ATM irányítja a CtLP megkötésével. Ha az ATM nem a CtLP-t köti, hanem a KU
fehérjéket, végegyesítés megy végbe.
A rokonmás átrendezés a
sejtkörnek csak S- és G2-szakaszában mehet végbe, mert a CtLP csak ebben a
szakaszban képes kapcsolódni, és a kiegészítő testvérkromatid is csak ebben áll
rendelkezésre. A sejtkör más szakaszaiban a végkivágást gátolja a Ku70/Ku80
fehérjekettős és más fehérjék, ezért jön létre ezekben végegyesítés. A
javításhoz a sejtkört az S-szakaszban meg kell állítani; ebben vesz részt a
CHP2 és a p53 fehérje. A rokonmás átrendezés tehát az S-, G2-szakaszban
végbemenő sejtválasz a kétszálú DNS-törésre; a törés tökéletes kijavítása.
RPA (replication protein A) az egyszálú
DNS-hez kapcsolódó legjelentősebb fehérje. Három alegységből (RPA2 [32 kDa],
RPA2 [14 kDa] és RPA1 [70 kDa]) tevődik össze. Hat OB-hajtékot (oligonucleotide/oligosaccharide binding) tartalmaz DNS-kötő
gomolyokkal (DBDs A-F [DNA-binding domains]; a DBD A, B, C, F az RPA1-en, a DBD
D az RPA2-n, a DBD E pedig az RPA3-on van); ezek kötik az egyszálú DNS-hez. Ha
a DNS-szál szabaddá válik, azonnal kapcsolódik hozzá, védi az elhajlástól,
másodlagos szerkezet kialakításától. A DNS-hez kötődve sokféle fehérjével
társulhat (p53, RAD51, ATRIP, ETAA1, BLM, WRN, SMARCAL1/HARP, XPA, XPG, XPF–
ERCC1), függően attól, hogy DNS-másolódás, DMS-átrendeződés vagy DNS-javítás
megy végbe. Ezekkel a fehérjékkel kölcsönhatásban toborozza a polimerázokat,
lehetővé téve a DNS másolódását, átrendeződését vagy a nukleotidok kivágását
(nukleotidkivágó javítás). Az RPA azonban részt vesz számos más folyamatban is,
mint magtestecsek rendeződése, génkifejeződés, végrészek védése stb.
R-pont restriction point, R point sejtellenőrzőpont, a sejtkör G1–S
átmenetének a vége felé van. A sejt az osztódási jelre csak a G1-szakaszának
második kétharmadában, tehát korlátozott ideig képes válaszolni, és eldönteni,
hogy véghezviszi-e a sejtkört. Ezt a korlátozott idejű szakaszrészt nevezzük
R-pontnak (restriction point [R
point]). Ha a sejt nem folytatja a
sejtkört, visszatér a nyugalmi állapotba.
RRM gomoly (
RNA Recognition Motif) (→RNS-kötő gomolyok)
sav acid hidrogéniont
(protont) átadó molekula; a vízben hidrogénionra (H+) és
savmaradékra (negionra [anion, negatív ion]) bomlik, a vízmolekulának protont
ad át (hidroxóniumion, H3O+).
általános sav minden olyan atomcsoport, amely megfelelő pH-n és
körülmények között protont ad le (általános savhatás).
erős, gyenge savak. Az erős savak vízben teljesen szétválnak (α = 1), a
gyengék nem teljesen (α <1). A savak erőssége a protont kötő képességükön
alapszik: az erős savak könnyen adnak le protont.
sav–bázis folyamat, semlegesítés acid-base reaction, neutralization a savak és bázisok egymás közötti folyamata, egymást
közömbösítik: só és víz keletkezik. (→vegyfolyamatformák)
sav–bázis hatás proton leadás-felvétel, proton- (H+)
mozgatás. Pl. valamely enzim hatóegysége viselkedhet
▪ savként,
és protont ad a vegylethez (általános savhatás). Ehhez az szükséges, hogy
valamelyik aminosavának (szokásosan arginin, lizin, ritkábban hisztidin)
oldallánca többletprotont tartalmazzon (pozitív töltésű legyen).
▪ Viselkedhet bázisként, ekkor protont
vesz fel (általános bázishatás), ehhez protonhiányosság kell.
Egyes enzimfolyamatokban
mindkettő – protonadás és protonfelvétel – lejátszódik. Előfordul az is, hogy
protont szállít az egyik vegyületről a másikra.
sejtlégzés cellular respiration a sejtek energianyerése elektronátmenettel, és az
energia elraktározása ATP-ben. A sejtek ugyanis bizonyos anyagok
elektronleadással (égetés, oxidation) történő átalakításával képesek energiát
nyerni, amelyet az ADP-nek ATP-vé alakítására használnak fel. Nevezik a
sejtlégzést biológiai égetésnek (biológiai elektronledásnak)
is, illetve elektronleadásos foszforilezésnek (oxidative
phosphorylation), mivel az elektronleadásból nyert energiából az ADP
foszforileződik ATP-vé.
A sejtek szokásosan a glükóz (szőlőcukor, C6H12O6)
elektronleadással járó lebontásából keletkező energiát használják az ATP
előállítására oxigén felhasználásával, miközben – végtermékként – széndioxid és
víz keletkezik:
C6H12O6 + 6 O2
→ 6 CO2 + 6 H2O + energia (ATP)
A széndioxid a kilégzéssel távozik; a víz a sejtben
hasznosul, az energia az ADP–ATP átalakulásban használódik fel.
■ A
sejtlégzés az energiatermecs belső hártyájában megy végbe, szorosan kapcsolódva
a hártyaközi térrel és az alapállománnyal; elektronszállítók részvételével.
■ A
sejtlégzés vegyfolyamata – rendre a cukor vízzé és széndioxiddá alakítása –
négy lépésből áll; úgy mondjuk, hogy a sejtlégzésnek négy szakasza van:
▪ Első a cukorbontás (glikolízis): a szőlőcukor
(glükóz) bontása piruváttá.
A szőlőcukor bontásának folyamatában 1 molekula
glükózból 2 molekula piruvát lesz, miközben 2 NADH és 2 ATP keletkezik.
(→glikolízis)
▪ A második a glükóz bontásából származó piruvát átalakulása
acetil-KoA-vá az energiatermecs alapállományában.
Ehhez a piruvátnak a sejtplazmából be kell jutnia az
energiatermecsbe: a 3 szénatomos piruvátból 2 szénatomos acetát keletkezik,
amely szállítóval, a koenzim-A-val (KoA) kötődik (acetil-KoA) egy enzimhármas,
a piruvát-dehidrogenáz együttes közreműködésével. A levált szénatom CO2
formájában a kilégzéssel távozik. A folyamat elektronleadással jár. Az
elektront a NAD+ veszi fel, NADH +H+ keletkezik. Az
acetil-KoA csatlakozik a citrát-körhöz, társul az oxálacetáttal.
▪ A harmadik szakasz a citrát-kör (Krebs-kör,
Szent-Györgyi–Krebs-kör), amely energiatermelő körfolyamat, az
anyagcsere-folyamatok sokaságában vesz részt, az energiatermecs
alapállományában megy végbe. (→citrát-kör)
▪ A negyedik szakasz a végső elektronleadás* (terminal oxidation), amelyben a sejtlégzés
első három szakaszában keletkezett NADH + H+ és FADH2
társenzimek által kötött elektronok energiájának közvetett felhasználásával az
ADP foszforileződik, ATP keletkezik.
■ A
vegyfolyamatban az ATP-szintáz és a légzési lánc (elektronszállító lánc,
electron transport chain, ETC) vesz részt.
A légzési láncot az energiatermecs belső hártyáján
átnyúló fehérjeössztesek alkotják. A hártyaátjáró fehérjeössztesek az
energiatermecs alapállománya és hártyaközi tere között létesítenek
összeköttetést; I, II, III és IV római számmal jelöljük.
- A fehérjeössztes I a NADH–KoQ-reduktáz, más
néven NADH-dehidrogenáz (NADH:ubiquinone oxidoreductase) vas-kén
központot tartalmazó, elektronfelvevő-átadó teleenzim; NADH-t kötő KoQ-reduktáz.
Átnyúlik a belső hártyán. A NADH-ból elvon két elektront, NAD+ és H+
(proton) keletkezik. A folyamat az energiatermecs alapállományában zajlik. A
felszabaduló energiával az enzim a H+-t (protont) átjuttatja a
hártyán a hártyaközi térbe. A 2 elektront az enzim társenzime, az ubikinon (KoQ10)
veszi fel két H+-al együtt, így KoQH2 (ubikinol) jön
létre.
- A fehérjeössztes II a szukcinát–KoQ-reduktáz,
más néven szukcinát-dehidrogenáz (succinate:ubiquinone oxidoreductase)
kicsi, négy alegységes teleenzim egy FAD és három vas-kén tartozékcsoporttal. A
fehérjeössztes II a belső hártya belső részében van, kisebb részével az
alapállomány felé néz, köti a citrát-körben lévő szukcinátot, és elvon belőle
két elektront, így a szukcinát fumarátá alakul. Az elektronokat a FAD köti,
amelyből még két proton felvételével FADH2 keletkezik. A FADH2 elektronjai
az enzimben szintén az ubikinonra (KoQ10) tevődnek át; ubikinol
(KoQH2) keletkezik. Az ubikinont az enzim köti (az enzim vegylete),
így kerül kapcsolatba a FADH2-vel. A szukcinát-dehidrogenáz
nem juttat H+-t át a hártyán.
- A fehérjeössztes III a KoQH2–citokróm-c-reduktáz,
más néven ubikinol–citokróm-c-reduktáz (ubiquinol:cytochrome c
oxidoreductase) háromféle hemet és egy vas-kén központi részt tartalmaz, 11
alegységből áll. Kettőst alkotva hidalja át a belső hártyát. A citokróm-b
alegységei veszik át az elektronokat KoQH2-től (ubikinoltól), és
teszik át egyesével a citokróm-c-re, a citokróm-c1 alegységük közreműködésével.
A fehérjeössztes III, a fehérjeössztes I-hez hasonlóan, H+-t juttat
a hártyaközi térbe.
- A fehérjeössztes IV a citokróm-c-oxidáz (cytochrome c
oxidase) 13 alegységből és sajátos oxigénkötő helyből áll. Csak két alegységnek
van tevékeny központja; az egyikben két rézion alkotja (Cua) a
központot. Ez veszi át a fehérjeössztes III-tól a citokróm-c által szállított
elektront, amely a hem-A-ra (citokróm-A) jut, onnan pedig az oxigénkötő
helyhez. Ez az egyetlen a négy fehérjeössztes közül, amelyik az elektront az
oxigénnel tudja társítani. A fehérjeössztes IV szintén átjuttatja a H+-t
a belső hártyán a hártyaközi térbe.
Mindegyik elektronátadás során jelentős energia válik
szabaddá, amelyet fehérjeössztes I, III és IV a H+ belső hártyán
való átjuttatására használ fel az alapállományból a hártyaközti térbe, vagyis a
protonátjuttatáshoz szükséges energia az elektronátmeneti folyamatokból származik.
A fehérjeössztes I és III két-két elektron
áthaladásakor becslések szerint négy-négy protont (H+) juttat a
hártyaközi térbe. A fehérjeössztes IV a négy elektron oxigénnel társításakor
pedig négyet. Ezért, ha a két elektron a NADH-ból adódik le, 10 H+,
ha FADH2-ból, akkor hat H+ átjuttatásával számolunk, az
utóbbiban ugyanis a fehérjeössztes I nem vesz részt.
■ A
sejtlégzésben 1 molekula glükózból a legkedvezőbb esetben (elméleti szinten) 36
ATP és két GTP keletkezik, ez utóbbiak szintén ATP-vé alakulnak:
▪ Két ATP képződik a glikolízis C6-szakaszában,
amelyben kialakul még 2 NADH + H+ is;
a C3-szakaszában (AcKoA-képződés), vagyis a
piruvát acetilcsoporttá alakulásában szintén 2 NADH + H+ jön létre.
▪ A citrát-körben 2 GTP, 6 NADH + H+ és 2
FADH2 keletkezik egy glükózból kiindulva.
▪ A NADH + és a FADH2 által
hordozott elektronok energiájából a végső elektronleadásban ATP képződik.
Egyetlen NADH + H+-révén körülbelül 3 ATP, egy FADH2
révén pedig 2 ATP formálódik. Összesen 10 NADH + H+ és két FADH2
képződött; ezekből tehát 34 ATP jön létre. Ehhez adódik hozzá a glikolízis
során termelt 2 ATP.
■ A sejtlégzés a magvas sejtek egész anyagcseréjének, a
sejt létezésének alapvető energiaforrása. Nélküle nincsenek élő magsejtűek.
Izom- és vörösvértestekben, valamint sejtártmányban oxigénfüggetlen ATP-képzés
is végbemehet, de ez csak rövid ideig tartja életben a sejtet, másrészt csak
akkor, ha más sejtek besegítenek, pl. a tejsavas erjedés során felszaporodó
laktátból elektront vonnak el a sejtlégzési folyamatukban.
SI (Système
international d’unités, International System of Units) →mértékegységrendszer
SPEN (spen family transcriptional
repressor) (egyéb elnevezése: SHARP)
DNS-kötő, a géneket némító, sokgomolyos fehérje; az X-kromoszóma némításának
meghatározó molekulája. Négy RNS-felismerő mintázata, magjelfogóval kapcsolódó
gomolya és 3’-végi fehérjéket kötő gomolya (SPOC [SPEN paralogue/orthologue
C-terminal domain]) van. Kromatint módosító gomolya nincs. RNS-ekkel
kölcsönhatásban, társnémítók kapcsolásával némítja a géneket.
SRP (signal recognition particle) jelzésfelismerő szemcse* törzsökös ribonuklein-fehérje,
amely a sejtplazmában képződő, de hajtákolásra a plazmahálózatba viendő polipeptideket
(együt a ribofordaccsal) szállítja plazmahálózat hártyájához. Felismeri a ribofordacsban
átfordítódó polipeptid első 20–30 aminosavát tartalmazó jelzéssorát* (ez
jelzi, hogy a polipeptidnek a plazmahálózatba kell kerülnie), és kötődik hozzá.
Felfüggeszti a polipeptid képződést, amíg kapcsolódik a plazmahálózat hártyáján
lévő jelfogójához, majd összeköti a jelzéssort a hártyán lévő, áteresztő rést
képző (hydrophilic membrane
pore) állványfehérje-együttessel
(translocon). (→fehérjeképződés, plazmahálózat, ribofordacs, RNS)
sugárkezelés (besugárzás) radiotherapy, radiation therapy,
irradiation betegség kezelése ionizáló
sugárzással. Formáit alkalmazási és tervezési módja szerint különítjük el.
érintett mezős besugárzás* involved-field radiation therapy (IFRT) a
daganatos területek együttes besugárzása. Nem sugarazzuk azokat a területeket,
amelyeken a daganatsejtek (pl. nyiroksejtdaganatokban) előfordulhatnak, de a
kezeléskor épek. (→kiterjesztett mezős besugárzás)
erősségmódosító besugárzás* intensity-modulated radiotherapy (IMRT) a
céltérfogatra szabott külső sugárkezelés korszerű formája, melyben néhányszor
(~1-4-szer), alkalmanként nagyobb (~8-10 Gy) sugármennyiséget adunk rendkívüli
pontossággal a daganatra; a szegélyező ép szöveteket alig éri sugárhatás. A
nagyobb sugármennyiség közvetlenül pusztítja a daganatot, ezért nevezik sugársebészetnek
(radiosurgery) vagy ablative treatmentnek – magyarul daganatirtó*
sugárkezelésnek.
A szokványos térfogatformált
sugárkezeléstől még két dologban tér el: nem egynemű ionizáló sugárzással
kezelünk, és fordított a tervezése (→sugártervezés). A különböző erősségű
nyalábokból álló besugárzással rendkívüli pontossággal lehet a sugármennyiséget
irányítani a szövetek szerint (elváltozás, ép szövet). A sugárkibocsátás
történhet álló forrásból, valamint a test körül mozgó forrásból (réteges
besugárzás, tomotherapy). A sugárzás formája szerint lehet:
• mennyiségváltozó* (dynamic). A forrás volfrám sugárirányítókkal, számítógépes
ellenőrzéssel adja folyamatosan az egyes pontok szerinti megkívánt különböző
mennyiséget.
• területirányított*. A besugárzási mezőt számos kis területre bontva sugarazunk. A
sugárforrás sugárirányítókkal pásztázza a mezőt lépésről lépésre, és amikor
beállítja a területet, bekapcsol, leadja a szükséges sugarat, majd lép a
következő területre és ismét sugaraz stb. (lép és sugaraz, step-and-shoot).
• térrögzítéses* (intensity modulated stereotactic radiotherapy,
erősségmódosító térrögzítéses sugárkezelés). A kezelés alatt felvevő figyeli a céltérfogatot,
és irányítja az egyenes gyorsító robot karját; ez sugaraz megszakításokkal
területirányított módon, vagyis lépésről lépésre. Amikor a felvevő azonosítja a
területet, a robot leadja a kívánt sugármennyiséget. Elmozduló céltérfogatoknál
alkalmazható sugársebészeti eljárás, 6 cm-nél kisebb daganatok elpusztítására
alkalmas. Egyéb elnevezései: stereotactic body radiation therapy (SBRT),
stereotactic ablative body radiosurgery (SABR), CyberKnife (a gammakés
mintájára).
• íves (arc
therapy). Az egyenes gyorsító egymást fedő, kúp alakú sugárnyalábokkal a
besugárzási mezőt ívek formájában tapogatja, és jutatja a sugarat az egyes
pontokra szabályos időközönként. Alkalmazzák egynemű (intensity-modulated arc
therapy, IMAT) és nem egynemű (volumetric modulated arc therapy, VMAT))
sugárnyalábokkal is.
Előnyei: eredményesebben pusztítja a daganatot,
kevesebb a kiújulás, rövidebb a kezelési idő, a korai és késői mellékhatások
jóval ritkábbak és enyhébbek. A legjelentősebb hátránya, hogy a szervezetet ért
teljes sugármennyiség nagyobb, a keskeny szegély miatt kimaradhat daganatos
szél, ezért a tervezés rendkívüli pontosságot igényel, időigényes és bonyolult;
alkalmazásához a legkorszerűbb felszerelés szükséges.
egyidejűleg módosított, gyors besugárzás (simultaneous
modulated accelerated radiotherapy) két céltérfogatot kezelünk egyszerre, ezért
a kezelési idő lényegesen rövidül. A sugármennyiség eloszlása a besugárzott
területen meglehetősen egyenlőtlen, pl. medencei daganat sugárkezelésében a
daganatra 70 Gy, a nyirokcsomókra 50 Gy, a köztes és szegélyező ép szövetekre,
szervekre (belek, hólyag) pedig csupán néhány Gy sugármennyiség jut. Az
egyenlőtlenség színes felvételen bemutatva képszerű (mennyiségkép, dose-painting).
gyógyszerbesugárzás* chemoradiation gyógyszerekkel együtt adott
sugárkezelés (→gyógyszerbesugárzás)
hagyományos szakaszos külső besugárzás conventionally-fractionated external beam radiation therapy
(CFEBRT) kis
sugármennyiségek (1–4 Gy, szokásos: 1,8–2 Gy) sorozatos adása külső
sugárforrásból. A besugárzási mezőre naponta adjuk ezt az adagot, míg el nem
érjük a daganatpusztító sugármennyiséget. Elve: az ép szövetek a kis sugárhatás
okozta károsodásokat – szemben a nagyobbakkal – kiheverik a következő
kezelésig. A kezelés általában 3–4 hétig tart.
képirányított besugárzás* image guided radiotherapy (IGRT) változó,
elmozduló céltérfogat besugárzására alkalmazott módszer. Formái:
• Változó céltérfogat. A céltérfogat
alakváltozása szakaszos sugárkezelések második felében adódik, pl. a daganat
kisebbedik. A további kezelést a kisebb céltérfogatra számolva végezzük, tehát
a sugármennyiséget és irányítást stb. a céltérfogat változásainak megfelelően
módosítjuk a 3–4 hetes kezelés alatt.
• Elmozduló céltérfogat. A térrögzítéses
kezelések néhány formáját foglalja magában. (→térrögzítéses ~)
kiterjesztett mezős besugárzás* extended field irradiation/radiotherapy
azoknak a területeknek együttes besugárzása, amelyeket valamely daganat
elfoglalhat, például a nyiroksejtdaganatok. Magában foglalhatja azt a területet
is, amelyen a kezeléskor ugyan nincsenek daganatsejtek, de előfordulhatnak.
(→érintett mezős ~)
közelbesugárzás brachytherapy olyan besugárzás, amelyben a sugárforrás és a daganat
érintkezik, vagy csaknem érintkezik.
külső besugárzás external beam
radiation/radiotherapy a testen kívüli, bizonyos távolságra lévő forrásból származó egynemű
sugárzással végzett kezelés. Egyéb nemzetközi elnevezései: beam therapy,
external beam therapy, teleradiotherapy.
térfogatformált besugárzás* conformal radiation therapy CT-felvételekkel
pontosított céltérfogat alakjára formált, egynemű külső besugárzás. A formálás
számítógépes tervezéssel és sugárirányítókkal (collimators), kitakarásokkal
valósítható meg. A sugármennyiség zöme a céltérfogatra jut, de a környező
szöveteket is éri valamennyi sugárhatás – jóval kevesebb, mint a hagyományos
sugárkezelésnél, ezért a mellékhatások is ritkábbak, enyhébbek, de nem
elhanyagolhatók. Ez a szokványosan alkalmazott külső sugárkezelési módszer.
térrögzítéses besugárzás* stereotactic radiation therapy térben
rendkívül pontosan rögzített terület besugárzása. Egyszerre nagy mennyiségű
sugár juttatható a célpontra, általában daganatra, egy vagy néhány alkalommal.
A mennyiségesés igen meredek, így a környező szöveteket alig éri sugár. Körülírt
kisebb képleteket hatásosan pusztít, mellékhatásai elenyészők. A rögzítés az
egyszeri nagy sugármennyiség leadása miatt elengedhetetlen – ha ép szövetet ér,
maradandó károsodás keletkezik.
A céltérfogat elmozdulhat a beteg
megmozdulása vagy élettani mozgások miatt, Pl. tüdő, máj, vese stb.
helyzetváltozása a légzéssel, avagy a méhnyak, dülmirigy stb. elcsúszása a
hólyag, végbél hosszabb kezelési idő alatti telődése következtében. A beteg elmozdulásából
keletkező hiba megakadályozására a sugárforrást s testhez rögzítjük – a
sugárforrás is követi az elmozdulást; pl. agydaganatok kezelésénél a
sugárforrást valamilyen fejre szerelt kerettel rögzítjük (sugársebészet
[gamma-kés], radiosurgery).
Az élettani mozgások rögzítésnek
háromféle megközelítését (érzékelés, követés, gátlás) alkalmazzák.
• Érzékelés. A
kezelés alatt a mozgást (4D) CT figyeli, sugárleadás csak a nyugalmi (alig
elmozdulás) szakaszában van.
• Követés. Felvevő figyeli folyamatosan a céltérfogatot, és
irányítja a sugárzást ennek megfelelően.
• Gátlás. Lényegében a légzéssel járó kilengések csökkentése,
pl. a hasra tett nehezékkel.
Az érzékeléses és követéses eljárás képirányított és
erősségmódosító kezelési módszer (l. fent: erősségmódosító / térrögzítéses
besugárzás).
A nemzetközi irodalomban stereotactic a térrögzítéses
besugárzás javasolt elnevezése, de előfordul a stereotaxic és a thigmotactic
jelző is. A stereotaxis, stereotaxy jelentése: térrögzítéses sebészet (stereotactic
surgery). Hasonló a thigmotaxis értelmezése is.
A hazai irodalomban használják a
sztereotaxiás, szterotaktikus és a sztereosztatikus sugárterápia kifejezéseket
is – az összefüggés közöttük nem egyértelmű. A többféleség és a bizonytalanság
elkerülhető a magyar változattal.
sugártervezés radiation treatment
planning a kezelendő elváltozás
(céltérfogat) és a környező ép szövetek (sugárhatási terület) pontos
kijelölése, a besugárzási terület megállapítása, a besugárzási területre adandó
sugár mennyiségének, adagolási formájának és területi elosztásának a
meghatározása. Célja: a céltérfogat kapja meg az elpusztításához szükséges
sugármennyiséget, az ép környezete pedig a lehető legkevesebbet. Sugárkezelő
orvosok és fizikusok végzik
■ Hagyományos
tervezés (forward planning). Két formája van:
• Hagyományos mezős tervezés (conventional
planning). Képalkotó, általában
CT-vizsgálattal pontosítjuk a céltérfogatot, és háromirányú tervezési
módszerekkel (three-dimensional planning techniques) határozzuk meg a
besugárzási mezőt, amely általában valamely csontszerkezethez kötött, és
téglalap alakú. A módszer gyors és egyszerű.
• Térfogatformált tervezés* (conformal radiation planning) CT-felvételekkel
pontosított, a céltérfogat alakjára formált, számítógépes háromirányú tervezés.
Az egynemű külső besugárzást sugárirányítókkal, sugárelnyelőkkel (collimators)
és/vagy kitakarásokkal alakítjuk a céltérfogatnak megfelelően. Szemben a
hagyományos téglalap alakú mezős besugárzással, a céltérfogat alakjára
tervezzük a besugárzást.
■ Fordított
tervezés (inverse planning) meghatározzuk, hogy céltérfogat(ok)
mennyi sugarat kapjon, és mennyi az a legtöbb sugárhatás, amely a környezetét
érheti (mennyiség-előírás) – ennek alapján formáljuk a sugárnyalábok irányát és
mennyiségét. Nem egyenletes ionizált sugárzást alkalmazzunk, beamletek szerinti
módosításokkal. Pl., ha valamely pontra jutó sugármennyiség több a
tervezettnél, a sugár erősségét egy vagy két beamlettel csökkentjük. (→beamlet)
sugárzás radiation az atommag bomlásakor
kibocsátott részecske és/vagy energia. A
sugárzás erőssége az időegység alatt elbomló atommagok számától függ, minél
több bomlik, annál erősebb. Mértékét becquerelben (Bq), ritkábban a régi
egységében, curie-ben (Ci, régi egység) fejezzük ki. (→atommagbomlás, becquerel, curie).
súrlódás, súrlódási erő friction, friction force. A súrlódás két test érintkező felületének
kölcsönhatása. Oka a felületek érdessége és a felület atomjainak egymásra ható
vonzása. Súrlódás az álló felületek között is van, ezt nevezzük helyzeti
súrlódásnak (static friction).
A
súrlódási erő a súrlódást létrehozó erő, vagyis az az erő, amelyet a
felszín fejt ki a rajta elmozduló testre a mozgás akadályozására. Mindig az
elmozdulás ellen hat, az elmozdulással párhuzamos, de ellentétes irányú. A
testre ható erő hatására jön létre, tehát válaszerő*, önmagában nincs;
az érintkező felületek atomjainak kölcsönhatásából keletkezik, és arányos az
érintkező felületek érdességével: minél durvább a felület, annál nagyobb. Minél
simább a felszín, annál kisebb a súrlódás, de a „tökéletesen” sima felület is
kifejt súrlódási erőt. Függ még a felületek összenyomásától; minél nagyobb a
nyomóerő (Fny), annál nagyobb a súrlódás. A súrlódási erő független
a test alakjától, felületétől és sebességétől. A súrlódási erő jele: Fs (F
erő, s súrlódás) = a nyomóerő és a súrlódási együttható (μ) szorzatával:
Fny × μ = N × μ. (N newton).
A súrlódási erőnek két formája a helyzeti (static
friction, s) és a mozgási (kinetic friction, k) súrlódási erő. Az előbbi a
mozgás elindulását gátló erő; tapadási erőnek nevezzük, jele: Fs(t) (s
a súrlódásra, t a tapadásra utal). Az utóbbi a mozgásba jött tárgy
súrlódása, amelynek két formája van: a csúszási súrlódási erő (Fs(cs))
és a gördülési súrlódás (Fs(g)). A mozgási súrlódási erő mindig
kisebb, mint a tapadási súrlódási erő. Ha a testre ható húzóerő (Fh
– húzóhatás) nagyobb, mint a tapadási erő, a tárgy elmozdul (Fh>Fs(t)).
▪ A tapadási súrlódási erő, az Fs(t)
= Fny × μt (μt a tapadási súrlódási
együttható). Értéke a test elmozdulásának pillanatában a legnagyobb (Fs(t)max).
A test elmozdításához ennél nagyobb erő szükséges.
▪ A csúszási súrlódási erő, az Fs(cs) = Fny
× μcs (μcs a csúszási súrlódási együttható).
▪ A gördülési súrlódási erő, az Fs(g) = Fny
× μg (μg a gördülési súrlódási együttható).
súrlódási együttható coefficient of friction az érintkező felületek súrlódási kapcsolatának a
mértéke. Jele: μ (mű) = Fs / Fny (Fs a
súrlódási erő, Fny a függőleges nyomóerő). Fny = m
× g (m tömeg, g nehézségi erő; m × g a test súlya).
A μt a tapadási, μcs a csúszási és
μg a gördülési súrlódási együttható. Valamely felszínnek a helyzeti
és a mozgási súrlódási együtthatója különböző, az utóbbi mindig kisebb;
hasonlóan a gördülési együttható is kisebb, mint a csúszási; vagyis a μt >μcs>μg.
szálelcsúszás*
replication slippage, polymerase slippage a másolódó DNS-szál szemernyi
részének eltávolodása a polimeráztól. Előfordul ugyanis, hogy a másolódó szál
és a polimeráz a másolás közben eltávolodik egymástól, de csak egy
villanásnyira, mert a polimeráz azonnal újra kapcsolódik a DNS-szállal az eltávolodást
követően, avagy visszafelé az eltávolodás kezdete előtt. Ha az újratársulás az
eltávolodást követi, kimarad néhány bázis, legtöbbször egy vagy több ismétlet
másolódása, a másolt szálon kevesebb bázis (ismétlet) lesz (bázisvesztés). Ha
visszafelé társul ismét, egynéhány bázist (általában ismétletet) kétszer másol,
a másolt szálon több bázis (ismétlet) lesz (bázistöbblet). Ekként INDEL
keletkezhet, de nagyobb DNS-szakaszok is kettőződhetnek, törlődhetnek.
A DNS-polimeráz meglehetősen pontosan
másol; a hibaarány másolódásonként egy bázisra vonatkoztatva 10−5. A
hibát a polimerázzal társult exonukleázok (polymerase-associated 3 → 5·proofreading
exonucleases) azonnal javítják, ekként az arány 10−6–10−7-re
csökken. A még megmaradt hiba a párhibajavítással állítódik helyre; végül is a
hibaarány 10−9, vagyis a hiba rendkívül ritka, de mégis előfordul,
hogy belőle INDEL keletkezik – leginkább az ismétletekben létrejövő szálelcsúszásból
eredően. (→DNS-kettőződés)
szerkezeti azonmások*
constitutional isomers azonos atomösszetételű és molekulatömegű, de az atomok
kapcsolódásában (összekapcsolódási rendjében) eltérő molekulák. Másként: azonos
összegképletű, de különböző szerkezeti képletű vegyületek. A szerkezeti
azonmások fizikai tulajdonságai, pl. forráspontjuk, különbözik. (→azonmás)
lánc azonmások* chain isomers az atomok, szokásosan a szénatom
elágazásában és/vagy kötésükben eltérő azonmások. Pl.
sorrendi
eltérés:
n-bután:
izobután:
kötési
eltérés:
A
legegyszerűbb szénhidrogéneknek, mint metán (CH4), etán (CH3–CH3)
és propán (CH3–CH2–CH3), nincs azonmása, mert
a szén és hidrogének kapcsolódása csak egyféleképpen lehetséges.
 hatócsoportú
azonmások* functional (group) isomers
különböző hatócsoportot kapcsoló azonmások. Pl. az acetonban karbonil- (C=O), a
propanolban pedig hidroxilcsoport van.
hatócsoportú
azonmások* functional (group) isomers
különböző hatócsoportot kapcsoló azonmások. Pl. az acetonban karbonil- (C=O), a
propanolban pedig hidroxilcsoport van.
kötésváltó azonmások* tautomers csak a protonok és elektronok
elhelyezkedésében más azonmások. A kötésátalakulás voltaképpen protonáthelyeződés*
(prototropy): egy proton a molekula
egyik helyéről a másikra tevődik át, rendszerint az elektronok eloszlási
változásával, a mozgékony hidrogén áttevődésével és kötésváltozással jár. Ezek
egyféle kötésben eltérő vegyületek, amelyek könnyen átalakulnak egymásba. Együtt
vannak jelen, váltakozó egyensúlyi állapotban, és a vegyi folyamatokban szintén
együtt vesznek részt. A kötésváltásnak* (tautomerism) számos formája
ismert. Néhány gyakoribb:
 • oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→hatáscsoport, oxovegyületek)
• oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→hatáscsoport, oxovegyületek)
 • laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, a
gyűrűs savamidokra (laktámokra) jellemző a hidrogénátrendeződés a
gyűrűben lévő amidcsoporton belül. Az uracil
(pirimidin-2,4-diol) egyensúlyi folyamata:
• laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, a
gyűrűs savamidokra (laktámokra) jellemző a hidrogénátrendeződés a
gyűrűben lévő amidcsoporton belül. Az uracil
(pirimidin-2,4-diol) egyensúlyi folyamata:
• Egyéb kötésváltó azonmások: enamin–imin: H−N−C=C / N=C−C−H, nitrozo–oxim: H−C−N=O / C=N−O−H,
keten–inol: H−C=C=O / C≡C−O−H, foszfit–foszfonát: P(OR)2(OH) ⇌ HP(OR)2(=O), aminosav–ammonium-karboxilát (H2N−CH2−COOH / H3N+−CH2−CO−)
stb.
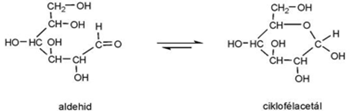 gyűrű–lánc azonmások* ring-chain isomers az azonmások egyike nyíltlánc, a másik gyűrűs. Olyan
aldehid-/ketocsoportot és OH-csoportot tartalmazó vegyületekben, például
szénhidrátokban fordul elő, amelyekben a proton áthelyeződésével a nyílt
vegyületből (láncforma) gyűrűs lesz, és fordítva. Az OH-csoport hidrogénje az
aldehidcsoportra vándorol, kialakítva a gyűrűformát. Az aldehidlánc utolsó
szénatomjához kettős kötéssel kapcsolódó oxigén helyett egyes kötéssel
OH-csoport társul. Az ábrán a glükóz (szőlőcukor) példája látható.
gyűrű–lánc azonmások* ring-chain isomers az azonmások egyike nyíltlánc, a másik gyűrűs. Olyan
aldehid-/ketocsoportot és OH-csoportot tartalmazó vegyületekben, például
szénhidrátokban fordul elő, amelyekben a proton áthelyeződésével a nyílt
vegyületből (láncforma) gyűrűs lesz, és fordítva. Az OH-csoport hidrogénje az
aldehidcsoportra vándorol, kialakítva a gyűrűformát. Az aldehidlánc utolsó
szénatomjához kettős kötéssel kapcsolódó oxigén helyett egyes kötéssel
OH-csoport társul. Az ábrán a glükóz (szőlőcukor) példája látható.
szétterjedés diffusion
(diffúzió)1. Molekulák behatolása és eloszlása másik anyagban. 2.
Molekulák hőenergiájuk szerinti eloszlása folyadékban.
szétalakulás*
denaturation (of proteins) a fehérjék
(nagymolekulák) természetes állapotának (térszerkezetének) megváltozása a
gyenge kötések felszakadása miatt. Következménye a biológiai működés
megszűnése, pl. enzimeknél. Előidézhető hővel, fizikai behatásokkal (rázás
stb.), pH-módosításokkal, vegyszerekkel. Az alapszerkezet, az
elektronkötésekkel létrehozott összetétel, változatlan marad. A folyamat
legtöbbször visszafordíthatatlan, máskor – a kiváltó hatás megszűnésével –
visszaáll a természetes állapot, pl. hemoglobin, szérumalbumin, ribonukleáz
esetében.
szétválás denaturation (of DNA) a kettős DNS-szál, illetve a kétszálú
RNS szálainak elválása egymástól a hidrogén- (gyenge) kötések felszakadása
miatt. Általában visszafordítható, élettani folyamatként is előfordul, pl.
DNS-kettőződés.
TANGO1
(transport and Golgi organization protein 1) (más néven MIA3 – MIA Src homology 3 (SH3) domain ER export factor 3) a
plazmahálózat küldőhelyén lévő jelfogó, nagy molekulákat (pl. kollagén) köt,
nagy szállítmányokat hoz létre. Köti a HSP47-et, amely a prokollagén
dajkafehérjéje; ennek következtében a prokollagén kapcsolódik a COPII-vel
(burokfehérje-összlet-2), és elkezdődik a burokképződés.
A
szokványos COPII-burok nem elegendő a nagy prokollagén burkolására. A nagyobb
hólyagcsa keletkezését a TANGO1 teszi lehetővé: olyan molekulákat köt, amelyek
korlátozzák a SAR1 GTPáz tevékenységét. Ennek következtében a COPII gyűrűs
szerkezetűvé válik, lehetővé téve a burok növekedését, a prokollagént
tartalmazó nagy hólyagcsa kialakulását. A TANGO1 hasonlóan segíti más
nagymolekulák, pl. lipidszemcsék (very low-density lipoproteins) beburkolását
is.
A
TANGO1 – gyűrűs COPII kettőshöz a Golgi felszínéről kiválasztódó mucin kötődik,
kialakítva kapcsolódást a plazmahálózat és Golgi között. A TANGO1-nek szerepe
van a sejtkívüli állomány és a csontok formálásában is.
tapadófehérjék cell
adhesion molecules, CAM a sejthártyába
beépült hártyafehérjék, amely összekapcsolódnak a szomszédos sejtek hártyájába
épült kapcsoló fehérjével. A két sejten lehet egyforma (azonkapcsolódás*) vagy
más kapcsolófehérje (máskapcsolódás*). Egy-egy sejt felszínén sok ilyen tapadó
fehérje van; együttesen erős kötést hoznak létre; egyesével gyengék. A sejtek
tapadó fehérjéi nem állandóak: változnak a sejtek fejlődésével és
tevékenységükkel sajátos igények kielégítésére.
A tapadó fehérjék időleges vagy tartós összetapadást
létrehoznak azonos sejtekkel, például hámsejtek egymással, avagy azonos formájú
sejtek egymás között, például, hám, sima és szívizom, ideg), de a
környezetűkkel is. Ezeket a kapcsolódásokat nevezzük sejttapadásnak (cell
adhesion, sejtadhézió); ennek eredményeként sejtkötelékek jönnek létre.
A sejtközi állomány sejtjeivel való tapadás az állomány
szerveződésének elemi része (sejt–sejtközi állomány tapadásnak mondjuk).
Többféle tapadó fehérje van, nagy csoportokat alkotnak.
A legjelentősebbek: kadherinek, integrinek, immunglobulinok nagycsaládjába tartozók,
szelektinek.
telomere position effect
→végrészhatás
tényező factor 1. Valamely rendszer összetevője, meghatározója;
részese a tevékenység eredményének, pl. véralvadási tényező: szerepe van a
véralvadék létrejöttében. A vegytanban sokszor nem besorolható molekula nevének
része, pl. a véralvadási tényező a véralvadásban részt vevő fehérje, pontos
besorolás nélkül. 2. A fizikában egységfüggetlen szorzószám, hányados, viszony
vagy arány neve. Pl.: az A = k • B összefüggésben k neve tényező,
ha A (mennyiség) és B (mennyiség) azonos mértékegységű.
átalakítási tényező conversion factor olyan szorzószám, amely valamely mértékegységet másfajta mértékegységre
alakít: 60 perc = 1 óra – a szorzószám: 60.
nagyítási tényező, jele: x. Szövetmetszet nagyítása: x = képnagyság /
valós nagyság; pl. x40 = negyvenszeres nagyítás. (→állandó együttható, egységkiterjedés).
téralakzati azonmások configurational
isomers összetételükben és a kötési sorrendben is egyező, csupán
elektronkötésük körüli térszerkezetükben eltérő vegyületük. Egymásba csak
valamelyik elektronkötésük felbomlásával és új elektronkötés kialakulásával
alakulhatnak át; a kötések elfordulásával nem. A téralakzati azonmásoknak két
alapformáját, a tükörképi és a nem tükörképi azonmásokat különböztetjük
meg:
■ Tükörképi (térközponti) azonmások (enantiomers,
enantiomerek) egy vagy több térközpontot (térközponti szénatomot)
tartalmazó vegyület olyan két formája, amelyek egymásnak tükörképei, de fedésbe
– miként a jobb és bal kéz – nem hozhatók. Másképp: olyan molekulák, amelyeknek
velük fedésbe nem hozható tükörképi párja is van.
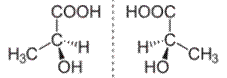 A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→térközpontiság)
A kétféle tükörképi azonmás megkülönböztetésére az R,
S betűt alkalmazzuk (R–S azonmásság*); és a szénatomhoz
kapcsolódó molekulák rangsora szerint határozzuk meg. A rangsort az atomok
rendszáma és kapcsolódási sora adja. A legkisebb rangja a legkisebb rendszámú
atomnak (H) van. A hatócsoportok rang szerinti sora: ─OCH3 > ─OH > ─NH2 > ─COOH > ─CHO >
─CH2OH > ─CH3 > ─H. Az atomok rang szerinti sorát a rendszámuk határozza
meg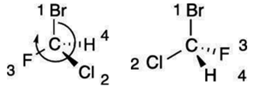 . A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
. A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
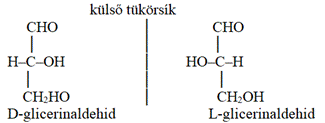 A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
■ Nem tükörképi azonmások* (diastereomers, diasztereomerek) egymásnak nem tükörképei, és egymással fedésbe sem hozhatók, fizikai és
vegyi tulajdonságaikban eltérők. Bennük a molekulák kapcsolódási rendje azonos,
egy vagy több nem kapcsolódó atom térbeli helyzete más. Kialakulhat egy vagy
több szénatom körül. Ilyenek a cisz–transz azonmások.
 cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
cisz–transz (Z–E) azonmások* (azon–ellentett azonmások*) cis–trans
isomers olyan nem tükörképi azonmásság, amely két kettős kötéssel kapcsolt
szénatomhoz csatlakozó atomok eltérő síkbeli viszonyából keletkezik. Ha a két nagyobb
tömegű hatócsoport a kettőskötéssel kapcsolt szénatomok azonos oldalán van, azon*
(cisz, egyoldali), ha ellentétesen kapcsolódik, ellentett* (transz,
kétoldali) helyzetről beszélünk. Pl. cisz-but-2-én (a metilcsoport, CH3,
egyoldali), míg a transz-but-2-énben kétoldali. Mint az ábrán is látható, ezek
nem tükörképei egymásnak.
A kétféle helyzet csak a kettőskötés
átmeneti felszakadásával és újraegyesülésével alakulhat át egymásba. A hatócsoportok
más térállása miatt különbözik az azonmások tulajdonsága, kölcsönhatása;
megváltozik az alakja. A kettő tehát más-más molekula; ez legtöbbször a
hagyományos nevükben is kifejeződik. (→cisz–transz)
A cisz–transz nevekkel
előfordulhat félreértés, ezért a IUPAC bevezette a szigorúbban szabályozott Z–E
rendszert, amely a szénatomokhoz kapcsolódó atomok/molekulák atomszámán
alapszik, és rangsort állít fel ennek alapján. Ha a rangsorban nagyobb értékű
molekula (példánkban a CH3, metilcsoport) ugyanazon oldalon van, Z
(zusammen), ha különböző, E (entgegen) betűt kap. Pl. (2Z)-but-2-én, illetve (2E)-but-2-én.
térhelyzeti azonmások*
conformational isomers, conformers, rotational isomers ugyanazon molekula egyszeres elektronkötése
mentén való elfordulásokból létrejöhető térszerkezeti változatok. Egymásba
könnyen átfordulnak. A térhelyzeti azonmások tehát az elektronkötések
felbomlása nélkül alakulhatnak át egymásba.
Ha az azonmásságot kialakító két molekula egyirányú, szün,
ha ellentétes, anti helyzetről beszélünk. Ezt nevezzük szün–anti
azonmásságnak. Pl.: a z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes.
z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes.
Az elforgatással az egyik (A) térhelzeti azonmás
átmenetformán (transition state) keresztül átalakul a másik (B) térazonmássá.
Az A és a B térazonmás helyi energiája a legkisebb, az átmenetállapoté a
legnagyobb. A forgatás az energiakülönbséget (energiagát*) küzdi le. Ha az
energiagát kicsi, a két térazonmás könnyen és gyorsan átalakul, szokásosan
mindkettő jelen van, váltakozó egyensúlyi állapotban. Ha az energiagát nagy, a
forgatás korlátozott, az átmenetalakzat tartósan jelen lehet külön
molekulaként; ezt a molekulát nevezzük átmeneti térazonmásnak*
(rotational isomer, rotamer). A hosszan megmaradó és ezért elkülöníthető
átmeneti térazonmást veszteglő térazonmásnak* (atropisomer) mondjuk.
térhelyzeti szabályozás*
allosteric regulation az enzimnek vagy más
ily módon szabályozható fehérjének a szabályozóhelyhez kapcsolódó molekula
által előidézett térhelyzeti változása, amely serkentheti vagy gátolhatja az adott
fehérje működését. A fokozást kiváltó molekula a térhelyzeti serkentő*
(allosteric activator), a gátlást okozó a térhelyzeti gátló* (allosteric
inhibitor) molekula.
A szabályozóhelyhez kapcsolódó molekula csak egy
irányban hat: vagy serkent, vagy gátol. Enzimek esetében a serkentés általában
a vegylet kapcsolódását mozdítja elő, pl. bizonyos enzimek hatáshelyét lefedi
az enzim egyik szerkezeti eleme, de amikor szabályozóhelyhez kötődik molekula,
a térszerkezet úgy változik, hogy a hatáshely szabaddá válik, és kötődhet hozzá
a vegylet. Előfordul az is, hogy hatóegység tevékenysége fokozódik (Vmax-érték
emelése). A gátlás szokásosan a hatáshely változásában nyilvánul meg (fedődhet,
változhat a térbeli illeszkedése), ezért az enzim nem képes megkötni a
vegyletet.
Az enzimek térhelyzeti szabályozása lehet:
• Visszaható
gátlás* (feedback inhibition), amely egy (vagy több együttműködő) enzim
hatására képződött termék és az enzim közötti kölcsönhatás eredménye. Ha a
termék mennyisége meghaladja a sejt szükségletét, a fölös termék a
szabályozóhelyhez kapcsolódva leállítja az enzim működését.
Jellegzetes a
visszajelzési szabályozás a többenzimes folyamatoknál: a folyamat végterméke
vagy valamelyik köztiterméke az első enzimhez kötődve fékezi az enzimsort.
• A vegyletes térhelyzeti szabályozás* (homotropic
allosteric regulation) a vegylet és az enzim közötti szabályozás: a vegylet
egyúttal szabályozhat is úgy, hogy a szabályozóhelyhez is kötődhet.
• Másmolekulás
térhelyzeti szabályozás* (heterotropic allosteric regulation) a
szabályozóhely és olyan molekula kölcsönhatása, amely nem a termék, de nem is a
vegylet. Ezt a szabályozómolekulát ezért nevezzük másmolekulának.
▪ Látszólag vetélkedő gátlás*, amely
azt jelenti, hogy az egyik kötőhelyhez kapcsolódó molekula kizárja a másik
kötőhelyhez való kapcsolódás lehetőségét. Ennek következtében, ha az enzim
szabályozóhelyéhez kapcsolódik molekula, az enzim nem képes megkötni a
vegyletet, elmarad az enzimhatás; vagy fordítva: a vegylet kapcsolódása
akadályozza a másikét. Azért nevezzük a vetélkedést látszólagosnak, mert a
molekulák nem ugyanazért a kötőhelyért versengnek.
A
fehérjék térhelyzetének megváltoztatása (conformational change) a sejtbiológiai
folyamatok egyik leggyakoribb szabályozási formája; a sejtműködés minden
formájában meghatározó. Sokszor láncszerűen zajlik, pl. a jelközvetítésben. A
jelközvetítés első enzime nem ritkán térhelyzeti szabályozó enzim, amely a
serkentő és gátló molekuláinak töménysége alapján érzékeli a környezeti
hatásokat, és indítja, gyorsítja, avagy éppen gátolja a jelközvetítést.
A láncfolyamat végterméke is visszahathat az első
enzimre: annak szabályozóhelyéhez kapcsolódva gátolja azt (visszaható gátlás);
így akadályozza meg, hogy feleslegesen sok végtermék keletkezzék. A láncszerű
jelközvetítés gyakorta kétirányú: előfordul, hogy valamelyik molekula, például
a végtermék, az egyik irányban gátol, a másikban serkent. Stb.
térszabályozó enzim allosteric enzyme térhelyzeti szabályozással
működő, avagy szabályozó térhelyzeti változást kiváltó enzim. Ilyen pl. a
G-fehérje-kötő jelfogó, amelynek a térszerkezete megváltozik a jelvivővel
kapcsolódva, és ez lehetővé teszi, hogy kötődjék hozzá és tevősödjék a
G-fehérje.
szabályozóhely allosteric site a
szabályozó molekula kapcsolódásának a helye, máshol van, mint a hatáshely, a
fehérjék harmadlagos szerkezete hozza létre. Ha a kötőhelyek más-más
polipeptidláncon vannak, a negyedleges térszerkezetnek is szerepe van a
szabályozásban. A kötődés a szabályozóhelyekhez ugyanolyan gyenge kötéssel jön
létre, mint a vegylet kapcsolásakor, tehát visszafordítható.
tetramerization
domain négyesítő gomoly négy fehérjét összekapcsoló gomoly. (→fehérjegomoly)
TFIIh (transcrition factor IIH, TFIIH) IIh-átírásfehérje törzsökös fehérjetömörülés; tíz polipeptidből álló,
gyűrű alakú, ~500 kDa tömegű fehérjeösztes kettős tevékenységgel:
▪ Általános átírást indító tényező a polimeráz-II
általi átírásokban. Ez az egyetlen olyan átírásössztes, amelyiknek
enzimműködése is van.
▪ Helikázössztesként vesz részt nukleotidkivágó
DNS-javításban (NER), de szerepe van a sejtkör szabályozásában is.
Két
nagy része a TF2H-mag és a CAK (CDK-activating complex).
▪ A TF2h-mag hét alegységből áll: tartalmaz két
ATP-függő, ellenkező irányú helikázt (XPB és XPD), valamint a p62, p52, p44,
p34 és p8 polipeptidet. Ez vesz részt a DNS javításában.
▪ A CAK a CDK7-kinázból (ciklinfüggő kináz), a
ciklin-H-ból (CCNH) és a MAT1-ből tevődik össze; Ennek van szerepe a
génátírásban. Pontosítja a DNS-hibát, helikázként bontja a hidrogénkötéseket, a
DNS-szálat az XPA, XPC és XPG fehérjékkel együttműködésben. A nukleotidkivágó
DNS-javításban nincs szerepe.
TFIIIa (transcription factor IIIA, TFIIIA) IIIa-átírásfehérje a polimeráz-III-at kapcsoló átírásfehérje, az 5S rRNS
átírását indítja. A cinkujj mintázatot tartalmazó fehérjék nagycsaládjába
tartozik. Kilenc cinkujj gomolya és egy különösen hosszú, ~52 bázispárnyi, DNS-t
felismerő bázissora van. Sajátos, hogy a DNS-hez és az RNS-hez is képes erősen kötődni.
töltésállapot polarization (polarizáció) 1. Részecskékben két atommag körüli
elektronok eloszlása. 2. A sejtekben az töltéses atomok eloszlása.
A töltésállapot lehet egyenletes és egyenetlen
eloszlású. Az egyenletes töltéseloszlású atom/molekula semleges (apolar, apoláris)
töltésű. Az egyenetlen töltéseloszlású atom/molekula negatív (-) vagy pozitív
(+) töltésű. A negatív vagy pozítív atomot/molekulát ionnak nevezzük.
(→ion)
Megkülönböztetünk
részpozitív és résznegatív töltésállapotot is. Ez az
elektonkötésekben résztvevő elektronokpár egyik atomtörzs irányába való
eltolódásából jön létre. (→elektronkötés) Azért részpozitív és résznegatív,
mert a töltésállapot kisebb, mint az, amely az ion létrejöttéhez szükséges. A részpozitív töltést δ+, a résznegatív
töltést δ- formával jelöljük.
▪ Kétsarkú töltésállapot (dipole
moment, dipólusmomentu) olyan töltésállapot, amelyben a részpozitív és a
résznegatív töltések súlypontja nem esik egybe. Két különböző
elektronegativitású atom között jön létre a kötő elektronpár eltolódása miatt. (→elektronkötés)
A molekula résztöltöttsége jelentősen
megváltoztatja a fizikai tulajdonságait és a vegyülőképességét. Az ellentétes
töltésállapotú molekulák vonzzák egymást.
▪ Nyugalmi töltésállapot a biológiában a sejtek ingermentes helyzetének töltésállapota.
(→idegsejt)
▪ Töltéscsökkenés* (depolarization, depolarizáció) a töltöttség mérséklése, megszüntetése. A biológiában a sejt környezetéhez
viszonyított negatív töltésének csökkenése.
▪ Töltésfokozódás* (hyperpolarization, hiperpolarizáció) a töltöttség mértékének növekedése; a sejt negatív töltésének fokozása.
▪ Töltésvisszaállás* (repolarization, repolarizáció)
az eredeti töltésállapot helyreállítása.
töltésingerület*
potential a biológiában az idegsejtek nyugalmi (ingermentes) töltésállapotának
(resting potential, nyugalmi potenciál) inger hatására bekövetkező
változása. Az inger lehet jelmolekula, fény-, hőhatás vagy a sejthártya nyomódása.
Két formája ismert: a helyi töltésingerület és az áramingerület.
helyi töltésingerület*
local potential a sejt nyugalmi
töltésállapotának megváltozása inger hatására az ingerérzékelés helyén. Az
idegsejt jelfogójához kötődő jelvivő (pl. acetilkolin) hozza létre
(ligand-regulated gate).
Veleje: inger hatására az ingerfelvétel pontján átmenetileg
megnyílnak a sejthártya jelfüggő Na-csatornái (ligand-gated Na-channels), és Na+-ionok
vándorolnak a sejtbe. Minél nagyobb az ingerület, annál nagyobb mértékben.
Ennek következtében csökken a sejthártyán kívüli és belüli töltésállapot
különbsége (depolarization, depolarizáció). Ellensúlyozására megnyílnak
a K-csatornák, és K+-ionok vándorolnak ki a sejtből. Amikor
megszűnik a sejt negatív töltése (0 mV) a Na-csatornák kezdenek záródni. A
csúcsértéket (~+30 mV; egyes sejtekben 0 mV, másokban 50 mV) elérve, mind
bezáródik, megszűnik a Na-ionok beáramlása.
A helyi töltésállapot-változás is terjed a
sejthártyán, de fokozatosan gyengül, ezért csak rövid távolságra (az
ingerérzékelés környékére) jut el. A helyi töltésingerület visszafordítható, az
inger megszűnésével helyreáll a nyugalmi töltésállapot.
Előfordul, pl. glicin hatására, hogy sejt
nem semlegesítődik, ellenkezőleg: fokozódik a negatív töltésállapota
(hyperpolarization, hiperpolarizáció), és érzéketlenné válik, gátlódik a
működése. A helyi töltésingerület tehát lehet serkentő vagy gátló; ez a
szabályozás alapvető az idegsejtek működésében.
áramingerület*
action potential (akciós potenciál) a
biológiában az inger hatására keletkező töltésváltozás elvezetése a sejt
felszínén (töltéshullám*). Feszültségfüggő ioncsatornák (voltage-gated ion
channels) megnyílásával keletkezik a sejtnek abban a részében, amelyben sok (μm2-enként
350–500) az ilyen ioncsatorna. Ez az ingerkeltő hely (trigger zone).
 Az áramingerület akkor követezik be, amikor a helyi
töltésingerület eléri a küszöbértéket (55 mV). Ilyenkor nyílnak meg a
feszültségfüggő Na- és a K-csatornák, hirtelen sok Na+-ion lép be a
sejtbe, a plazma jelentősen pozitívvá válik (vagyis lényegesen csökken a
sejtnek a környezetéhez viszonyított negatív töltöttsége – töltéscsökkenés), de
a sejt a K+-ionok kilövellésével helyreállítja a nyugalmi
töltésállapotot, fokozott negatív töltésállapotot hoz létre (töltésfokozódás).
A Na+- és a K+-ionok vándorlása a másodperc töredéke
alatt megy végbe.
Az áramingerület akkor követezik be, amikor a helyi
töltésingerület eléri a küszöbértéket (55 mV). Ilyenkor nyílnak meg a
feszültségfüggő Na- és a K-csatornák, hirtelen sok Na+-ion lép be a
sejtbe, a plazma jelentősen pozitívvá válik (vagyis lényegesen csökken a
sejtnek a környezetéhez viszonyított negatív töltöttsége – töltéscsökkenés), de
a sejt a K+-ionok kilövellésével helyreállítja a nyugalmi
töltésállapotot, fokozott negatív töltésállapotot hoz létre (töltésfokozódás).
A Na+- és a K+-ionok vándorlása a másodperc töredéke
alatt megy végbe.
A küszöbérték feletti hirtelen és jelentős
töltésváltozás végighalad az idegroston; ezt nevezzük áramingerületnek.
Ez visszafordíthatatlan. Jóformán minden áramingerület élettani hatást vált ki,
pl. váladékképződés, izom-összehúzódás.
tömegvonzás gravity, gravitation (gravitáció) két vagy több tömeg (test, részecske) között
fellépő vonzóerő a világmindenség bármely részén. Tehát nemcsak valamely tárgy
és a Föld közötti kapcsolat. Másként: két test olyan kölcsönhatása, amely
mindig vonzerőben nyilvánul meg. Jele: g.
tömegvonzási erő force of gravity a tömegvonzás nagyságát kifejező
erő, amely az egymásra ható testek tömegétől és a köztük lévő távolságtól függ.
Jele: Fg; egyenlő az egymásra ható testek tömegének a szorzata,
osztva a testek közötti távolság négyzetével, szorozva az egyetemes
tömegvonzási állandóval (G). A két test közötti vonzerő nagysága
mindkettőnél egyforma.
Newton tömegvonzási egyenletével: Fg = G ∙
(M1 ∙ M2 / r2); M1 az egyik,
M2 a másik test tömege; r a testek közötti távolság, G
az egyetemes állandó – tapasztalati érték = 6,67 ∙ 10-11 [N ∙ m2
/ kg2]; negatív érték). (→newton)
A Föld tömegvonzásánál az M1
a Föld tömege (5,71 • 1024 kg), M2 a
földön lévő test tömege, r a Föld sugara (középponttól a felszínig mért
távolság = 6,38 • 106 méter). A föld fölött lévő tárgynál az r + a
magasság a testek közötti távolság, ezért a tömegvonzási erő kisebb; a földtől
távolodva csökken. A tömegvonzás a Föld középpontjában = 0. (→nehézségi erő)
törékeny
X-társult előmásulásos állapot* fragile X-associated premutation condition
Az előmásulásos FMR1 gén által okozott betegségek közös elnevezése.
Előmásulásosnak
nevezzük az olyan ismétletbővülésű FMR1gént, amelyben 55–200 ismétlet van. Minél
több az ismétlet, annál kevesebb FMR1 fehérje képződik, és annál gyakoribbak,
kifejezettebbek a tünetek.
Háromféle betegség tartozik
közéjük:
törékeny-X-társult
elmezavarodottság fragile X-associated
neuropsychiatric disorder, FXAND
viszonylag újonnan (2018-ban) elfogadott különálló előmásulásos betegség;
tüneteit korábban a törékeny X-kromoszómával összefüggő egyéb betegségek
részének vélték.
A feszültállapot (anxiety)
és búskomorság (depression) a leggyakoribb megnyilvánulása. Fejlődési zavarok,
mint ASD (autism spectrum disorder) és ADHD
(figyelemhiányos túltevékenység, attention deficit hyperactivity disorder) –
hasonlóan a törékeny-X-betegséghez – ezekben az érintett gyermekekben is
előfordulnak, de jóval ritkábban és sokkal enyhébb formában; felnőtt korra
többé-kevésbé megszűnnek. Értelemcsökkenés nem jellemző, legfeljebb nagyon
enyhe; arányos az ismétletek számával: a >100 ismétletbővülés és csökkenő
FMR1 fehérje képződés eseteiben jelentősebb.
törékeny X-társult korai
petefészek-elégtelenség fragile
X-associated premature ovarian insufficiency, FXPOI a petefészkek 40 éves kor előtti kimerülése.
Vérzészavarok, fogamzásnehézségek és a korai változókor jellemzi. Legtöbbször
az FMR1 gén előmásulásos ismétletválzata okozza a fokozott mRNS képződés miatt
(mRNS-mérgezés). Ezekben az mRNS-ekben ugyanis bennük van a kóros
ismétletbővülés. (→FMR1-betegségek)
Az előmásulásos ismétletválzatot hordozó
nők 20%-ában alakul ki korai petefészek-elégtelenség. A törékeny-X-jellegek
(idegrendszeri és testi fejlődési rendellenességek) rendszerint nincsenek
jelen. A vérzés elmaradása az átlagosnál ~5 évvel korábban bekövetkezik,
legkorábban a 80–90 ismétletszámú válzatot hordozókban; valószínűleg azért,
mert náluk képződik a legtöbb mRNS.
törékeny X-társult remegéses mozgászavar fragile X-associated tremor/ataxia syndrome, FXTAS idősebb kori kezdetű, súlyosbodó mozgászavar
(rendezetlen, terpeszkedő járás) és célirányos mozgásra jelentkező, nagy
kitérésű remegés jellemzi. Társulhat viselkedési, emlékezési zavarokkal,
szellemi leépüléssel és sok más idegrendszeri tünettel, izomzavarokkal,
kimerüléssel stb. Képalkotókon a kisagyi fehérállományban láthatók eltérések.
Szövettani jellegzetessége az idegsejtek és a csillagsejtek (astrocytes)
magjában lévő zárványok.
Az előmásulásos FMR1 génről másolódó kóros
ismétletbővületet tartalmazó mRNS-ek sokasága okozza. Megváltozik az
átfordítódás: nem AUG kezdetűvé válik (repeat associated non AUG translation),
aminek következtében sokglicines végződésű FMR1 fehérje, FMRpolyG keletkezik.
Ezek ártalmasak, és az idegsejtek, csillagsejtek pusztulását okozzák.
(→FMR1-betegségek)
törlődés deletion a
genetikában olyan másulás (mutation),
amelyben egy gén vagy kromoszómarész elvész; gén- vagy kromoszómarész-hiány
keletkezik. A kromoszómahiány nem törlődés, hanem egy kromoszóma hiánya.
törlődés–beékelődés deletion-insertion,
DELIN több, egymásnak megfelelő nukleotid
(bázis) elvesztése, beékelődése, cseréje. Megváltoztathatja a keletkező RNS-t,
fehérjét. (A párosításhibás nukleotidokhoz semmi köze.)
Találkozunk
a nemzetközi irodalomban az INDEL (insertion-deletion) betűszóval; megegyezés
alapján már nem használjuk.
törzs phylum, division rendszertani
egység; állatoknál, maghíjasoknál phylum, növényeknél, gombáknál division
az angol neve. Az élőlények rendszertanában az ország (kingdom, regnun) és az
osztály (class) között van. A törzs felett a főtörzs (superphylum vagy superdivision),
alatta az altörzs (subphylum vagy subdivision) van.
transactivation
domain, TAD kölcsöntevősítő gomoly kölcsönhatást teremtő állványfehérje. (→fehérjegomoly)
translational
reading frame átfordítási
olvasáskeret (→olvasáskeret)
translational
reading frameshift olvasáskeret-eltolódás (→olvasáskeret)
túlmásulás hypermutation (→génmásulás)
tumor
mutational burden (TMB) →másulásteher
ubikvitinjelölés
(ubikvitinkód) ubiquitination,
ubiquitylation a
célfehérje társítása egy vagy több ubikvitinnel. A kapcsolódás elektronkötéssel
jön létre három enzim, az ubikvitinserkentő (E1), az ubikvitinkötő (E2) és az
ubikvitin-ligáz (E3) segítségével. A folyamat több lépésből áll:
▪ Az
első a sejtplazmában lévő tétlen ubikvitin tevősítése, ami kötőhely kialakítása
az ubikvitinben az E2 kapcsolódásához. Ezt az E1 enzim végzi: kötődik az
ubikvitinhez tioészterkötéssel, és foszforilezi ATP felhasználásával.(A
tioészterkötés az ubikvitin C-végi karboxilcsoportja és az E1 ciszteinjének
tiolcsoportja között jön létre.). E1-ubikvitin molekula keletkezik.
▪ A
második lépés az E2 enzim és az E1-ubikvitin kötődése. Az E2 az ubikvitin
kötőhelyéhez kapcsolódik, szintén tioészterkötéssel úgy, hogy az E1 és az
ubikvitin közti tioészterkötés áttevődik az E2-re, az E1 enzim pedig leválik;
E2-ubikvitin keletkezik.
▪ Az E3
ismeri fel a lebontandó fehérjét, és kapcsolódik hozzá. A célfehérjével társult
E3 kötődik az E2-ubikvitinhez, megint csak tioészterkötéssel, amely az E2 és az
E3 között alakul ki. Négy fehérjéből (E2, E3, ubikvitin és a célfehérje) álló
képződmény formálódik, amelyben az E2 és az E3 együtt segíti a célfehérje és az
ubikvitin fűződését izopeptidkötés létrehozásával. Ebben az ubikvitin C-végi
glicinének karboxilcsoportja kötődik a célfehérje N-végi lizinének az
ε-aminocsoportjával. (A célfehérje és az ubikvitin a kötésnél elágazik, az N
(nitrogén) α-helyzetű – ezért izopeptid a kötés.) (→peptidkötés)
Ritkán
az ubikvitin nem a lizin ε-aminocsoportjához, hanem az N-végi első
aminocsoporthoz (metionin) vagy a cisztein/szerin/treonin oldallánchoz kötődik.
▪ A második
ubikvitin az első ubikvitin megfelelő lizinjéhez kapcsolódik, szintén izopeptid
kötéssel. A következő ubikvitin a másodikhoz, az azutáni a harmadikhoz stb.
kötődik ugyan így; míg ki nem alakul a megfelelő számú ubikvitinlánc.
A célfehérjék az ubikvitin K6, K11, K27,
K29, K33, K48, K63 helyzetű lizinjével az N-végi metioninnal (met1) kötődhetnek,
függően az E2, E3 enzimektől, és a célfehérjétől. Így igen sokféle (a kapcsolt
ubikvitinek számában, kötődésében és kapcsolódási helyzetében eltérő) jelölési
alakzat jöhet létre. Ez teszi lehetővé, hogy az ubikvitinjelölés több nagyon
különböző sejtfolyamatnak is a tartozéka legyen. Pl. a fehértestecs a K48 vagy
a K11 helyzetű lizinhez kötődő négy vagy több ubikvitinnel kapcsolt fehérjéket
ismeri fel; a lebontandó fehérjék ezzel jelölődnek. (→fehérjebontás, fehérjetestecs)
A K63 helyzetű
lizinhez kapcsolt ubikvitinjelölés az immun-, a gyulladásos és a sejtburjánzási
jelzésfolyamatok irányítási módja; jelentős továbbá az önfalásban és a
DNS-hibák javításában is. Ezt a jelölést az UBC13 végzi, amely szokatlan E2
enzim, kettős képez az MMS2 vagy UEV1 fehérjével, ekként hatékony. Az
UBC13–MMS2 a DNS-hibák javításának, az UBC13–UEV1 a jelzésfolyamatok
szabályozója. Az ubikvitin K63 lizinjéhez ubikvitinlánc kapcsolódik, ez kötődik
a célfehérjével, szolgál kapcsolóhelyként a jelközvetítő fehérjéknek. Megjegyzés:
az ubikvitinjelölést hagyományosan a fehérjebontással társították; a fehérjék
„halál csókjának” (degradation tag) nevezték. Ma már tudjuk, hogy ez messze nem
így van.
újnemzedékes
bázispásztázás next generation
sequencing, NGS (→bázispásztázás)
változóan metilezett bázissor differentially methylated region, DMR olyan bázissor, amelynek metilezettsége szövet- és
sejtféleségenként, ugyanazon sejtek/szövetek különböző időszakában, válzatok
között, továbbá egyénenként is más, és amely részt vesz a génátírás
szabályozásában. A DNS leginkább a CpG-szigeteken metileződik; a változóan
metilezett helyek többnyire ezek közelében találhatók. A változóan metilezett
hely többféle: szövetfajlagos, rákfajlagos, válzatfajlagos, öregedésfajlagos
stb.
várandóssági cukorbaj gestational diabetes változó nagyságú vércukor-emelkedéssel
járó olyan szénhidrát-anyagcsere zavar, amely először a várandósságban
nyilvánul meg, avagy derül ki. A szénhidrát-anyagcsere zavarának bármely
formája lehet. Legtöbbször a 24–28. héten végzett szűréskor ismerjük fel. Akkor
beszélünk várandóssági cukorbajról, ha az éhomi vércukorérték 7+ mmol/l és/vagy
a kétórás terhelés 7,8+ mmol/l. Felismerése fontos, mert károsíthatja az anyát
és a magzatot is. A szülést követő 6–8. héten ellenőrző vércukorterhelést
végzünk. Az értékek lehetnek élettaniak, de maradhatnak kórosok is. Ezek az
asszonyok veszélyeztetettek, folyamatos ellenőrzést igényelnek.
Korábban terhességi
cukorbajnak nevezték, és ezt ma is gyakran mondják. Mióta a babát váró édesanya
jelzője várandós, állapotos stb., de nem terhes, a szénhidrát-anyagcserezavar
is várandóssági cukorbaj (terhességi cukorbaj).
végmásolási nehézség* end-replication problem a kromoszómák végrészi túlnyúlásának
a kettőződési akadályai (sok másodlagos szerkezet, sajátos hibák). Ezek ugyanis
útját állhatják a kettőződési villának. A nehézség az akadály ideiglenes
eltávolításával oldható meg. (→végrészkettőződés)
végrészhatás*
telomere position effect az a jelenség, hogy a végrész tömörödött kromatinja
távolhatású, a végrész alatti szakaszban is fékezi az átíródást.
víztaszító hatás hydrophobic
effect/interaction a víz és a vízbe
helyezett nem sarkos (apolar, résztöltéssel nem bíró) molekula közti
kölcsönhatás. A vízmolekulák a nem kétsarkú molekula köré zárványszerűen (clathrate-like
structure, cage) rendeződnek. Ez azt jelenti, hogy a határfelszínen a
vízmolekulák – miként a jégben – négy hidrogénhíddal egymáshoz kötődve szorosan
összekapaszkodnak, magukba zárva a nem sarkos molekulát, anélkül, hogy
kötődnének vele. Ha több nem sarkos molekula kerül a vízbe, azok összecsapzódnak,
egymáshoz közel kerülnek, csökkentve a vízzel érintkező felszínüket – gömb
alakúvá formálódnak. A víz tehát fokozza a nem sarkos molekulák összetartását.
Ezt nevezzük víztaszító hatásnak. Ez a magyarázata annak, hogy a fehérjék vizes
közegben gömbszerűvé válnak úgy, hogy a víztaszító aminosavak a gömb belseje
felé fordulnak (a fehérje magját képezik), a felszínt a vízkedvelők alkotják.
A víztaszító hatás érvényesül a töltésvegyes*
molekulákban is, vagyis az olyan összetett molekulákban, amelyeknek kétsarkú
(fejrész) és nem sarkos (apolar) része is van. Ilyen molekula pl. a koleszterin
és a foszfolipid. Ha a nem sarkos (víztaszító) rész kisebb, mint a sarkos, azaz
a fejrész, a molekula a vízben ék alakúvá válik. Ezek összeállva olyan gömbbé
formálódnak, amelyben a víztaszító rész belülre kerül – micella a neve,
magyarul →göbecs. Ha a nem sarkos rész nagyjából ugyanakkora, mint a fejrész, a
töltésvegyes molekulákból kettős hártya alakul ki. Két-két molekula úgy kerül
szembe egymással, hogy a nem sarkos részük van belül, egymással szemben, és
kapcsolódik. A vízkedvelő rész alkotja a felszínt, ez néz a vizes közeg felé.
Így alakul ki a foszfolipidekből pl. a sejthártya.
vizsgálat kettős jelentésű:1. kutatási
vizsgálat trial adatgyűjtéssel végzett, számmutatókkal értékelt tanulmány.
(→kísérletes vizsgálat, klinikai vizsgálat, népességi vizsgálat); 2. testvizsgálat
examination az emberi (állati) test vizsgálata műszerek, vérvétel,
vizelet stb. alkalmazásával, rendre betegség felismerésére. Ebben az értelemben
a vizsgálás, megvizsgálás szó nem alkalmazható.
vizsgálás, megvizsgálás examination megfigyeléssel, hallgatózással, kézzel, kopogtatással
stb. végzett testvizsgálat; szokásosan betegség megállapítására. Ebben az
értelemben a vizsgálat szó is mondható.
X chromosome inactivation center (XIC) →X-kromoszóma-némítási központ
X-kromoszóma-némítás X-chromosome
inactivation, lyonization az egyik
X-kromoszóma tevőtlenné tétele, átíródásának megakadályozása a testi sejtekben
az ébrény beágyazódását követően. A kromatinállomány tömör kromatinná
alakulásával megy végbe; a XIST (X-inactivation specific transcript) RNS végzi. A petesejtben
nem némul el az X-kromoszóma.
A némítás következtében az egyik X-kromoszóma génjei
nem fejeződnek ki, ezért – hasonlóan a férfiakhoz – a nőkben is csak az egyik
X-kromoszóma tevékeny. Néhány gén azonban kibújik a némításból, tevékeny marad.
Ezeket a nemzetközi irodalom escape genesnek nevezi, magyarul szökőgének*.
A szökőgének általában a karok végén helyezkednek el; a némított X-kromoszóma
ezen részeit áltesti szakaszoknak* (pseudo autosomal regions) nevezzük.
Az
áltesti szakaszok génjei jelen vannak mindkét nemi kromoszómán, ezért nőkben és
a férfiakban is két válzatuk van. Elengedhetetlenek a szabályos fejlődéshez.
Az
X-kromoszóma némítása nem állandósult állapot, megváltozhat, többnyire
szövetfajlagosan. Pl. az immunsejtek tevősödésekor az X-kromoszóma néhány
némított génje újra bekapcsolódik. Ez magyarázhatja az immunválaszok nemek
közötti különbségeit.
A némított X-kromoszóma összenyomódik, és a burkoló
XIST RNS-t, valamint a hozzákötött fehérjékkel együtt a Barr-testet alkotja; a
nyugalmi sejtmagban ekként látható.
Minden olyan sejtben, amely egynél több X-kromoszómát
tartalmaz, a második, harmadik stb. X-kromoszóma némul, tehát az XX-t
tartalmazó sejtekben egy, az XXX-t tartalmazó sejtekben kettő. A XIST RNS-t ez
a kettő képezi.
X-kromoszóma-némítási központ X chromosome inactivation center, XIC az
X-kromoszómának a saját némítást irányító része (cis-acting
region). Többnyire hosszú nem kódoló RNS-eket képező génekből és ismétletekből
áll; fehérjét kódoló gén alig van benne. Itt helyezkedik el többek közt az
X-kromoszóma némítását végző XIST gén (Xq13.2), az azt serkentő FTX,
JPX és RLIM gén (az utóbbi az RNF12-t kódolja), valamint a XIST-et
gátló TSIX gén.
zártömlő* inclusion
cyst a felszíni hám bezáródása a hámalatti szövetbe, például a
tüszőrepedéskor keletkező felszíni sérülésnél a hámsejtek vagy a sérülésbe
hullott méhkürthámsejtek bezáródása a petefészek állományába.
 ▪ A jelmolekula (pl. idegingerület-átadó, peptidhormon,
sejten kívüli jelvivők) kötődésekor a csatornafehérje (jelfogó) alakváltozása
következtében vagy foszforilezésre nyílik meg, majd ismét záródik a jelvivő
elválásával – ezt történhet fordítva is. Az átjárhatóság tehát átmeneti. A jelmolekula
(sejten kívüli vagy belüli jelvivő) az egyik alegységgel társul, távol az
ioncsatornától. Ezeken a csatornákon az ionok kizárólag a hártyán kívüli és
belüli töménységkülönbségüktől függően közlekednek ki vagy be, és nagyon
gyorsan: a másodperc töredéke alatt. Az ábra bal oldalán zárt, jobb oldalán
átjárható helyzetben látható egy sejtfali ioncsatorna vázlatosan; az utóbbi a
jelmolekula (piros négyzetecske) hatására vált nyitottá. (Az ábrát ML
készítette.)
▪ A jelmolekula (pl. idegingerület-átadó, peptidhormon,
sejten kívüli jelvivők) kötődésekor a csatornafehérje (jelfogó) alakváltozása
következtében vagy foszforilezésre nyílik meg, majd ismét záródik a jelvivő
elválásával – ezt történhet fordítva is. Az átjárhatóság tehát átmeneti. A jelmolekula
(sejten kívüli vagy belüli jelvivő) az egyik alegységgel társul, távol az
ioncsatornától. Ezeken a csatornákon az ionok kizárólag a hártyán kívüli és
belüli töménységkülönbségüktől függően közlekednek ki vagy be, és nagyon
gyorsan: a másodperc töredéke alatt. Az ábra bal oldalán zárt, jobb oldalán
átjárható helyzetben látható egy sejtfali ioncsatorna vázlatosan; az utóbbi a
jelmolekula (piros négyzetecske) hatására vált nyitottá. (Az ábrát ML
készítette.)

 ▪ Kereteltolódás*
(frameshift mutation) az
olvasáskeretnek egyetlen bázis beékelődése vagy kiesése miatti olyan másulása,
amelyben megváltozik az aminosavat kódoló bázishármasok sorrendje. Teljesen más
fehérje keletkezik, amely nyilvánvalóan nem alkalmas az eredeti fehérje
feladatának ellátására. Az ábra felső részén öt CAT bázishármas látható; öt
hisztidin keletkezik, és képződik tovább a polipeptid. Az alsó bázissorban a
második hármas után beékelődik egy adenin (A), és teljesen átalakul az
olvasáskeret: megváltoznak a bázishármasok. A harmadik hármas treonint, a
negyedik és ötödik szerint képez és így tovább. A képződő fehérje szerkezete
tehát egészen más lesz.
▪ Kereteltolódás*
(frameshift mutation) az
olvasáskeretnek egyetlen bázis beékelődése vagy kiesése miatti olyan másulása,
amelyben megváltozik az aminosavat kódoló bázishármasok sorrendje. Teljesen más
fehérje keletkezik, amely nyilvánvalóan nem alkalmas az eredeti fehérje
feladatának ellátására. Az ábra felső részén öt CAT bázishármas látható; öt
hisztidin keletkezik, és képződik tovább a polipeptid. Az alsó bázissorban a
második hármas után beékelődik egy adenin (A), és teljesen átalakul az
olvasáskeret: megváltoznak a bázishármasok. A harmadik hármas treonint, a
negyedik és ötödik szerint képez és így tovább. A képződő fehérje szerkezete
tehát egészen más lesz. ▪ INDEL (
in = insertion,
del
= deletion) magyarul bázistöbblet/bázisvesztés*, de egységesség kedvéért
az INDEL szóösszevonást alkalmazzuk. Megegyezés szerint az INDEL legtöbb 1 kb
hosszúságú (1–1000 bázispár) bázistöbblet/bázisvesztés. Helytelen rövid/hosszú
többletről/vesztésről (small/large indel) beszélni, mert a fogalom jelentése
szerzők szerint nagyon is eltérő. Ha szükséges, pontosítani kell a
törlődött/beékelődött bázisok számát. Az egyetlen bázispár
beékelődése/törlődése pontmásulás. Egyik formája a kereteltolódás. A bázisok
százait tartalmazó beékelődéseket/törlődéseket, például kromoszómaáthelyeződés/kromoszómamegfordulás,
szintén INDEL-nek nevezzük, mert nem külön másulási forma.
▪ INDEL (
in = insertion,
del
= deletion) magyarul bázistöbblet/bázisvesztés*, de egységesség kedvéért
az INDEL szóösszevonást alkalmazzuk. Megegyezés szerint az INDEL legtöbb 1 kb
hosszúságú (1–1000 bázispár) bázistöbblet/bázisvesztés. Helytelen rövid/hosszú
többletről/vesztésről (small/large indel) beszélni, mert a fogalom jelentése
szerzők szerint nagyon is eltérő. Ha szükséges, pontosítani kell a
törlődött/beékelődött bázisok számát. Az egyetlen bázispár
beékelődése/törlődése pontmásulás. Egyik formája a kereteltolódás. A bázisok
százait tartalmazó beékelődéseket/törlődéseket, például kromoszómaáthelyeződés/kromoszómamegfordulás,
szintén INDEL-nek nevezzük, mert nem külön másulási forma. A forrás rezgő töltés, amelyben a pozitív és a negetív töltés váltakozva
felfelé és lefelé mozdul el folyamatosan. Minden töltés körül elektromos tér
keletkezik. A töltés le-fel mozgása miatt az elektromos tér is mozog hullám
formájában. Amikor a pozítív töltés felfelé mozdul, a hullám emelkedik, amikor
lefelé, a hullám süllyed. A mozgó elektromos tér mágneses teret gerjeszt,
iránya az elektromos tér irányának változását követi. A mozgó mágneses tér
elektromos teret hoz létre, vagyis folyamatosan keletkezik elektromos és
mágneses tér, ezt nevezzük elektromomágneses térnek. Az energiafolyam pedig nem
más, mint az elektromágneses tereknek haránthullámok szerinti terjedése a
térben – azaz maga a tér terjed a haránthullámok tulajdonságaival. A kétféle tér
egymással hegyes szöget zár be, a terjedés iránya pedig merőleges a hullámokra.
Az ábrán az elektromos teret piros, a mágnesest a kék szín jelöli; ez maga az
elektromágneses hullám, illetve sugárzás. (Az ábrát Teleki Katalin készítette.)
Jellemzői a hullámhossz és a hullámgyakoriság (v).
A forrás rezgő töltés, amelyben a pozitív és a negetív töltés váltakozva
felfelé és lefelé mozdul el folyamatosan. Minden töltés körül elektromos tér
keletkezik. A töltés le-fel mozgása miatt az elektromos tér is mozog hullám
formájában. Amikor a pozítív töltés felfelé mozdul, a hullám emelkedik, amikor
lefelé, a hullám süllyed. A mozgó elektromos tér mágneses teret gerjeszt,
iránya az elektromos tér irányának változását követi. A mozgó mágneses tér
elektromos teret hoz létre, vagyis folyamatosan keletkezik elektromos és
mágneses tér, ezt nevezzük elektromomágneses térnek. Az energiafolyam pedig nem
más, mint az elektromágneses tereknek haránthullámok szerinti terjedése a
térben – azaz maga a tér terjed a haránthullámok tulajdonságaival. A kétféle tér
egymással hegyes szöget zár be, a terjedés iránya pedig merőleges a hullámokra.
Az ábrán az elektromos teret piros, a mágnesest a kék szín jelöli; ez maga az
elektromágneses hullám, illetve sugárzás. (Az ábrát Teleki Katalin készítette.)
Jellemzői a hullámhossz és a hullámgyakoriság (v).
 A belhártyán belül van az alapállomány (mitochondrial
matrix), amely fehérjében igen gazdag; ~1500-féle van, ezek zömét már
azonosították. 13-féle fehérjét az energiatermecs DNS-e képez, a többit – más
fehérjék közreműködésével – a TOM–TIM együttes (outer and inner mitochondrial
membrane translocation proteins) szállítja át a belső hártyán. Szép számmal
találhatók enzimek: a citrát-kör, a hemképződés, a zsírsavak lebontásában
szerepet játszó β-elektronleadási rendszer, a piruvát-dehidrogenáz-össztes
fehérjéi stb., valamint mRNS-ek, tRNS-ek, fehérjetermecsek, miRNS-ek, és ebben
találhatók az energiatermecs DNS-ei is. Az ATP képződéshez szükséges
foszforilező enzimössztes a belső hártya begyűrődéseiben van. A hártyaközi tér*
fehérjékben szegényebb, citokróm-C-t, sejtvégzeti enzimeket, antioxidánsokat,
elektron átadó-átvevő enzimeket tartalmaz.
A belhártyán belül van az alapállomány (mitochondrial
matrix), amely fehérjében igen gazdag; ~1500-féle van, ezek zömét már
azonosították. 13-féle fehérjét az energiatermecs DNS-e képez, a többit – más
fehérjék közreműködésével – a TOM–TIM együttes (outer and inner mitochondrial
membrane translocation proteins) szállítja át a belső hártyán. Szép számmal
találhatók enzimek: a citrát-kör, a hemképződés, a zsírsavak lebontásában
szerepet játszó β-elektronleadási rendszer, a piruvát-dehidrogenáz-össztes
fehérjéi stb., valamint mRNS-ek, tRNS-ek, fehérjetermecsek, miRNS-ek, és ebben
találhatók az energiatermecs DNS-ei is. Az ATP képződéshez szükséges
foszforilező enzimössztes a belső hártya begyűrődéseiben van. A hártyaközi tér*
fehérjékben szegényebb, citokróm-C-t, sejtvégzeti enzimeket, antioxidánsokat,
elektron átadó-átvevő enzimeket tartalmaz.
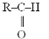 , karbonil
(keton)
, karbonil
(keton) 
 , észter
, észter  , foszforil
, foszforil 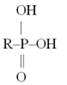
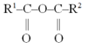 , vegyes savanhidrid
, vegyes savanhidrid 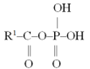 (pl. karbonsav, foszforsav, acil-foszfát) foszforsavanhidrid
(pl. karbonsav, foszforsav, acil-foszfát) foszforsavanhidrid 
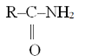
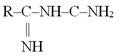 , imidazol
, imidazol
 , szulfonsav (R–C–SO3H),
diszulfid (R1–S–S–R2)
, szulfonsav (R–C–SO3H),
diszulfid (R1–S–S–R2) A Lugol-oldattal a hámszövet jódfestődését figyeljük,
amely mahagóni- (sötét-) barnától a halványsárgáig (jódnegatív) változhat, és
lehet egyöntetű vagy foltos, de az is előfordul, hogy jóformán még a nagyon
halványsárga elszíneződés sem jön létre. Az érett többrétegű laphám mahagóni-
(sötét) barnára festődik. Oka a közbenső sejtek széles rétege; a közbenső
sejtekben ugyanis sok a glikogén. A sorvadó, kóros, sérült többrétegű hám
világosan, sárgásan festődik. Az ábrán jól látható mahagónibarnára festődő ép többrétegű
laphám (kis
nyilak); élesen elüt
a jóddal nem festődő,
halványsárga kóros
elváltozástól,
amelyet jódnegatívságnak mondunk (vastag nyíl).
A Lugol-oldattal a hámszövet jódfestődését figyeljük,
amely mahagóni- (sötét-) barnától a halványsárgáig (jódnegatív) változhat, és
lehet egyöntetű vagy foltos, de az is előfordul, hogy jóformán még a nagyon
halványsárga elszíneződés sem jön létre. Az érett többrétegű laphám mahagóni-
(sötét) barnára festődik. Oka a közbenső sejtek széles rétege; a közbenső
sejtekben ugyanis sok a glikogén. A sorvadó, kóros, sérült többrétegű hám
világosan, sárgásan festődik. Az ábrán jól látható mahagónibarnára festődő ép többrétegű
laphám (kis
nyilak); élesen elüt
a jóddal nem festődő,
halványsárga kóros
elváltozástól,
amelyet jódnegatívságnak mondunk (vastag nyíl).



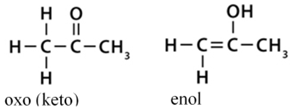 • oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→
• oxo(keto)–enol azonmásság*. Az α helyzetű szénatom hidrogénjének
áthelyeződése. Az oxovegyületekben egy oxigénatom kettős kötéssel kapcsolódik
egy szénatomhoz. Az enolformában OH-csoport kötődik telítetlen szénvegyülethez.
Az oxovegyületek előfordulhatnak
enolformában is (oxo–enol kötésváltás). Az oxoforma erősebb kötésű, és túlsúlyban van a kettő egyensúlyi
állapotában. (→ • laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő,
• laktim–laktám azonmások. Az α helyzetű nitrogénatom
hidrogénjének áthelyeződése: –N=C– / –N–C–;
a laktimban a szén kettős kötéssel, a laktámban egyes kötéssel kapcsolódik a
nitrogénhez. Gyűrűs vegyületekben fordul elő, 
 A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→
A tükörképi azonmások akkor keletkezhetnek,
ha a térközépponti szénatomhoz a négy különböző atom/atomcsoport (vegység) nem
azonos sorrendben kapcsolódik. A szénatomhoz kapcsolódó atomok/molekulák
egymástól azonos távolságra vannak, és az egymáshoz viszonyított szögük is
azonos, ezért a vegyi és a fizikai tulajdonságuk egyforma, kivéve, hogy kristályos
formájukban a síkban sarkított fényt (polarized light) ellenkezőleg forgatják
(ezért nevezik fényforgató azonmásoknak is), aminek következtében eltérhet a
biológiai hatásuk. Pl. a metilcsoport (CH3) a tejsav bal oldali ábráján
a szénatom negyedik kötéséhez, a jobb oldalin a második kötéséhez kapcsolódik.
(→ . A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.)
. A rangsor megállapításához
az 1., 2. és 3. rangú atomot/hatócsoportot vesszük figyelembe, és hogy azok
milyen irányban olvashatók össze. Ha az óramutató járásának megfelelően R
(rectus), ha ellenkezően, S (sinister) betűt teszünk a tükörazonmás neve elé. Pl. az ábrán lévő atomok közül a bróm a legnagyobb
rendszámú, tehát az 1. rangú. Ezt követi a klór (2. rangú), a harmadik pedig a
fluor. Az 1., 2. és 3. rangú atom összeolvasási
sorrendje: Br–Cl–F. Ez a bal oldali ábrán egyezik az óramutató járásával, tehát
R-előjelet kap. A jobb oldali ábrán ellentétes; ez tehát az S-előjelű. (Az ábra
a Fisher-ábrázolás szerinti; a vízszintes és a függőleges kötésvonalak
metszéspontja jelöli az α-szénatomot.) A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
A tükörképi, másként fényforgató azonmásságot
hagyománytiszteletből nevezik D–L azonmásságnak* (D/L enantiomerism) is.
Emil Fisher nevezéktana szerint a fényt balra forgatót L betűvel
(laevus), a jobbra forgatót D betűvel (dexter) jelöljük: L-téralakzat,
D-téralakzat. A tükörpár D- vagy L-formáját a glicerinaldehid egyik vagy másik,
D-nek vagy L-nek nevezett térszerkezetéhez viszonyítva határozzuk meg. A D-
vagy L-glicerinaldehiddel rokonságban lévő vegyületek térszerkezete
mindegyikben azonos. A D–L azonmások különböző biológiai tulajdonságú
molekulák. A gyakorlatban az R–S és a D–L azonmásság elnevezés is használatos,
a kettő azonos.
 z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes.
z adenozin szün helyzetében a cukor ötödik
szénatomjához kapcsolt OH-csoport és a gyűrűs molekula aminocsoportja (a két
molekularészlet nem kapcsolódik egymással) egyirányú, az anti
helyzetében ellentétes. Az áramingerület akkor követezik be, amikor a helyi
töltésingerület eléri a küszöbértéket (55 mV). Ilyenkor nyílnak meg a
feszültségfüggő Na- és a K-csatornák, hirtelen sok Na+-ion lép be a
sejtbe, a plazma jelentősen pozitívvá válik (vagyis lényegesen csökken a
sejtnek a környezetéhez viszonyított negatív töltöttsége – töltéscsökkenés), de
a sejt a K+-ionok kilövellésével helyreállítja a nyugalmi
töltésállapotot, fokozott negatív töltésállapotot hoz létre (töltésfokozódás).
A Na+- és a K+-ionok vándorlása a másodperc töredéke
alatt megy végbe.
Az áramingerület akkor követezik be, amikor a helyi
töltésingerület eléri a küszöbértéket (55 mV). Ilyenkor nyílnak meg a
feszültségfüggő Na- és a K-csatornák, hirtelen sok Na+-ion lép be a
sejtbe, a plazma jelentősen pozitívvá válik (vagyis lényegesen csökken a
sejtnek a környezetéhez viszonyított negatív töltöttsége – töltéscsökkenés), de
a sejt a K+-ionok kilövellésével helyreállítja a nyugalmi
töltésállapotot, fokozott negatív töltésállapotot hoz létre (töltésfokozódás).
A Na+- és a K+-ionok vándorlása a másodperc töredéke
alatt megy végbe.